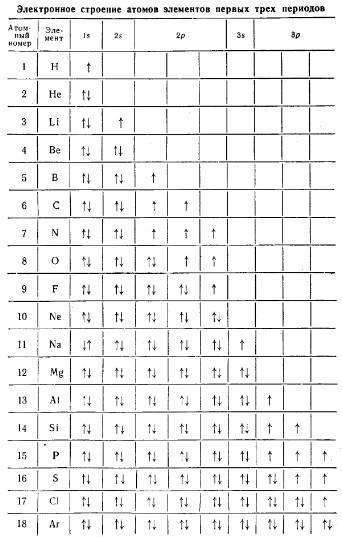
Что такое завершенный электронный слой
ОБЩАЯ ХИМИЯ
СТРОЕНИЕ АТОМА
Химические свойства элементов обусловливаются не всеми электронами, а только теми, которые имеют наибольшую энергию. Эти электроны называют валентными.
В атомах элементов главных подгрупп валентными е электроны внешнего энергетического уровня. Завершены внутренние энергетические уровни атомов существенно не влияют на их химические свойства. Число валентных электронов равно номера группы, в которой находится химический элемент. Например, атомы Водорода, Лития, Натрия и Калия, которые расположены в главной подгруппе i группы, имеют по одному валентному электрону, а атомы элементов главной подгруппы IV группы — Углерода и Кремния — по четыре.
Именно от числа валентных электронов зависит то, есть элемент металлом или неметалом, свойства его соединений и значение валентности в этих соединениях.
Если в атомах элементов на внешнем уровне небольшое число электронов (преимущественно от одного до четырех), то элемент проявляет металлические свойства, а если на внешнем уровне имеется более четырех электронов, то элемент проявляет преимущественно неметаллические свойства. Чем больше число электронов на внешнем уровне, тем более выраженные неметаллические свойства и меньше — металлические.
Со увеличением порядкового номера элемента в Периодической системе число валентных электронов периодически повторяется, что приводит к периодической смене свойств элементов и образованных ими веществ. Именно поэтому каждый период начинается с металлического элемента и заканчивается неметалічним.
В атомах переходных элементов ( d -элементов) на внешнем энергетическом уровне в основном содержится два электрона. Благодаря этому все переходные элементы относят к металлических. Все f — e крики так же относят к металлических.
Атомы, которые содержат на внешнем уровне число электронов, промежуточное между металлическими и неметаллическими (обычно это три-четыре), образуют амфотерные соединения.
Зависимость металлических и неметаллических свойств от строения внешнего электронного слоя
Завершены энергетические уровни, а также внешние уровни, которые содержат восемь электронов, имеют повышенную устойчивость. Именно этим объясняется химическая инертность гелия, неона и аргона: они вообще не вступают в химические реакции. Атомы всех других химических элементов пытаются отдать или присоединить электроны, чтобы их электронная оболочка стала устойчивой, при этом они превращаются в заряженные частицы.
Заряженный атом или группу атомов называют ионом. Различают катионы — ионы с положительным зарядом, и анионы — отрицательно заряженные ионы.
Рассмотрим щелочной металл Натрий — элемент главной подгруппы И группы. Натрий — активный металл, он легко горит на воздухе, реагирует не только с кислотами, но и с водой. Высокая химическая активность натрия объясняется наличием в его атомах одного валентного электрона. Теряя этот электрон, атом Натрия превращается на положительно заряженный ион Na + с электронной конфигурацией инертного газа Неона. Ионы Na + входят в состав всех соединений Натрия, например соды и поваренной соли. В отличие от атомов Натрия, ионы Натрия химически инертны и практически безвредны для организма. Весь Натрий, содержащийся в организме человека (приблизительно 90 г ), находится в виде ионов.
Чем большее число электронов содержится на внешнем электронном слое, тем сложнее их отдавать, поэтому с увеличением числа электронов на внешнем уровне (в периодах) металлические свойства элементов уменьшаются.
В атомах галогенов, которые образуют главную подгруппу VII группы, семь электронов на внешнем уровне. До его завершения им не хватает всего одного электрона, поэтому для них наиболее характерен процесс присоединения электрона. Так, атом Фтора, присоединяя один электрон, превращается в ион F — , что имеет электронную конфигурацию инертного газа и по химическим свойствам значительно отличается от простого вещества фтора, которая состоит из молекул F 2 .
Атомы других неметаллических элементов, так же, как и атомы галогенов, стремятся завершить внешний энергетический уровень путем присоединения электронов, потому что ионы с электронной конфигурацией инертного газа имеют повышенную устойчивость. Чем больше электронов не хватает до завершения электронного слоя, тем труднее их присоединять, ведь чем меньше электронов на внешнем уровне, тем слабее обнаружены неметаллические свойства.
Таким образом, металлические свойства обуславливаются способностью отдавать электроны, а неметаллические — способностью их присоединять. В периоде с увеличением порядкового номера металлические свойства уменьшаются, а неметаллические — растут. Каждый период начинается наиболее активным (среди элементов определенного периода) металлическим элементом, а в конце периода расположен наиболее активный неметаллические элемент (в группе VII) и инертный газ (в группе VIII).
Электронные конфигурации ионов можно вывести из электронных конфигураций атомов, добавив к них или отняв от них нужное число электронов. Например, электронная конфигурация атома Лития — 1 s 2 2 s 1 , а иона Лития Li + — 1 s 2 , что совпадает с конфигурацией атома инертного газа Гелия.
При образовании анионов дополнительные электроны занимают свободные орбитали. Например, конфигурация атома Хлора 1 s 2 2 s 2 2р 6 3 s 2 Зр 5 , а иона С l — — 1 s 2 2 s 2 2 p 6 3 s 2 Зр 6 , что совпадает с электронной конфигурацией атома инертного газа Аргона.
Радиус атома
Размер ядра атома по сравнению с размером атома очень незначительный, поэтому атомное ядро никоим образом не влияет на размер атомов. Радиус атомов полностью обусловливается размером электронной оболочки, а точнее — числом электронных слоев (энергетических уровней).
В атомов химических элементов одного периода число электронных слоев, что заполняется, одинаковое, ведь и радиус их атомов должно быть одинаковым. Однако в периоде с увеличением порядкового номера химического элемента заряд ядра последовательно растет. Электроны с увеличением заряда ядра притягиваются к нему сильнее, и поэтому в периоде радиус атомов уменьшается.
В главных подгруппах с увеличением порядкового номера элемента (сверху вниз) растет число занятых энергетических уровней. Именно поэтому радиус атомов химических элементов одной группы увеличивается.
Изменение радиусов атомов в группах объясняет изменение металлических свойств элементов одной группы. Чем дальше от ядра расположены валентные электроны (электроны внешнего энергетического уровня), тем меньше они притягиваются к ядру, ведь внешние электроны с увеличением радиуса легче отдавать, и это приводит к тому, что металлические свойства, которые обусловлены способностью элементов отдавать электроны, в группах возрастают. Одновременно неметаллические свойства элементов в группах с увеличением радиуса атомов (порядкового номера) уменьшаются. Металлические свойства, таким образом, наиболее ярко выраженные в нижнего элемента подгруппы, а неметаллические — у верхнего.
С учитывая изменения металлических свойств в периодах, можно утверждать, что среди всех химических элементов наиболее активным металлическим элементом является Франций (поскольку Франций в природе не обнаружен, а добытый искусственно ядерным синтезом, то среди существующих элементов наиболее активный металлический элемент — Цезий). А наиболее активный неметаллические элемента — Фтора.
Электроотрицательности химических элементов
Способность атома притягивать к себе валентные электроны других атомов называют електронегативністю. Сильнее всего притягивают электроны атомы наиболее активных неметаллических элементов — Фтора, Кислорода, Хлора, — ведь им для завершения внешнего уровня не хватает одного или двух электронов, И электроны, которые они будут принимать, расположатся достаточно близко к ядру — на втором или третьем электронном слое. Поэтому электроотрицательности этих элементов наибольшая. Легче всего отдают электроны атомы активных металлических элементов, в первую очередь щелочных: Лития, Натрия, Калия и др. Они характеризуются наименьшей електронегативністю.
Поскольку электроотрицательности — это свойство, которая также связана с приемом-потерей электронов, то и меняться в Периодической системе она будет так же, как и металлические свойства в периодах электроотрицательности увеличивается слева направо, а в группах снизу вверх, ведь элемент с наибольшей електронегативністю — Фтора, а с наименьшей — Цезий.
Способ количественного определения электроотрицательности впервые разработал американский химик Лайнус Полинг. По шкале Полинга, электроотрицательности Фтора составляет 3,98 (округленно 4), на втором месте находится Кислород (3,44), на третьем — Хлор (3,16). Водород и типичные неметаллические элементы расположены посредине шкалы; значение их электроотрицательностей примерно равны 2. Активные металлические элементы имеют значение электроотрицательностей меньше, чем 1,6.
Строение электронных оболочек атомов

Атом – мельчайшая частица вещества, состоящая из ядра и электронов. Строение электронных оболочек атомов определяется положением элемента в Периодической системе химических элементов Д. И. Менделеева.
Электрон и электронная оболочка атома
Атом, который в целом является нейтральным, состоит из положительно заряженного ядра и отрицательно заряженной электронной оболочки (электронное облако), при этом, суммарные положительные и отрицательные заряды равны по абсолютной величине. При вычислении относительной атомной массы массу электронов не учитывают, так как она ничтожно мала и в 1840 раз меньше массы протона или нейтрона.
Рис. 1. Атом.
Электрон – совершенно уникальная частица, которая имеет двойственную природу: он имеет одновременно свойства волны и частицы. Они непрерывно движутся вокруг ядра.
Пространство вокруг ядра, где вероятность нахождения электрона наиболее вероятна, называют электронной орбиталью, или электронным облаком. Это пространство имеет определенную форму, которая обозначается буквами s-, p-, d-, и f-. S-электронная орбиталь имеет шаровидную форму, p-орбиталь имеет форму гантели или объемной восьмерки, формы d- и f-орбиталей значительно сложнее.
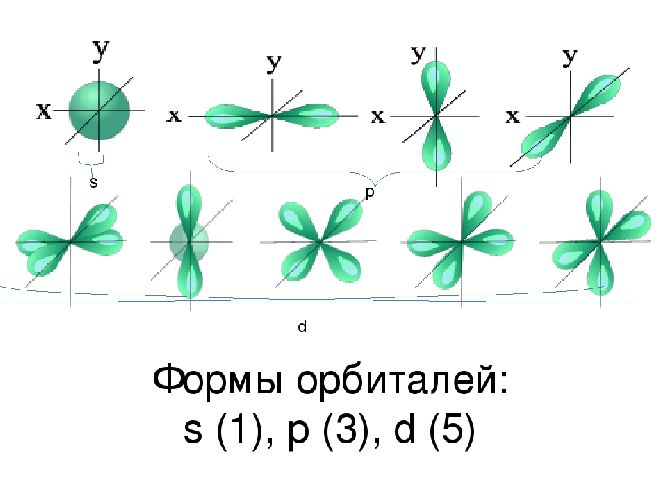
Рис. 2. Формы электронных орбиталей.
Вокруг ядра электроны расположены на электронных слоях. Каждый слой характеризуется расстоянием от ядра и энергией, поэтому электронные слои часто называют электронными энергетическими уровнями. Чем ближе уровень к ядру, тем меньше энергия электронов в нем. Один элемент отличается от другого числом протонов в ядре атома и соответственно числом электронов. Следовательно, число электронов в электронной оболочке нейтрального атома равно числу протонов, содержащимся в ядре этого атома. Каждый следующий элемент имеет в ядре на один протон больше, а в электронной оболочке – на один электрон больше.
Вновь вступающий электрон занимает орбиталь с наименьшей энергией. Однако максимальное число электронов на уровне определяется формулой:
где N – максимальное число электронов, а n – номер энергетического уровня.
На первом уровне может быть только 2 электрона, на втором – 8 электронов, на третьем – 18 электронов, а на четвертом уровне – 32 электрона. На внешнем уровне атома не может находится больше 8 электронов: как только число электронов достигает 8, начинает заполняться следующий, более далекий от ядра уровень.
Строение электронных оболочек атомов
Каждый элемент стоит в определенном периоде. Период – это горизонтальная совокупность элементов, расположенных в порядке возрастания заряда ядер их атомов, которая начинается щелочным металлом, а заканчивается инертным газом. Первые три периода в таблице – малые, а следующие, начиная с четвертого периода – большие, состоят из двух рядов. Номер периода, в котором находится элемент имеет физический смысл. Он означает, сколько электронных энергетических уровней имеется в атоме любого элемента данного периода. Так, элемент хлор Cl находится в 3 периоде, то есть его электронная оболочка имеет три электронных слоя. Хлор стоит в VII группе таблицы, причем в главной подгруппе. Главной подгруппой называется столбец внутри каждой группы, который начинается с 1 или 2 периода.
Таким образом, состояние электронных оболочек атома хлора таково: порядковый номер элемента хлора – 17, что означает, что атом имеет в ядре 17 протонов, а в электронной оболочке – 17 электронов. На 1 уровне может быть только 2 электрона, на 3 уровне – 7 электронов, так как хлор находится в главной подруппе VII группы. Тогда на 2 уровне находится:17-2-7=8 электронов.
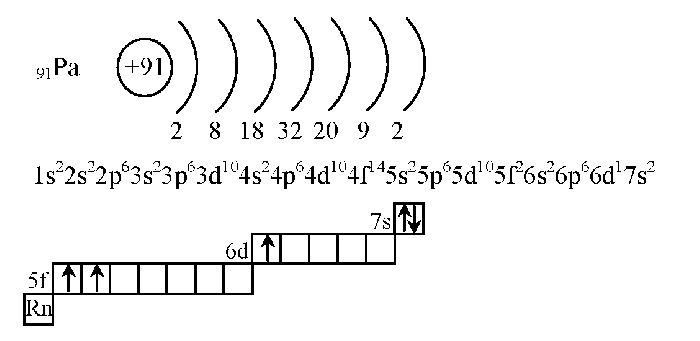
Рис. 3. Схема строения электронной оболочки атома.
Что мы узнали?
Тема «Строение электронных оболочек атомов» по химии (8 класс) кратко объясняет строение атома, свойства и расположение электронов. Также она дает представление о распределении электронов по уровням в периодической системе Д. И. Менделеева.
Строение атома и электронные конфигурации 1.0
Атом можно представить как конструктор «Лего», который можно собрать из более простых “элементарных” частиц. У каждого атома число “деталек” может быть различным. Об этом и о других особенностях строения атома поговорим в статье.
Строение атома
Великие ученые и философы древности упорно бились над вопросом, из чего же состоят вещества, которые их окружают. Впервые идею о том, что все тела живой и неживой природы состоят из мельчайших частиц — атомов — высказал древнегреческий ученый Демокрит целых 2500 лет назад!
Что же из себя представляет атом?
Атом — это мельчайшая химически неделимая частица вещества.
Атомы могут соединяться друг с другом с помощью химических связей в различной последовательности, образуя более сложные частицы — молекулы. Можно провести аналогию:
- атом — отдельный человек,
- молекулы — группы людей, объединенные общим признаком (семья, одноклассники, коллеги, любители кошек, любители собак).
Молекула — это мельчайшие частицы, которые состоят из атомов. Они являются химически делимыми.
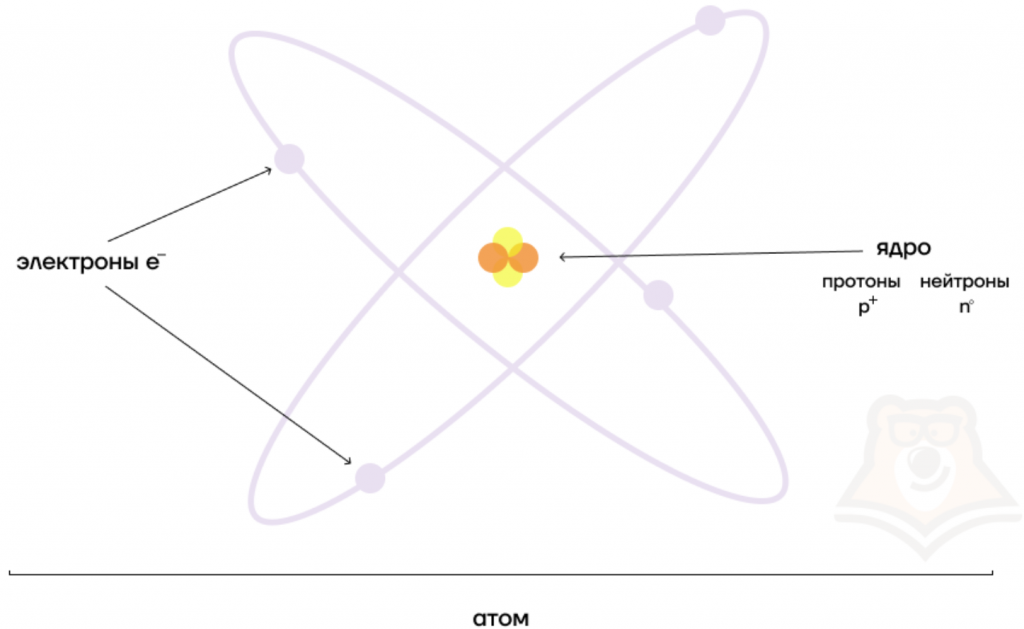
Долгое время считалось, что атом нельзя разделить далее на составляющие. Но с развитием науки учёные-физики выяснили, что атом состоит из более мелких, или элементарных частиц — протонов (p), нейтронов (n) и электронов (ē).
В центре атома располагается ядро, которое состоит из протонов и нейтронов (их общее название нуклоны), а вокруг ядра вращаются электроны.
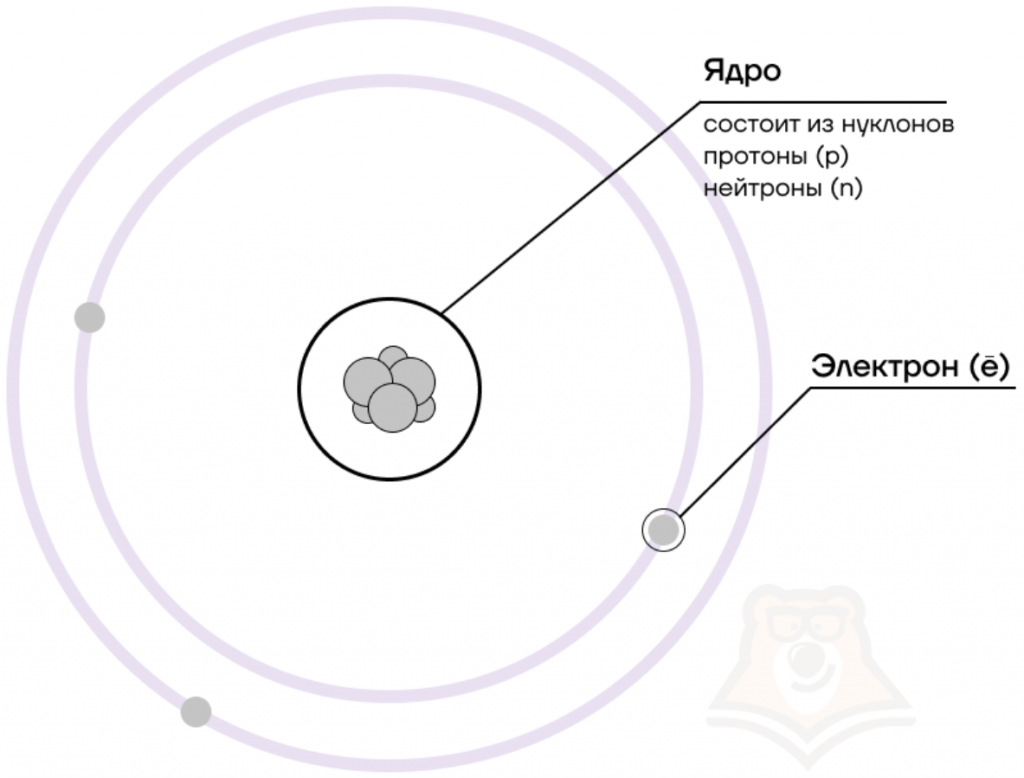
| Чем атом похож на Солнечную систему? Можно представить атом как Солнечную систему, где вокруг ядра (Солнца) по орбитам вращаются электроны (планеты). Это так называемая планетарная модель атома. В реальности атом намного сложнее, но для запоминания нам удобнее пользоваться этими представлениями. |
Тогда более точно определение атома будет звучать так:
Атом — электронейтральная химически неделимая частица, которая состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов.
Каждая из элементарных частиц в атоме имеет свой заряд и массу:

Характеристика элементарных частиц
Из таблички видно, что вся масса атома сосредоточена в протонах и нейтронах, то есть в ядре. При этом само ядро положительно заряжено, а вокруг ядра вращаются отрицательно заряженные электроны.
В разновидностях одного и того же химического элемента может быть различное число элементарных частиц. Давай рассмотрим это на примере атома водорода.

Первый случай: ядро атома водорода состоит из одного протона (масса ядра = 1 а.е.м.). Такой атом называется протием, именно он указан в периодической системе Д.И. Менделеева.
Добавим к этому ядру один нейтрон, тогда масса ядра будет равна 2 а.е.м.. Мы получили вторую разновидность атома водорода — дейтерий.
Если добавить второй нейтрон к такому ядру, то мы получим тритий. Так вот, разновидности одного и того же химического элемента, которые различаются числом нейтронов в ядре, называются изотопами.
Как определить количество элементарных частиц
Сейчас мы научимся определять количество протонов, нейтронов и электронов в атоме любого химического элемента. В этом нам поможет периодическая система Д.И. Менделеева.
Давай рассмотрим ячейку в периодической системе с углеродом:
В верхней части ячейки располагается порядковый номер элемента (это целое число), под ним располагается относительная атомная масса. Она является нецелым числом, поэтому её легко определять. Относительная атомная масса, округленная до целого числа, называется массовым числом.
Эти характеристики связаны с количеством элементарных частиц в атоме следующим образом:
(№ элемента = p = Z = ē)
Число нейтронов = массовое число – порядковый номер
Давай рассмотрим основные определения и положения, связанные с характеристикой элемента и числовыми операциями:
- Орбиты, на которых располагаются электроны, называются электронными слоями (или энергетическими уровнями). Нумерация слоев начинается с ближайшего к ядру электронного слоя.
- На каждом электронном слое может находиться не более 2N2 электронов (где N — номер слоя).
- Число занятых электронами слоев в атоме элемента совпадает с номером периода, в котором он находится.
- Последний энергетический уровень называют внешним (максимальное число ē на внешнем уровне = 8). Обычно на нем находятся валентные электроны, то есть электроны на внешней (валентной) оболочке атома.
- Число валентных электронов, как правило, совпадает с номером группы, в котором находится элемент.

На примере атома углерода определим количество элементарных частиц в его атоме.
Порядковый номер углерода равен 6, значит, заряд его атома + 6, число протонов и число электронов совпадает и тоже равно 6.
Относительная атомная масса равна 12,01, а число нейтронов равно 12 – 6 = 6.
Углерод находится во втором периоде, IV группе. Это показывает нам, что занято лишь 2 электронных слоя, при этом на внешнем электронном уровне располагаются 4 электрона.
“Грустный” и “веселый” атом
При заполнении электронами ячеек мы описываем так называемое основное состояние. Это такое состояние атома, при котором энергия системы минимальна. Его состояние можно определить как “веселое”: в атоме всё спокойно и в порядке.
Но может быть и другая ситуация, когда на электроны оказывается какое-то воздействие. Тогда происходит процесс, похожий на развод пары в человеческом мире. В результате воздействия те электроны, которые находились на орбитали вдвоем и были спаренными, могут друг с другом “поссориться” и “разъехаться” по разным орбиталям.
Тогда атом можно определить как “грустный”: электроны ссорятся, атома грустит. В химии это состояние и называется возбужденным. Такой “развод” возможен только в пределах одного энергетического уровня.

Атомные подуровни заполняются электронами в порядке увеличения их энергии. Этот порядок выглядит следующим образом:
| 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → … |
Проскок электрона
| Как умеет скакать электрон? Иногда при заполнении энергетических подуровней мы нарушаем порядок заполнения подуровней. В первую очередь, это связано с заполнением s- и d-подуровней . Электрон перемещается с внешнего s- на предвнешний d-подуровень. Так образуется более устойчивая заполненная или полузаполненная конфигурация. Такое явление называется проскоком электрона: электрон как бы нарушает общую очередь элементов в оболочке и обходит их. |
Это явление характерно для элементов IB и VIB групп, например, Cr, Cu, Ag.
Например, у меди электронная оболочка должна выглядеть как ..3d 9 4s 2 . Но так как для заполнения d-подуровня не хватает одного электрона, то более выгодной становится ситуация, когда с s-подуровня электрон “перепрыгивает” на внутренний d-подуровень. В результате, конфигурация меди выглядит как 3d 10 4s 11

| Итог: иметь конфигурации nd 5 и nd 10 более энергетически выгодно, чем nd 4 и nd 9 . Поэтому у таких элементов, как Cu, Cr, Ag, Au, Nb, Mo, Ru, Pt, Pd происходит проскок (провал) электрона: электрон с верхнего “этажа” как будто проваливается на нижний. |
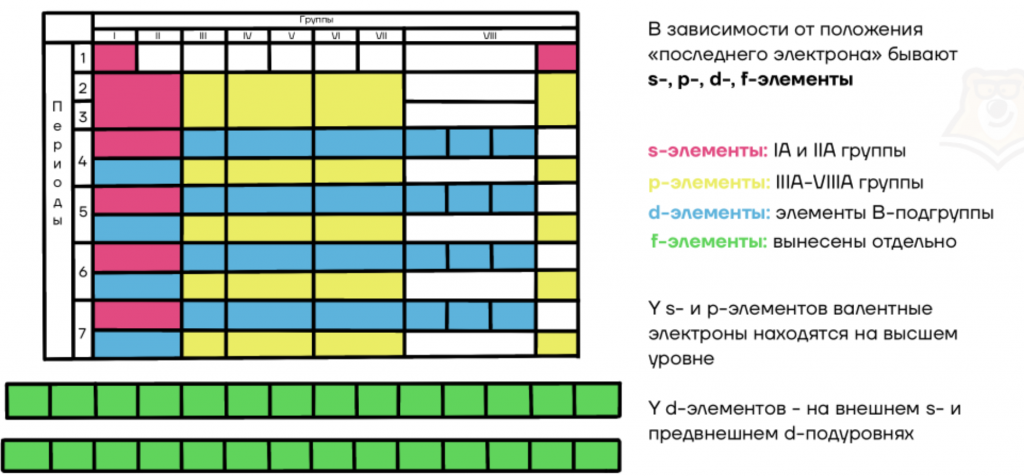
Классификация химических элементов: s-,p-,d-,f-элементы
В зависимости от положения “последнего электрона” бывают s-, p-, d-, f-элементы:
- s-элементы: IA и IIA группы;
- p-элементы: IIIA-VIIIA группы;
- d-элементы: элементы побочных подгрупп;
- f-элементы: вынесены в отдельную группу лантаноидов и актиноидов.
У s- и p-элементов валентные электроны находятся на внешнем уровне.
У d-элементов — на внешнем s- и на предвнешнем d-подуровнях.
Далее приведены электронные формулы атомов элементов первых четырех периодов. Благодаря этой шпаргалке всегда можно сверить свой вариант электронной конфигурации и проверить себя.
Продолжение темы читайте в статье «Строение атома и электронные конфигурации 2.0».
Фактчек
- Атом — электронейтральная частица, состоящая из ядра и вращающихся вокруг него электронов.
- Электроны располагаются на электронных подуровнях, причем их число определяется порядковым номером элемента.
- Существует группа атомов одного и того же химического элемента, у которых имеется разное число нейтронов. Такие элементы называют изотопами.
- Электроны располагаются по ячейкам так, чтобы энергия системы была минимальна.
- Иногда для достижения минимума энергии некоторые правила нарушаются — таковым является проскок электрона.
Проверь себя
Задание 1.
Ядро атома состоит из:
- Протонов и нейтронов
- Протонов и электронов
- Нейтронов и электронов
- Протонов, нейтронов и электронов
Задание 2.
У изотопов различается число:
- Протонов
- Нейтронов
- Электронов
- Нейтронов и электронов
Задание 3.
Проскок электрона характерен для элемента:
Задание 4.
На третьем электронном слое может находиться максимально:
- 8 электронов
- 18 электронов
- 2 электрона
- 32 электрона
Ответы: 1. — 1; 2. — 2; 3. — 4; 4. — 2.
СТРОЕНИЕ ЭЛЕКТРОННОЙ ОБОЛОЧКИ АТОМА
1. Квантовые числа (главное, побочное, магнитное, спиновое).
2. Закономерности заполнения электронной оболочки атома:
— принцип наименьшей энергии;
3. Определения понятий: электронная оболочка, электронное облако, энергетический уровень, энергетический подуровень, электронный слой.
Атом состоит из ядра и электронной оболочки. Электронная оболочка атома – это совокупность всех электронов в данном атоме. От строения электронной оболочки атома напрямую зависят химические свойства данного хим. элемента. Согласно квантовой теории, каждый электрон в атоме занимает определенную орбиталь и образует электронное облако, которое является совокупностью различных положений быстро движущегося электрона.
Для характеристики орбиталей и электронов используют квантовые числа.
Главное квантовое число – n. Характеризует энергию и размер орбитали и электронного облака; принимает значения целых чисел от 1 до бесконечности (n = 1,2,3,4,5,6…). Орбитали, имеющие одинаковое значение n, близки между собой по энергии и по размеру и образуют один энергетический уровень.
Энергетический уровень – это совокупность орбиталей, имеющих одинаковое значение главного квантового числа. Энергетические уровни обозначают либо цифрами, либо большими буквами латинского алфавита (1-K, 2-L, 3-M, 4-N, 5-O, 6-P, 7-Q). С увеличением порядкового номера энергия и размер орбиталей увеличиваются.
Электронный слой – это совокупность электронов, находящихся на одном энергетическом уровне.
На одном энергетическом уровне могут находиться электронные облака, имеющие различные геометрические формы.
Побочное (орбитальное) квантовое число – l. Характеризует форму орбиталей и облаков; принимает значения целых чисел от 0 до n-l.
| УРОВЕНЬ | ГЛАВНОЕ КВАНТОВОЕ ЧИСЛО — n | ЗНАЧЕНИЕ ПОБОЧНОГО КВАНТОВОГО ЧИСЛА – l |
| K | 0 (s) | |
| L | 0,1 (s,p) | |
| M | 0,1,2 (s,p,d) | |
| N | 0,1,2,3 (s,p,d,f) |
Орбитали, для которых l=0, имеют форму шара (сферы) и называются s-орбиталями. Они имеются на всех энергетических уровнях, причем на К-уровне имеется только s-орбиталь. Схематично изобразите форму s-орбитали:
Орбитали, для которых l=1, имеют форму вытянутой восьмерки и называются р—орбиталями. Они имеются на всех энергетических уровнях, кроме первого (К). Схематично изобразите форму l-орбитали:
Орбитали, для которых l=2, называются d-орбиталями. Их заполнение электронами начинается с третьего энергетического уровня.
Заполнение f-орбиталей, для которых l=3, начинается с четвертого энергетического уровня.
Энергия орбиталей, находящихся на одном энергетическом уровне, но имеющих разную форму, неодинакова: Espdf, поэтому на одном уровне выделяют разные энергетические подуровни.
Энергетический подуровень – это совокупность орбиталей, которые находятся на одном энергетическом уровне и имеют одинаковую форму. Орбитали одного подуровня имеют одинаковые значения главного и побочного квантового числа, но отличаются направлением (ориентацией) в пространстве.
Магнитное квантовое число – ml. Характеризует ориентацию орбиталей (электронных облаков) в пространстве и принимает значения целых чисел от –l через 0 до +l. Число значений ml определяет число орбиталей на подуровне, например:
s-подуровень: l=0, ml=0, — 1 орбиталь.
p-подуровень: l=1, ml=-1, 0, +1, -3 орбитали
d-подуровень: l=2, ml=-2, -1, 0, +1, +2, — 5 орбиталей.
Таким образом, число орбиталей на подуровне можно вычислить как 2l+1. Общее число орбиталей на одном энергетическом уровне = n 2 . Общее число электронов на одном энергетическом уровне = 2n 2 . Графически любая орбиталь изображается в виде клетки (квантовой ячейки).
Схематично изобразите квантовые ячейки для разных подуровней и подпишите для каждой из них значение магнитного квантового числа:
Итак, каждая орбиталь и электрон, находящийся на этой орбитали, характеризуется тремя квантовыми числами: главным, побочным и магнитным. Электрон характеризуется еще одним квантовым числом – спином.
Спиновое квантовое число, спин (от англ. to spin – кружить, вращать) – ms. Характеризует вращение электрона вокруг своей оси и принимает только два значения: +1/2 и –1/2. Электрон со спином +1/2 условно изображают так: ; со спином –1/2: ¯.
Заполнение электронной оболочки атома подчиняется следующим законам:
Принцип Паули: в атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел. Составьте наборы квантовых чисел для всех электронов атома кислорода и убедитесь в справедливости принципа Паули:
Принцип наименьшей энергии: Основное (устойчивое) состояние атома – это такое состояние, которое характеризуется минимальной энергией. Поэтому электроны заполняют орбитали в порядке увеличения их энергии.
Правило Клечковского: Электроны заполняют энергетические подуровни в порядке увеличения их энергии, который определяется значением суммы главного и побочного квантовых чисел (n + l): 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d.
Правила Гунда: На одном подуровне электроны располагаются так, чтобы абсолютное значение суммы спиновых квантовых чисел (суммарного спина) было максимальным. Это соответствует устойчивому состоянию атома.
Составьте электронно-графические формулы магния, железа и теллура:
Исключения составляют атомы хрома и меди, в которых происходит проскок (переход) одного электрона с 4s-подуровня на 3d-подуровень, что объясняется большой устойчивостью образующихся при этом электронных конфигураций 3d 5 и 3d 10 . Составьте электронно-графические формулы атомов хрома и меди:
Для характеристики электронного строения атома можно использовать схемы электронного строения, электронные и электронно-графические формулы.
Используя вышеперечисленные схемы и формулы, покажите строение атома серы:
ТЕСТ НА ТЕМУ «СТРОЕНИЕ ЭЛЕКТРОННОЙ ОБОЛОЧКИ АТОМА»
1. Элемент, невозбужденный атом которого не содержит неспаренных электронов, — это
| А) магний | Б) углерод | В) сера | Г) цинк |
2. Электронная конфигурация иона Cl + в основном электронном состоянии (этот ион образуется при действии ультрафиолетового излучения на сильно нагретый хлор) имеет вид:
| А) [Ne] 3s 2 3p 5 | Б) [Ne] 3s 1 3p 6 | В) [Ne] 3s 2 3p 4 | Г) [Ne] 3s 2 3p 6 |
3. Элементу второго периода для завершения внешнего уровня не хватает трех электронов. Этот элемент
| А) бор | Б) углерод | В) азот | Г) фосфор |
4. Формула высшего оксида некоторого элемента – ЭО3. Какую конфигурацию валентных электронов может иметь этот элемент в основном состоянии?
| А) 4d 6 | Б) 2s 2 2p 4 | В) 3s 2 3p 4 | Г) 3s 1 3d 5 |
5. Чему равно орбитальное квантовое число 3р электрона?
| А) 1 | Б) 3 | В) 0 | Г) +1/2 |
6. Число неспаренных электронов в атоме хрома в невозбужденном состоянии равно:
| А) 1 | Б) 4 | В) 5 | Г) 6 |
7. Электронную конфигурацию внешнего электронного слоя 3s 2 3p 6 имеют соответственно атом и ионы:
| А) Ar, Cl — , S -2 | Б) Kr, K + , Ca +2 | В) Ne, Cl — , Ca +2 | Г) Ar, Cl — , Ca +2 |
8. Число d-электронов у атома серы в максимально возбужденном состоянии равно:
| А) 1 | Б) 2 | В) 4 | Г) 6 |
9. Распределение электронов в нормальном состоянии в атоме хрома по энергетическим уровням соответствует ряду цифр:
| А) 2,8,12,2 | Б) 2,8,8,6 | В) 2,8,13,1 | Г) 2,8,14,0 |
10. Ионы О -2 и К + имеют соответственно следующие электронные формулы:
| А) 1s 2 2s 2 2p 4 | Б) 1s 2 2s 2 2p 6 | В)1s 2 2s 2 2p 6 3s 2 3p 6 4s 0 | Г)1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 |
| А,Г | В | В | В | А | Г | А,Г | Б | В | Б,В |
ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ ФОРМУЛЫ ВЕЩЕСТВА ПО ПРОДУКТАМ СГОРАНИЯ
1. При полном сгорании 0,88 г вещества образовалось 0,51 г углекислого газа и 1,49 г сернистого газа. Определить простейшую формулу вещества. (CS2)
2. Установить истинную формулу органического вещества, если известно, что при сжигании 4,6 г его было получено 8,8 г углекислого газа и 5,4 г воды. Плотность паров этого вещества по водороду равна 23. (С2Н6О)
3. При полном сгорании 12,3 г органического вещества образовалось 26,4 г углекислого газа, 4,5 г воды и выделилось 1,4 г азота. Определить молекулярную формулу вещества, если его молярная масса в 3,844 раза больше молярной массы кислорода. (C6H5NO2)
4. При сгорании 20 мл горючего газа расходуется 50 мл кислорода, а получается 40 мл углекислого газа и 20 мл водяных паров. Определить формулу газа. (C2H2)
5. При сжигании 5,4 г неизвестного вещества в кислороде образовалось 2,8 г азота, 8,8 г углекислого газа и 1,8 г воды. Установите формулу вещества, если известно, что оно легче воздуха. (HCN)
6. При сжигании 3,4 г неизвестного вещества в кислороде образовалось 2,8 г азота и 5,4 г воды. Установить формулу вещества, если известно, что оно легче воздуха. (NH3)
7. При сжигании 1,7 г неизвестного вещества в кислороде образовалось 3,2 г сернистого газа и 0,9 г воды. Установить формулу вещества, если известно, что оно легче аргона. (H2S)
8. Образец вещества массой 2,96 г в реакции с избытком бария при комнатной температуре дает 489 мл водорода (Т=298°К, давление нормальное). При сожжении 55,5 мг того же вещества получили 99 мг углекислого газа и 40,5 мг воды. При полном испарении образца этого вещества массой 1,85 г его пары занимают объем 0,97 л при 473°К и 101,3 кПа. Определить вещество, привести структурные формулы двух его изомеров, отвечающих условиям задачи. (С3Н6О2)
9. При сгорании 2,3 г вещества образовалось 4,4 г углекислого газа и 2,7 г воды. Плотность паров этого вещества по воздуху равна 1,59. Определить молекулярную формулу вещества. (С2Н6О)
10. Определить молекулярную формулу вещества, если известно, что 1,3 г его при сгорании образует 2,24 л углекислого газа и 0,9 г паров воды. Масса 1 мл этого вещества при н.у. равна 0,00116 г. (C2H2)
11. При сжигании одного моля простого вещества образовалось 1,344 м 3 (н.у.) газа, который в 11 раз тяжелее гелия. Установить формулу сжигаемого вещества. (С60)
12. При сжигании 112 мл газа было получено 448 мл углекислого газа (н.у.) и 0,45 г воды. Плотность газа по водороду составляет 29. Найти молекулярную формулу газа. (С4Н10)
13. При полном сгорании 3,1 г органического вещества образовалось 8,8 г углекислого газа, 2,1 г воды и 0,47 г азота. Найти молекулярную формулу вещества, если масса 1 л паров его при н.у. составляет 4,15 г. (C6H7N)
14. При сгорании 1,44 г органического вещества образовалось 1,792 л углекислого газа и 1,44 г воды. Установите формулу вещества, если его относительная плотность по воздуху составляет 2,483. (С4Н8О)
15. При полном окислении 1,51 г гуанина образуется 1,12 л углекислого газа, 0,45 г воды и 0,56 л азота. Вывести молекулярную формулу гуанина. (C5H5N5O)
16. При полном окислении органического вещества массой 0,81 г образуется 0,336 л углекислого газа, 0,53 г карбоната натрия и 0,18 г воды. Установить молекулярную формулу вещества. (C4H4O4Na2)
17. При полном окислении 2,8 г органического вещества образовалось 4,48 л углекислого газа и 3,6 г воды. Относительная плотность вещества по воздуху 1,931. Установить молекулярную формулу данного вещества. Какой объем 20% раствора гидроксида натрия (плотность 1,219 г/мл) необходим для поглощения выделившегося при сгорании углекислого газа? Какова массовая доля карбоната натрия в полученном растворе? (С4Н8; 65,6 мл; 23,9%)
18. При полном окислении 2,24 г органического вещества образуется 1,792 л углекислого газа, 0,72 г воды и 0,448 л азота. Вывести молекулярную формулу вещества. (C4H4N2O2)
19. При полном окислении органического вещества массой 2,48 г образуется 2,016 л углекислого газа, 1,06 г карбоната натрия и 1,62 г воды. Установить молекулярную формулу вещества. (C5H9O2Na)
Строение атома. Гибридизация орбиталей
Обычно в начале статьи пишут краткий план того, о чем пойдет речь в статье. Еще добавляют зачем и почему на нее нужно тратить время. Но здесь такого не будет, потому что я не уверен — нужна ли она вообще.
Но я расскажу историю. Вообще статья должна была быть про белок, как формируется первичная, вторичная структура, ну и так далее. И вот идет подготовка материала, а там довольно большую роль играет электроотрицательность. На самом деле не очень и большую, но все-таки роль у нее есть. И вот мне стало интересно, а как она формируется? Ты конечно знаешь, что она растет в периодической таблице слева направо и зависит от радиуса атома. Но почему? В общем-то эти вопросы привели меня к строению атома и закону Кулона. Поэтому сейчас мы устроим маленькое путешествие в химию и физику. Начнем со строения атома. А уже в следующей статье будем разбираться с электроотрицательностью.
Планетарная модель строения атома от Резерфорда
Это модель ключевая, потому что на ее основе строились все остальные. Вообще Резерфорд крутой мужик, который очень любил всякие опыты. Вот один из них:
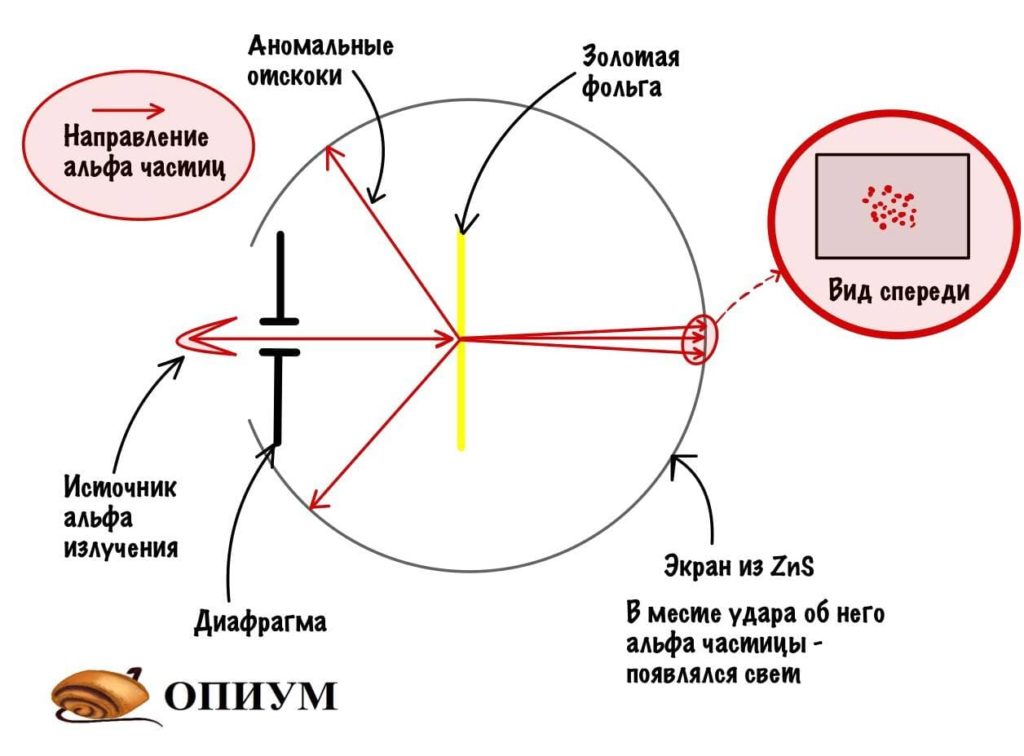
Опыт Резерфорда
Резерфорд взял источник альфа-частиц и направил его на фольгу из золота. Диафрагма нужна для того, чтобы альфа-излучение направлялось только к фольге, а не разлеталось в разные стороны. При прохождении альфа-частиц через атомы золота они отклонялись, а место их удара отмечалось на цинковом экране (он светится, когда на него попадает альфа-частица). Ничего удивительного, у атома есть заряд, и он вызывает отклонение частиц. Но тут случилось кое-что необычное: очень редко альфа-частицы отскакивали в другую сторону — к месту их «запуска». Резерфорд очень удивился и сказал: «Да это примерно тоже самое, что стрелять по тряпке из ружья и получить пулю в лоб». Конечно, не дословно, но смысл примерно такой.
Какие выводы делает Резерфорд из этого опыта? Он предполагает, что основная масса атома сосредоточена в его ядре — когда альфа-частицы попадают в него, то отскакивают в обратную сторону. Ядро очень маленькое и заряжено положительно, а вокруг него по орбитам летают отрицательно заряженные электроны. Он называет это планетарной моделью. Очень красиво, согласитесь? Мы живем в мире, который находится в солнечной системе. А атомы, из которых состоит все вокруг, имеют строение такой же системы.
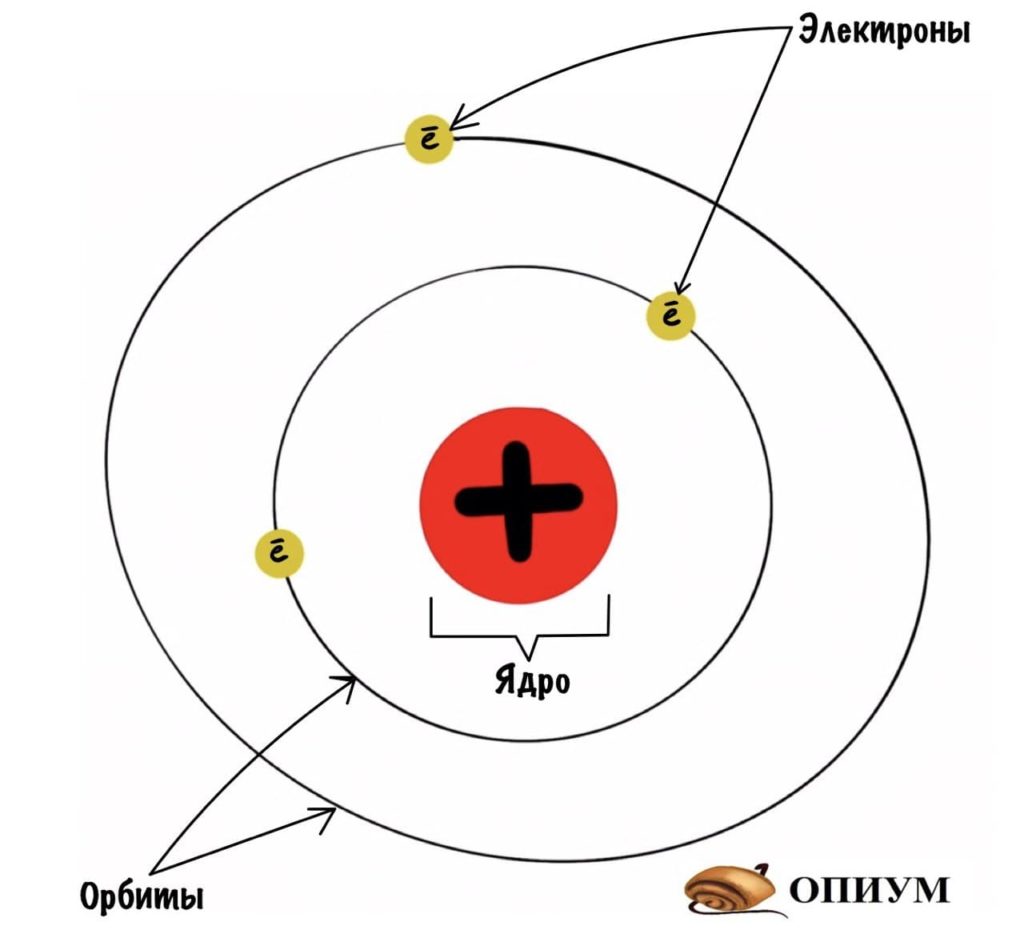
Модель атома по Резерфорду
Это все очень поэтично и красиво, но есть парочка проблем:
- Если электроны летят по орбите, то у них есть скорость, и они излучают электромагнитные волны — или энергию. А значит они быстро ее потратят и упадут на ядро.
- Некоторые атомы излучают свет — фотоны. Это называется спектром. Но при такой модели им неоткуда взять такое количество энергии. Мало того, что они падают на ядро, так им еще и излучать что-то нужно. Не очень все это складывается.
Были и еще проблемы, но это основные. Как же их решить?
Полуклассическая модель атома по Бору
Появляется второй крутой мужик. Может быть, он даже круче первого, потому что говорит такое — от чего волосы у физиков встают дыбом. Бор взял модель атома по Резерфорду и сказал что-то вроде: «Давайте предположим, что электроны движутся по орбитам, но никакую энергию они не излучают. Но если электрон перепрыгивает с одной орбиты на другую, то он выделяет энергию — фотоны. Это и есть спектр!»
Бор назвал состояние атома, когда его электроны движутся по свои орбитам, стационарным состоянием. При перепрыгивании одного электрона на другую орбиту атом становится возбужденным и может выделять энергию. Атом становится возбужденным не просто так — он поглощает какую-то энергию извне, она представляет собой фотон или фотоны.
Переведем Бора на язык физиков: “Вся ваша физика полная туфта. Атому на нее плевать, он живет по другим законам”. И все как бы в шоке, но больше всех Эйнштейн — он становится главным хейтером Бора. Но экспериментально модель Бора подтверждается.
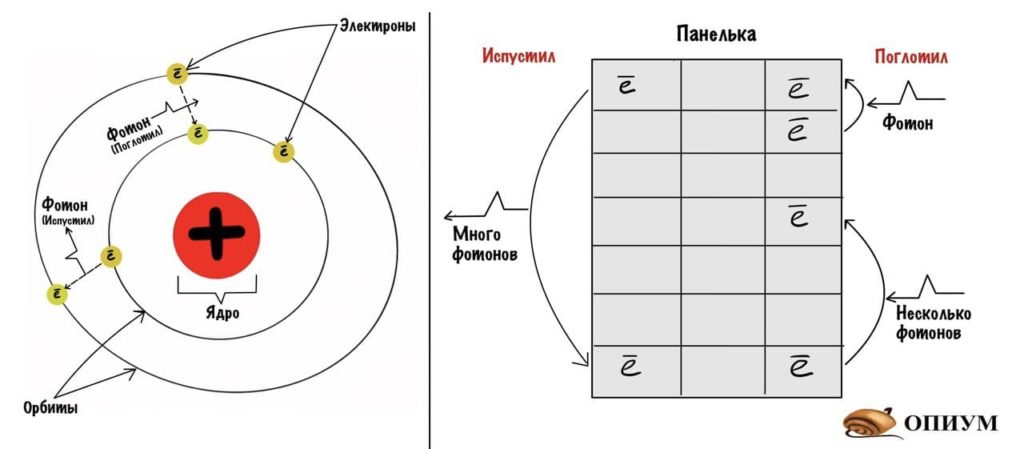
Модель атома по Бору
Модель Бора чем-то похожа на дом. Представьте себе панельку. Если электрон упадет с 7 этажа на первый, то он выделит энергию — это и есть фотон. А вот если зарядить как следует атом, то электрон может прыгнуть с первого этажа на пятый. Чем больше зарядишь, тем выше прыгнет. Чем с большей высоты упадет, тем больше выделит энергии. Примерно так. Оказалось, что Бор был прав и дальше мы это увидим.
Резерфорд, кстати, сделал предположение, что ядро состоит из положительно заряженных протонов. Но Резерфорд и Бор еще не знали, от чего зависит количество электронов и протонов, но с этим разберутся попозже.
Современная модель атома
Ну а дальше началось самое интересное — физики взяли модель атома по Бору и добавили к ней своего добра. Так получилась современная модель атома. Конец! Ну или не совсем. Атом состоит из ядра и электронной оболочки. Начинаем с ядра.
Ядро атома
У атома есть ядро, которое состоит из протонов и нейтронов. Протоны заряжены положительно, а у нейтронов заряда нет. Количество протонов и электронов равно — зависит от порядкового номера в таблице Менделеева. Если это атом азота, то у него 7 протонов и 7 электронов. Нейтрон такому правилу не подчиняется — их может быть больше, а может и меньше. Протон и нейтрон весят в примерно 1800 раз больше, чем электрон. Поэтому основная масса атома находится в ядре.
На самом деле протон и нейтрон состоят из других частиц, но не будем слишком глубоко копать. Можешь почитать, если интересно.
Электронная оболочка
Электронная оболочка — это все электроны атома. Она состоит из слоев, на которых располагается какая-то часть электронов.
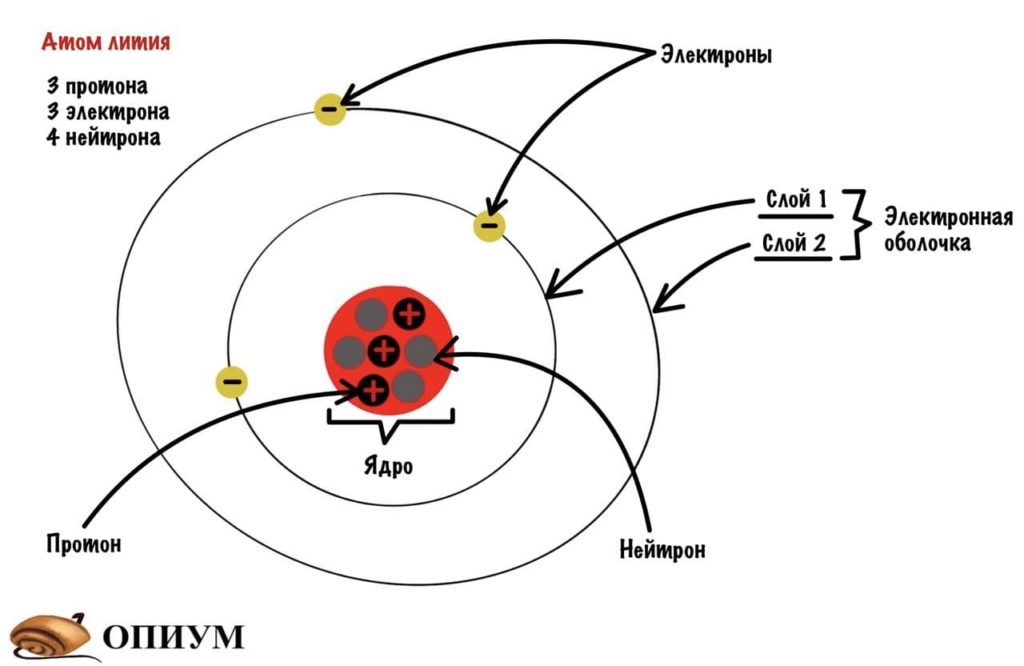
Строение атома лития
Каждый слой состоит из орбиталей. Заметили? Не орбит, а орбиталей. Орбита — это траектория движения тела, на которой в какой-то момент времени можно его встретить. Помните круговые поливалки в деревне? Вода из них движется по определенной траектории. Можно встать и подождать пока тебя польют в жаркий день. Орбиталь — это другое дело, на ней электрон проводит 90 процентов времени, но как он там движется — одному ему известно. Поэтому можно стоять очень долго, но так и не дождаться пока тебя польют. Пример не очень, согласен. Лучше бы привел Луну или какую-нибудь планету, но вы поняли…
Есть 4 вида орбиталей: s, p, d и f. S- это сфера, p — бесконечность или гантелька, d и f сложнее. Я их рисовать не буду, потому что они нас не интересуют. P-орбиталей всегда 3 — px, py, pz.
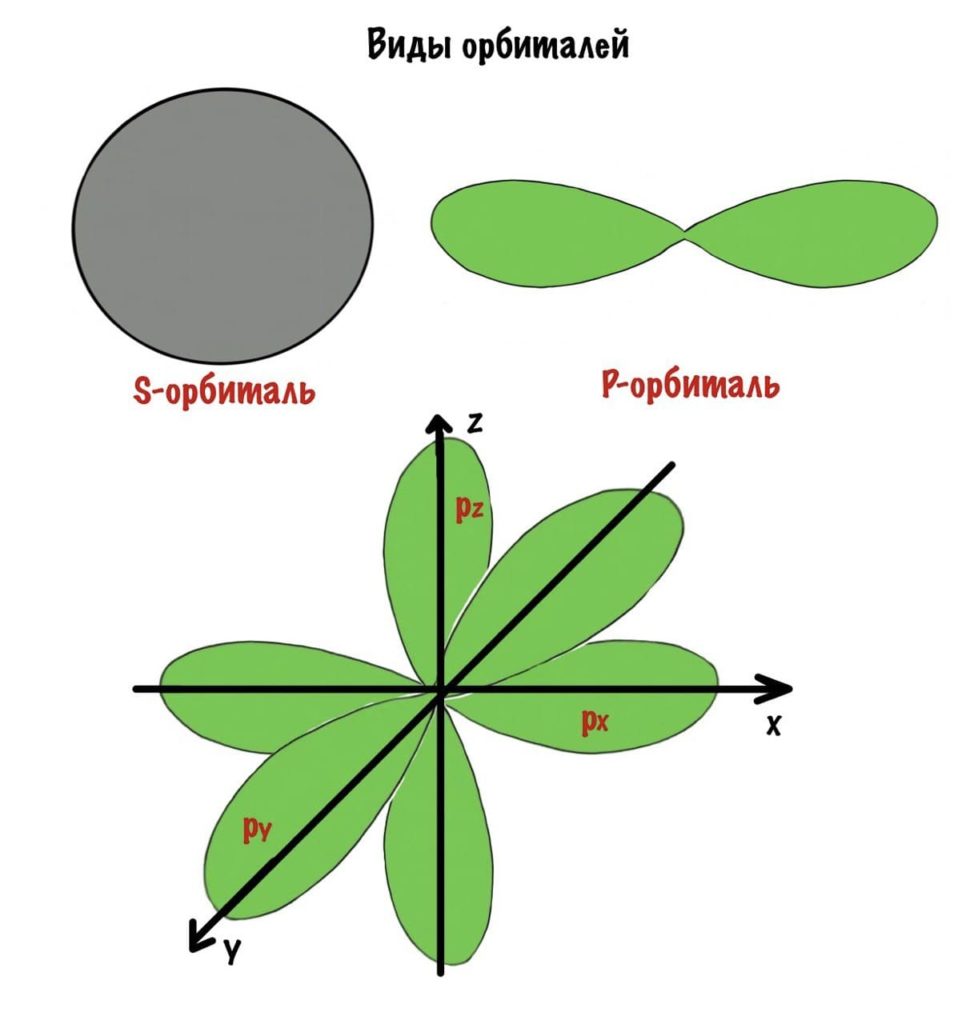
s и p орбитали
Слои электронной оболочки
Теперь подробнее про слои. Первый слой состоит только из одной орбитали — s. Второй слой: одна s и три p орбиталей. Третий слой — одна s, три p и пять d орбиталей. Ну а на четвертом за 5d орбиталями добавятся еще 7f. Количество слоев зависит от количества электронов, а значит от порядкового номера атома.
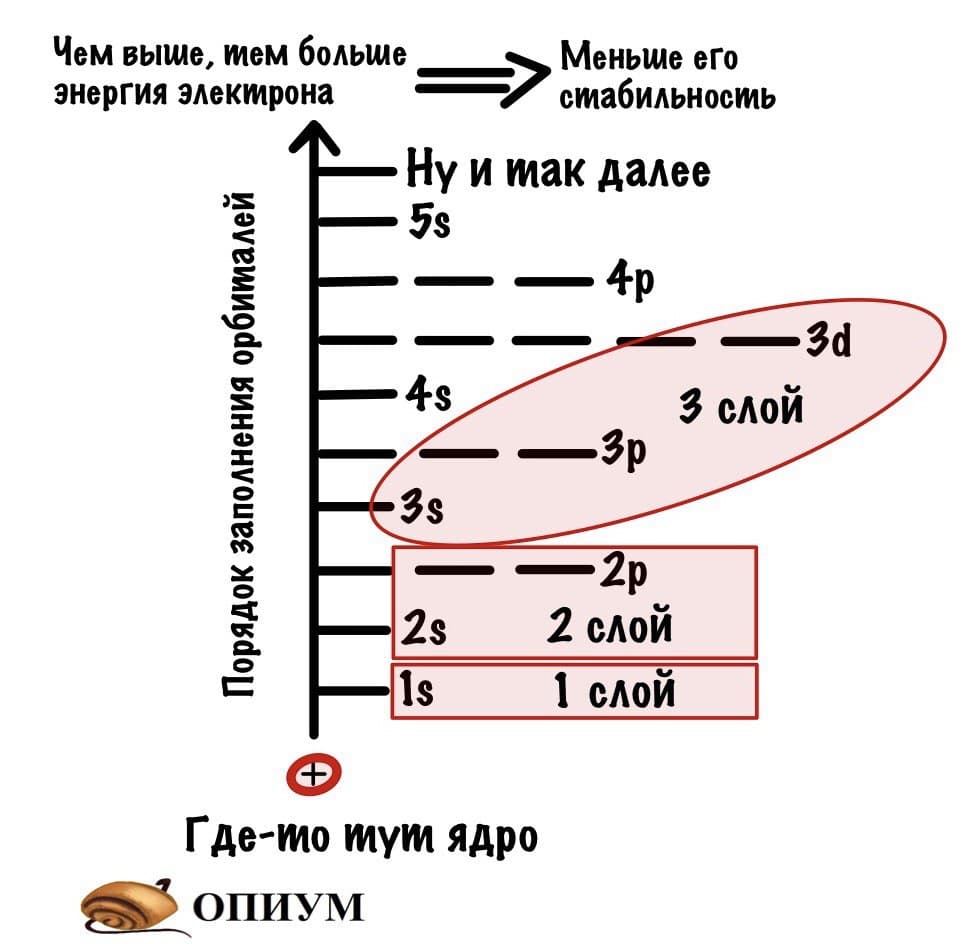
Слои электронной оболочки
Тут есть определенные правила:
- На каждой орбитали могут находиться только два электрона.
- Орбитали заполняются с определенной последовательностью, она видна на картинке.
- Чем дальше орбиталь от ядра атома, тем больше ее энергия и энергия электрона на ней.
- Электрону выгоднее быть на орбитале и слое, которые ближе всего к ядру атома. Там его энергетическое состояние стабильнее, так как меньше энергия. Поэтому электроны стремятся упасть вниз — прямо как я по социальной лестнице, ой.
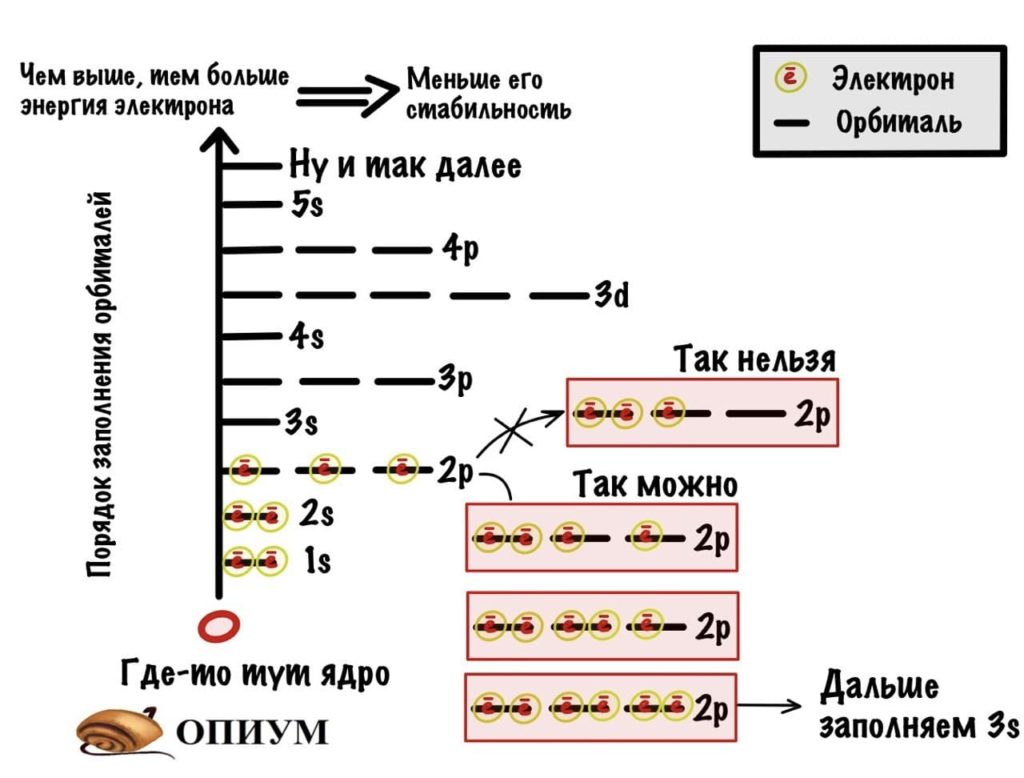
Правила заполнения орбиталей
Добавим к атому лития, который я показывал до этого, орбитали и получим что-то такое.
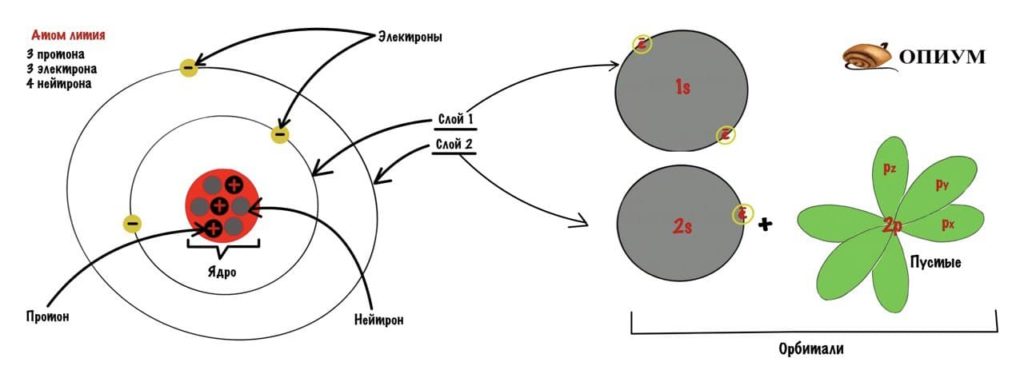
Атом лития
Можно еще попробовать свести орбитали в один рисунок, смотрите.
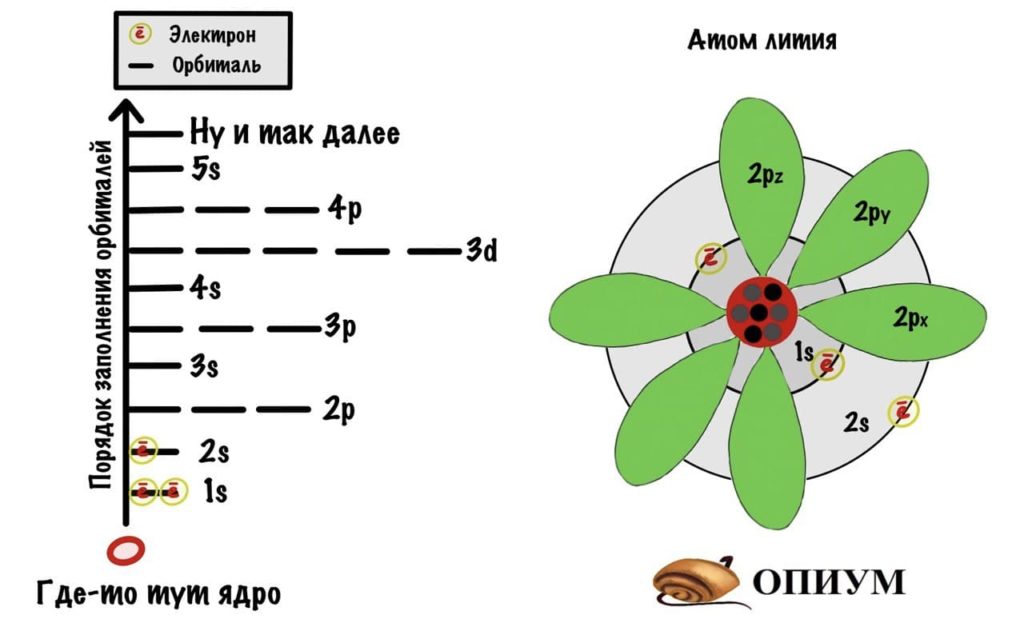
Электронная формула и строение атома лития
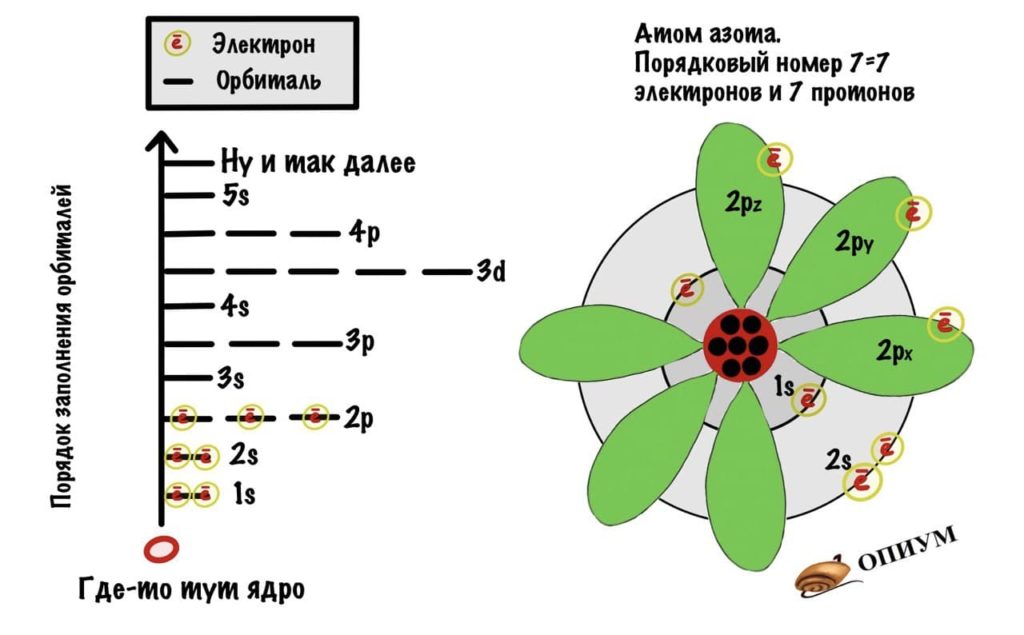
Электронная формула и строение атома азота
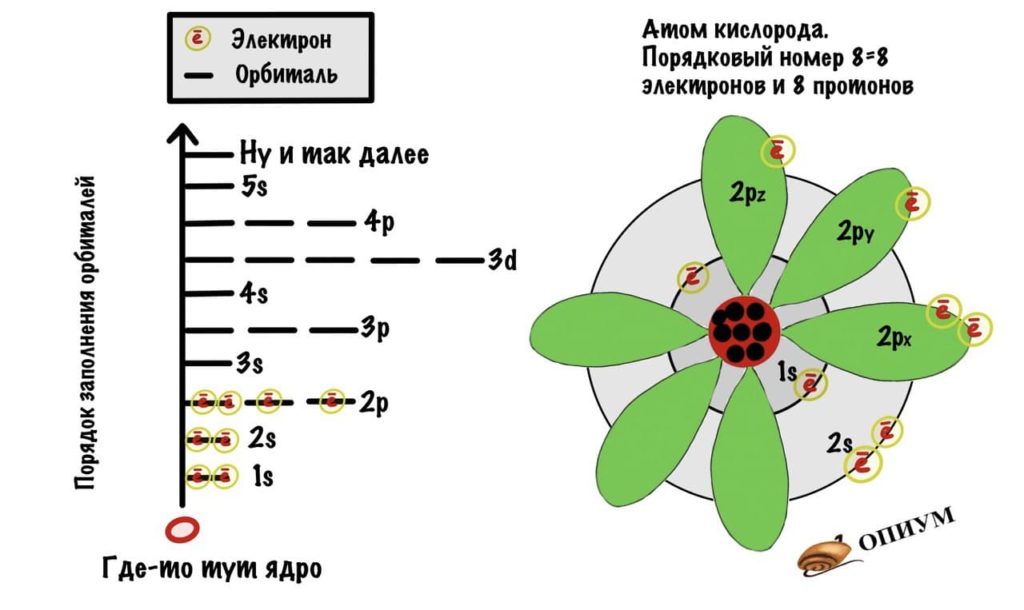
Электронная формула и орбитали атома кислорода
Химические связи чаще всего образуются за счет неспаренных электронов, но подробнее об этом поговорим в следующей статье. А сейчас нас интересует углерод и гибридизация его орбиталей.
Гибридизация орбиталей
Сначала посмотрим на электронную формулу углерода и вспомним о Боре. В стационарном состоянии у углерода всего два электрона на 2p-орбиталях. Однако, если атом углерода поглотит энергию фотона, то электрон с 2s-орбитали может перейти на 2p-орбиталь — атом углерода становится возбужденным. В таком состоянии он может образовать 4 связи, т.к. у него 4 неспаренных электрона.
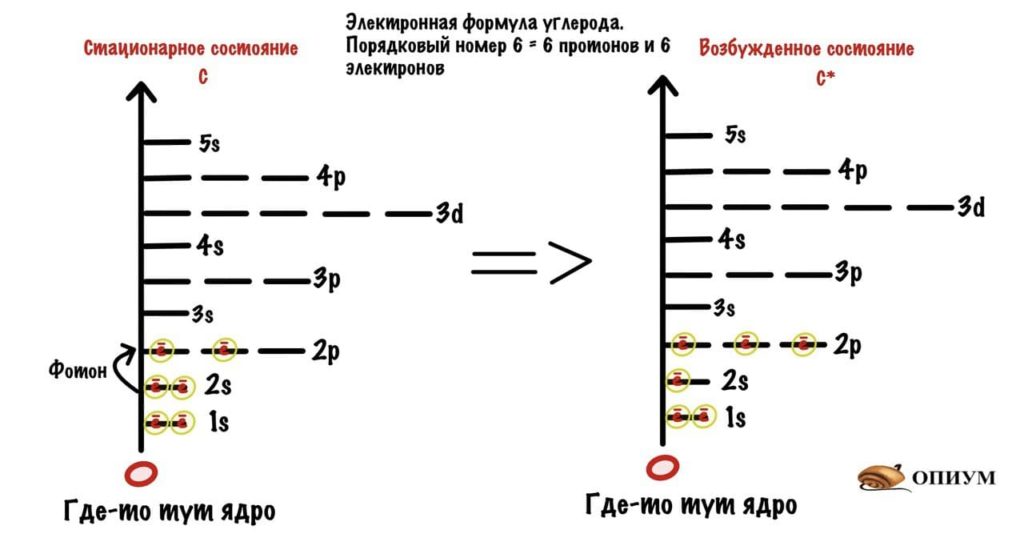
Электронная формула углерода
И тут встал вопрос. Атом углерода в возбужденном состоянии может образовать четыре связи, так как у него четыре неспаренных электрона. Но энергия связей будет разной, потому что эти электроны располагаются на разных орбиталях (у p орбитали энергия побольше). Это не очень хорошо сказывается на стабильности системы. Как выйти из этого положения? Атом придумал интересную штуку — он изменил форму и размеры орбиталей. Это и есть гибридизация.
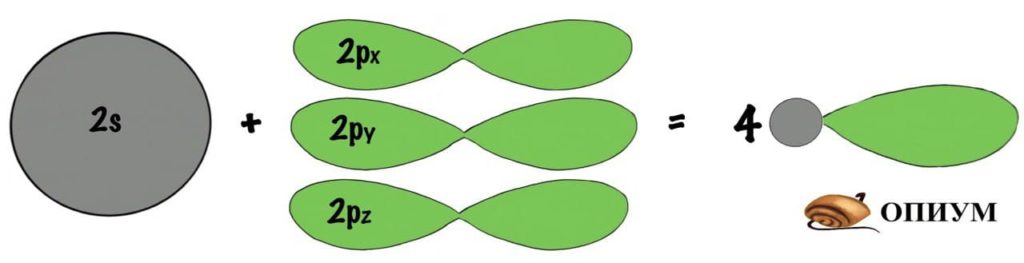
sp 3 -гибридизация
sp 3 -гибридизация
Когда три p орбитали объединяются с одной s, тогда получается sp 3 -гибридизация. Форма молекулы примерно такая:
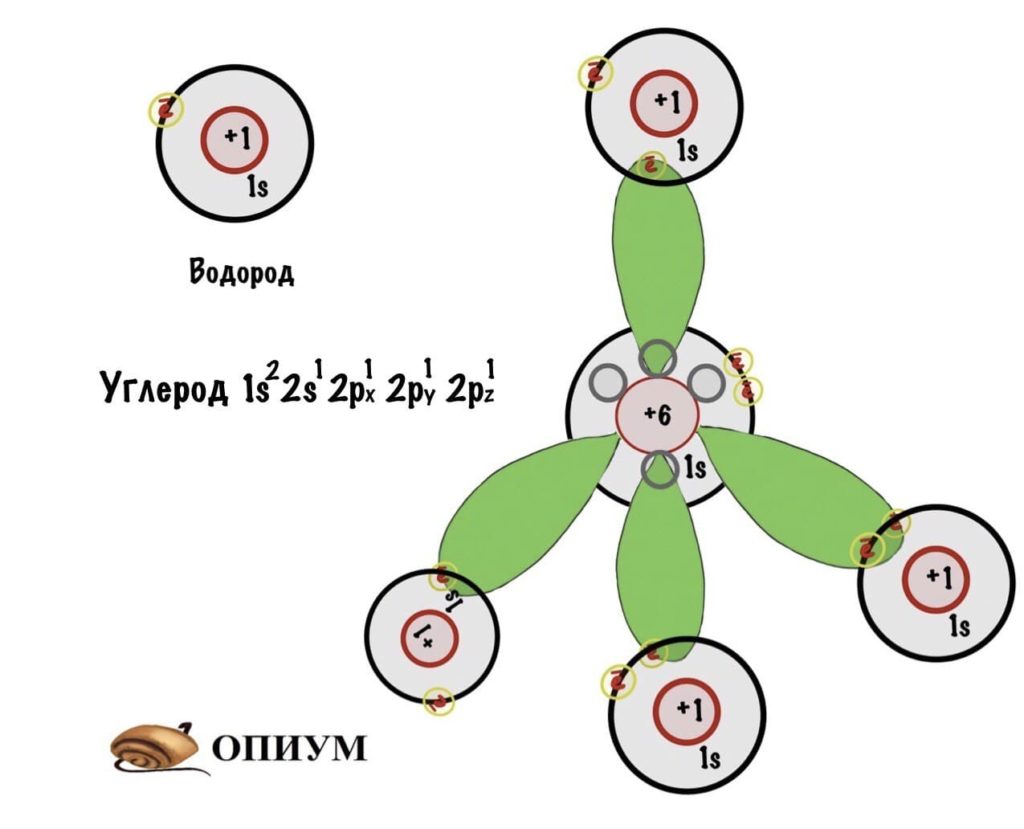
Гибридизация в метане
И на рисунке не особо понятно, но это тетраэдр или правильная треугольная пирамида. Просто рисовать в плоскости у меня не особо хорошо получается. Здесь между орбиталями легендарный угол — 109 о 28 ‘ . В организме почти весь углерод в такой гибридизации. Но не только у него бывает sp 3 -гибридизация. В молекулах аммиака и воды тоже такая гибридизация, но с нюансом, смотрите.
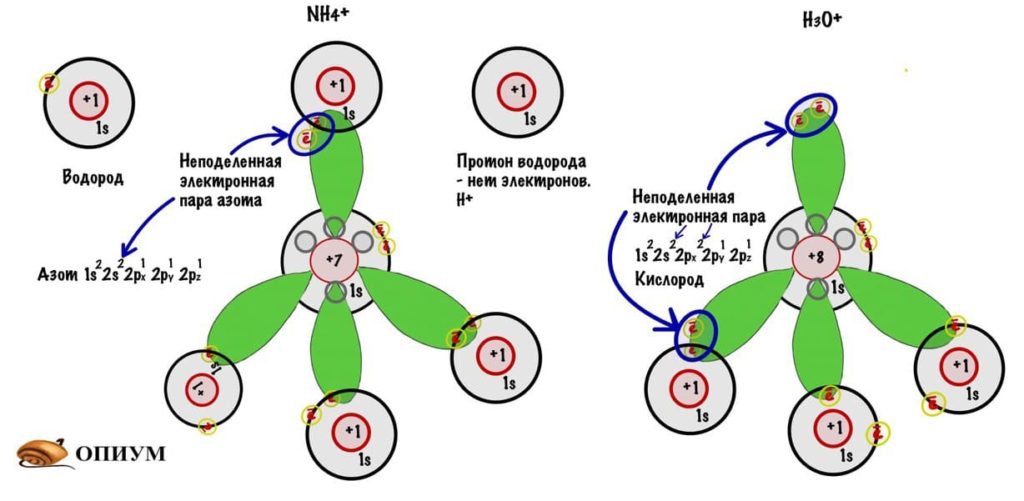
Ионы аммония и гидроксония
У азота есть одна неподеленная электронная пара на втором энергетическом слое, а именно на 2s-орбитали — там находится два электрона и третий туда уже не засунуть. Но азот может отдать протону водорода один электрон по донорно-акцептерному механизму и образовать связь. Так возникает ион аммония. Такая же тема с водой, но кислород не может отдать по электрону от каждой электронной пары — только с одной! Так образуется ион гидроксония.
sp 2 и sp-гибридизация
Название говорит само за себя. При sp 2 -гибридизации одна p-орбиталь остается без изменений, а две другие гибридизируются с s-орбиталью. Все орбитали лежат в одной плоскости под углом 120 градусов.

sp 2 -гибридизация
Куда пропала p-связь? Ну ладно, держите формулу этилена со всеми связями.
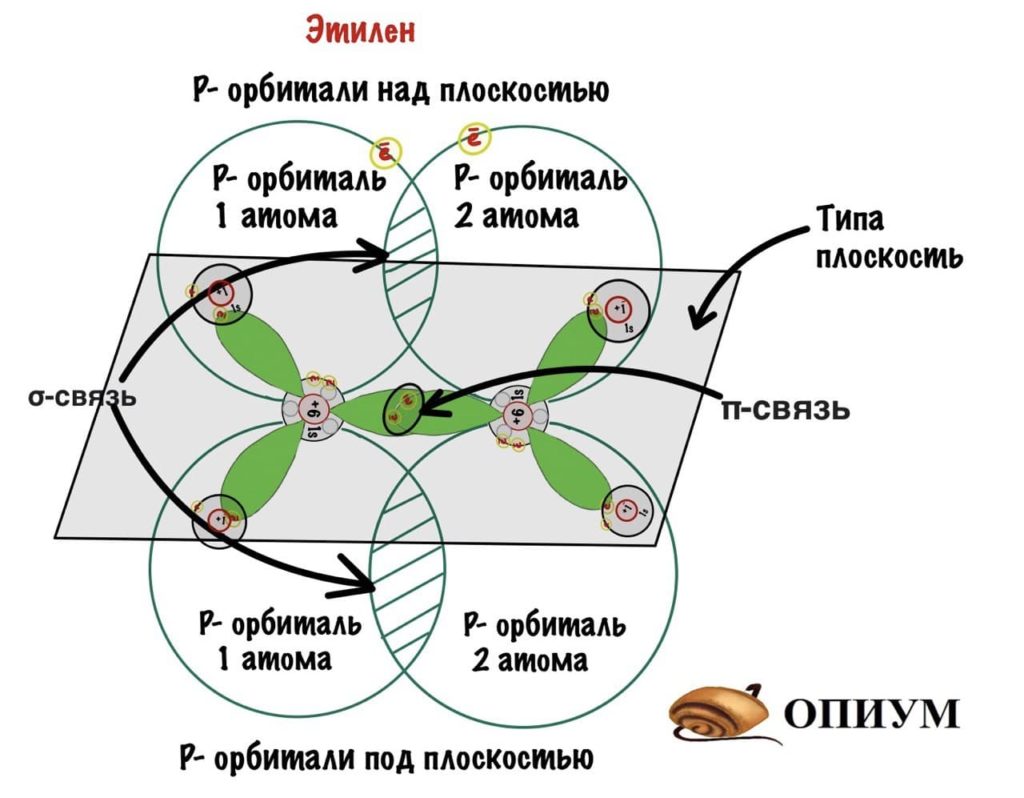
sp 2 -гибридизация в этилене
На рисунке видно, что p-орбитали без гибридизации находятся над и под плоскостью, они образуют сигма-связь — эта связь более жесткая, чем пи-связь. Поэтому вращение вокруг нее ограничено.
sp-гибридизацию нарисовать не смогу, сорян. Но смысл вы поняли: без изменений останутся две p-орбитали, а две sp-орбитали будут похожи на палочку — угол между ними будет 180 градусов. Одна p-орбиталь будет идти над плоскостью, а другая смотреть в лицо. Надеюсь, что у тебя получилось представить. Едем дальше.
Атомный остов
Есть еще такое понятие — ядерный остов, оно понадобится нам дальше. Сейчас быстро разберемся с ним.
Электронный слой бывает завершенным или незавершенным:
- Завершенный, если все орбитали заняты электронами.
- Незавершенный, если заняты не все.
Заряд ядра атома (количество протонов) + заряд завершенных слоев (количество электронов) = атомный остов. Картинка….
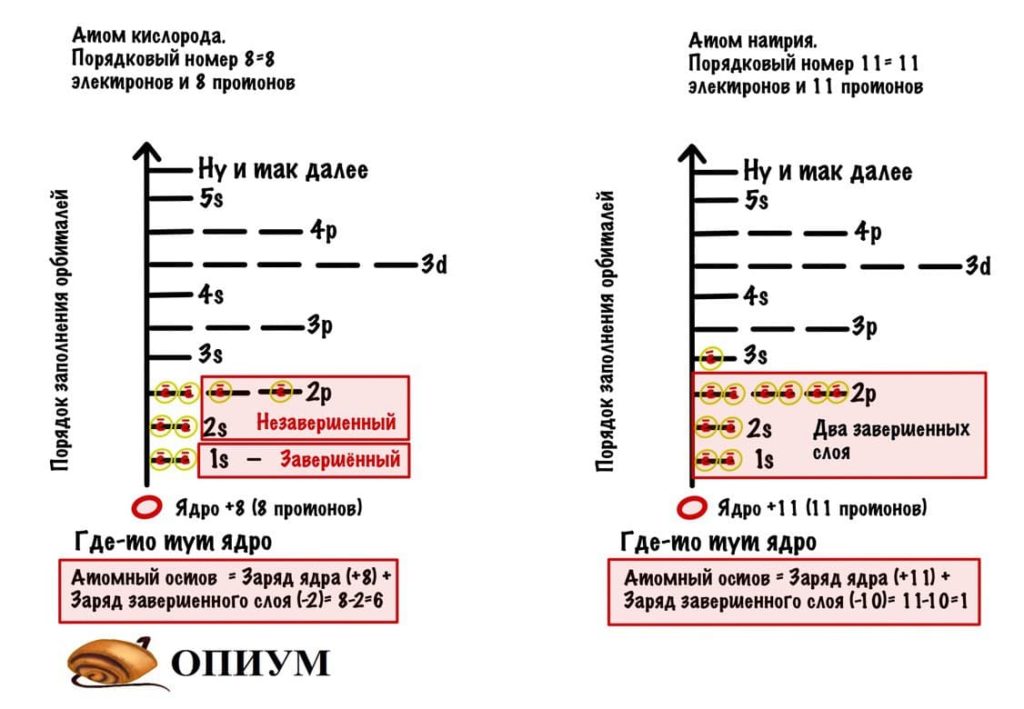
Атомный остов
У кислорода заряд атомного остова больше, чем у натрия. Это нам понадобится, когда будем считать электроотрицательность.
Фух, со строением атома закончили. Поздравляю всех, кто дочитал до этого момента. Дальше можно переходить к электроотрицательности, но это уже в следующей статье.
Ого, вы реально дочитали до конца? Наверное, она вам понравилась. Если так, то может понравиться и телеграм канал. Там можно задать вопрос или указать на ошибку.
Атомы и электроны
Мы приступаем к изучению химии — мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными формулами элементов.
Атом (греч. а — отриц. частица + tomos — отдел, греч. atomos — неделимый) — электронейтральная частица вещества микроскопических размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом

Протон (греч. protos — первый) — положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов элементов. Нейтрон (лат. neuter — ни тот, ни другой) — нейтральная (0) элементарная частица, присутствующая в ядрах всех химических элементов, кроме водорода.
Электрон (греч. elektron — янтарь) — стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома — порядковый номер в таблице Менделеева — равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.

Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Состоит из s-подуровня: одной «1s» ячейки, в которой помещаются 2 электрона (заполненный электронами — 1s 2 )
Состоит из s-подуровня: одной «s» ячейки (2s 2 ) и p-подуровня: трех «p» ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s 2 ), p-подуровня: трех «p» ячеек (3p 6 ) и d-подуровня: пяти «d» ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s 2 ), p-подуровня: трех «p» ячеек (4p 6 ), d-подуровня: пяти «d» ячеек (4d 10 ) и f-подуровня: семи «f» ячеек (4f 14 ), на которых помещается 14 электронов

Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь — клеверный лист.

Правила заполнения электронных орбиталей и примеры
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной «ячейке») не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются еще одним электроном с противоположным направлением
- Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода — 6, у серы — 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.

Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
- Углерод — 1s 2 2s 2 2p 2
- Серы — 1s 2 2s 2 2p 6 3s 2 3p 4
Внешний уровень и валентные электроны
- Углерод — 2s 2 2p 2 (4 валентных электрона)
- Сера -3s 2 3p 4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью — способностью атомов образовывать определенное число химических связей.

- Углерод — 2s 2 2p 2 (2 неспаренных валентных электрона)
- Сера -3s 2 3p 4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.

- Магний — 1s 2 2s 2 2p 6 3s 2
- Скандий — 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1
Строение атома. Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева

Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. В центре атома находится положительно заряженное ядро. Оно занимает ничтожную часть пространства внутри атома, в нём сосредоточены весь положительный заряд и почти вся масса атома.
Ядро состоит из элементарных частиц — протона и нейтрона; вокруг атомного ядра по замкнутым орбиталям движутся электроны.
Протон (р) — элементарная частица с относительной массой 1,00728 атомной единицы массы и зарядом +1 условную единицу. Число протонов в атомном ядре равно порядковому номеру элемента в Периодической системе Д.И. Менделеева.
Нейтрон (n) — элементарная нейтральная частица с относительной массой 1,00866 атомной единицы массы (а. е. м.).
Число нейтронов в ядре N определяют по формуле:
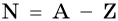
где А — массовое число, Z — заряд ядра, равный числу протонов (порядковому номеру).
Обычно параметры ядра атома записывают следующим образом: слева внизу от символа элемента ставят заряд ядра, а вверху — массовое число, например:
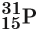
Эта запись показывает, что заряд ядра (следовательно, и число протонов) для атома фосфора равен 15, массовое число равно 31, а число нейтронов равно 31 – 15 = 16. Так как массы протона и нейтрона очень мало отличаются друг от друга, то массовое число приблизительно равно относительной атомной массе ядра.
Электрон ( е – ) — элементарная частица с массой 0,00055 а. е. м. и условным зарядом –1. Число электронов в атоме равно заряду ядра атома (порядковому номеру элемента в Периодической системе Д.И. Менделеева).
Электроны движутся вокруг ядра по строго определённым орбиталям, образуя так называемое электронное облако.
Область пространства вокруг атомного ядра, где наиболее (90 и более %) вероятно нахождение электрона, определяет форму электронного облака.
Электронное облако s-электрона имеет сферическую форму; на s-энергетическом подуровне может максимально находиться два электрона.
Электронное облако p-электрона имеет гантелеобразную форму; на трёх p-орбиталях максимально может находиться шесть электронов.
Орбитали изображают в виде квадрата, сверху или снизу которого пишут значения главного и побочного квантовых чисел, описывающих данную орбиталь. Такую запись называют графической электронной формулой, например:
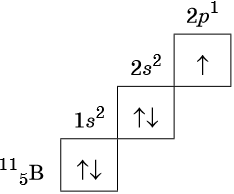
В этой формуле стрелками обозначают электрон, а направление стрелки соответствует направлению спина — собственного магнитного момента электрона. Электроны с противоположными спинами ↑↓ называют спаренными.
Электронные конфигурации атомов элементов можно представить в виде электронных формул, в которых указывают символы подуровня, коэффициент перед символом подуровня показывает его принадлежность к данному уровню, а степень у символа — число электронов данного подуровня.
В таблице 1 приведено строение электронных оболочек атомов первых 20 элементов Периодической системы химических элементов Д.И. Менделеева.
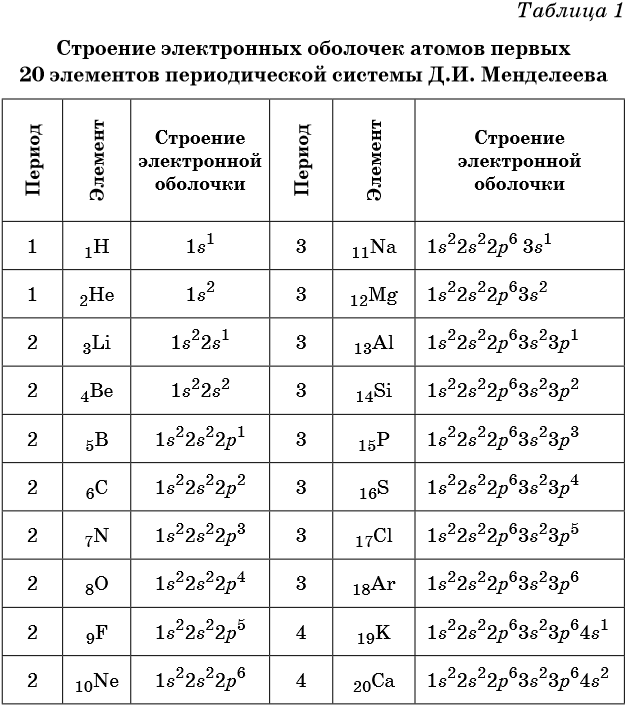
Химические элементы, в атомах которых s-подуровень внешнего уровня пополняется одним или двумя электронами, называют s-элементами. Химические элементы, в атомах которых заполняется p-подуровень (от одного до шести электронов), называют p-элементами.
Число электронных слоёв в атоме химического элемента равно номеру периода.
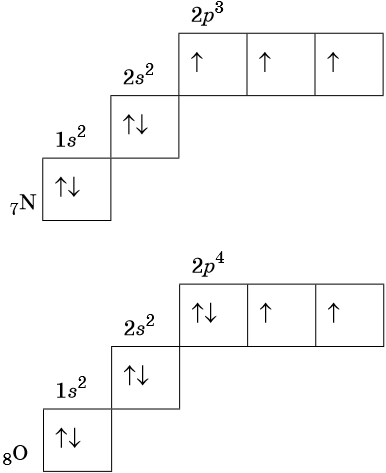
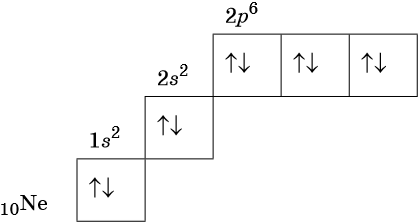
В соответствии с правилом Хунда электроны располагаются на однотипных орбиталях одного энергетического уровня таким образом, чтобы суммарный спин был максимален. Следовательно, при заполнении энергетического подуровня каждый электрон прежде всего занимает отдельную ячейку, а только после этого начинается их спаривание. Например, у атома азота все p-электроны будут находиться в отдельных ячейках, а у кислорода начнётся их спаривание, которое полностью закончится у неона.
Изотопами называют атомы одного и того же элемента, содержащие в своих ядрах одинаковое число протонов, но различное число нейтронов.
Изотопы известны для всех элементов. Поэтому атомные массы элементов в периодической системе являются средним значением из массовых чисел природных смесей изотопов и отличаются от целочисленных значений. Таким образом, атомная масса природной смеси изотопов не может служить главной характеристикой атома, а следовательно, и элемента. Такой характеристикой атома является заряд ядра, определяющий число электронов в электронной оболочке атома и её строение.
Рассмотрим несколько типовых заданий по этому разделу.
Пример 1. Атом какого элемента имеет электронную конфигурацию 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 ?
На внешнем энергетическом уровне у данного элемента находится один 4s-электрон. Следовательно, этот химический элемент находится в четвёртом периоде первой группе главной подгруппе. Этот элемент — калий.
К этому ответу можно прийти по-другому. Сложив общее количество всех электронов, получим 19. Общее число электронов равно порядковому номеру элемента. Под номером 19 в периодической системе находится калий.
Пример 2. Химическому элементу соответствует высший оксид RO2. Электронной конфигурации внешнего энергетического уровня атома этого элемента соответствует электронная формула:
- ns 2 np 4
- ns 2 np 2
- ns 2 np 3
- ns 2 np 6
По формуле высшего оксида (смотрите на формулы высших оксидов в Периодической системе) устанавливаем, что этот химический элемент находится в четвёртой группе главной подгруппы. У этих элементов на внешнем энергетическом уровне находятся четыре электрона — два s и два p. Следовательно, правильный ответ 2.
Тренировочные задания
1. Общее число s-электронов в атоме кальция равно
2. Число спаренных p-электронов в атоме азота равно
3. Число неспаренных s-электронов в атоме азота равно
4. Число электронов на внешнем энергетическом уровне атома аргона равно
5. Число протонов, нейтронов и электронов в атоме 9 4Be равно
1) 9, 4, 5
2) 4, 5, 4
3) 4, 4, 5
4) 9, 5, 9
6. Распределение электронов по электронным слоям 2; 8; 4 — соответствует атому, расположенному в(во)
1) 3-м периоде, IА группе
2) 2-м периоде, IVА группе
3) 3-м периоде, IVА группе
4) 3-м периоде, VА группе
7. Химическому элементу, расположенному в 3-м периоде VA группе соответствует схема электронного строения атома
1) 2, 8, 6
2) 2, 6, 4
3) 2, 8, 5
4) 2, 8, 2
8. Химический элемент с электронной конфигурацией 1s 2 2s 2 2p 4 образует летучее водородное соединение, формула которого
9. Число электронных слоёв в атоме химического элемента равно
1) его порядковому номеру
2) номеру группы
3) числу нейтронов в ядре
4) номеру периода
10. Число внешних электронов в атомах химических элементов главных подгрупп равно
1) порядковому номеру элемента
2) номеру группы
3) числу нейтронов в ядре
4) номеру периода
11. Два электрона находятся во внешнем электронном слое атомов каждого из химических элементов в ряду
1) He, Be, Ba
2) Mg, Si, O
3) C, Mg, Ca
4) Ba, Sr, B
12. Химический элемент, электронная формула которого 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 , образует оксид состава
13. Число электронных слоев и число p-электронов в атоме серы равно
1) 2, 6
2) 3, 4
3) 3, 16
4) 3, 10
14. Электронная конфигурация ns 2 np 4 соответствует атому
1) хлора
2) серы
3) магния
4) кремния
15. Валентные электроны атома натрия в основном состоянии находятся на энергетическом подуровне
1) 2s
2) 2p
3) 3s
4) 3p
16. Атомы азота и фосфора имеют
1) одинаковое число нейтронов
2) одинаковое число протонов
3) одинаковую конфигурацию внешнего электронного слоя
4) одинаковое число электронов
17. Одинаковое число валентных электронов имеют атомы кальция и
1) калия
2) алюминия
3) бериллия
4) бора
18. Атомы углерода и фтора имеют
1) одинаковое число нейтронов
2) одинаковое число протонов
3) одинаковое число электронных слоёв
4) одинаковое число электронов
19. У атома углерода в основном состоянии число неспаренных электронов равно
20. В атоме кислорода в основном состоянии число спаренных электронов равно