Электронная структура атомов
Основными характеристиками атома, которые определяют его поведение в химических реакциях и при образовании простых веществ, является строение внешнего электронного слоя и энергия электронов относительно положительно заряженного ядра. Обе характеристики подлежат периодической зависимости от порядкового номера элемента, который всегда указывается в периодической таблице элементов.
Согласно современным квантово-механическими представлениями конфигурация электронной оболочки определяется зарядом ядра атома и положением элемента в периодической системе. Как уже установлено, электроны с одинаковым значением главного квантового числа образуют квантовые уровни, емкость которых увеличивается по мере удаления от ядра. Квантовые уровне, в свою очередь, построенные из подуровней, объединяющих электроны с одинаковым значением орбитального квантового числа. А подуровни состоят из орбиталей, на каждой из которых может находиться не более двух электронов.
Распределение электронов в атоме выражают с помощью электронной формулы (условного записи распределения электронов в атоме с помощью квантовых чисел) и электронно-графической схемы — квантовых ячеек, в которых клеточка символизирует орбиталь, а стрелка — электрон.
Таблица 1 — Электронное строение атомов элементов первых трех периодов
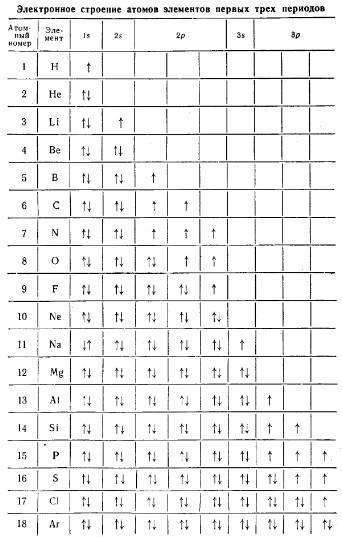
В электронных формулах цифрами указывают номер энергетического уровня, латинскими буквами — энергетические подуровни, а цифрами вверху справа — количество электронов на подуровне. Например, условная запись 5d 4 означает, что на d-подуровне пятого энергетического уровня размещаются четыре электрона.
При составлении электронной формулы атома любого элемента полезно помнить несколько очевидных закономерностей:
Общее количество энергетических уровней (а следовательно, и номер внешнего уровня) определяется значением главного квантового числа n и соответствует номеру периода, в котором размещается элемент.
Например, элемент магний (порядковый номер 12) находится в третьем периоде периодической системы элементов, поэтому двенадцать электронов атома Mg размещаются на трех энергетических уровнях. При этом третий, наиболее удаленный от ядра уровень является внешним, для него главное квантовое число n = 3.
Энергетические уровни расщепляются на энергетические подуровни, для описания которых используются буквенные обозначения орбитального квантового числа l. Количество энергетических подуровней на данном уровне совпадает с номером этого уровня и определяется значением главного квантового числа n (или количеством значений орбитального квантового числа l).
Таким образом, на первом энергетическом уровне (для которого n = 1) существует только один подуровень 1s (напомним: для s-подуровня орбитальное квантовое число l = 0), на втором — два подуровня (2s и 2p), на третьем — три (3s, 3p, 3d), на четвертом — четыре (4s, 4p, 4d, 4f) и т.д.
Энергетические подуровни состоят из орбиталей. Количество орбиталей на энергетическом подуровне определяется количеством значений магнитного квантового числа m, равное (2l + 1).
Графически орбитали изображаются в виде квантовых ячеек, каждая из которых имеет форму небольшого квадратика. Орбитали одного энергетического подуровня изображаются слитно:

Элементы малых периодов
В первых трех периодах, которые называются малыми (или типичными), с увеличением заряда ядра происходит заполнение электронами внешнего энергетического уровня, номер которого совпадает с номером периода в периодической системе.
Первый период состоит из двух элементов. У атома водорода один электрон размещается на единой орбитали s-подуровня первого энергетического уровня (n = 1). Электронная формула водорода записывается:

В соответствии с принципом Паули на s-орбитали может находиться два электрона с антипараллельными спинами, поэтому электронная формула атома гелия имеет следующий вид:

Благодаря такому размещению электронов образуется устойчивая конфигурация, которая определяет химическую инертность гелия. В атоме гелия завершается застройка ближайшего к ядру первого энергетического уровня.
Элементы, в атомах которых застраивается электронами s-орбитали внешнего энергетического уровня, называются s-элементами.
Все s-элементы объединяются в s-электронную семью, которая в периодической системе элементов размещается в двух первых группах, за исключением s-элемента гелия Не, который традиционно зачисляют в VIII группу благодаря его принадлежности к инертным элементам.
У элементов второго периода происходит заполнение второго энергетического уровня (второй энергетический уровень, n = 2): сначала заполняется 2s-орбиталь, а затем последовательно три 2р-орбитали. Для упрощения на электронных схемах указываются только полностью заполненные энергетические уровни, например
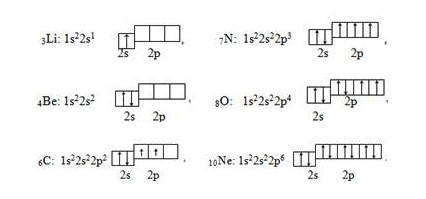
Элементы Li и Be относятся к s-электронной семьи, поскольку в их атомах именно на s-подуровень поступает последний электрон — так называемый формообразующие электрон (или просто формирующий ), то есть, который определяет принадлежность атома к элементам конкретной электронной семьи. В следующих шести элементах, начиная от карбона 6С и заканчивая неоном 10Ne, формирующие электроны заполняют р-подуровень ( l = 1) второго энергетического L-уровня (n = 2).
Элементы, в атомах которых заполняются электронами р-орбитали внешнего энергетического уровня, называются р-элементами.
Cовокупность всех р-элементов составляет р-электронную семью. Р-элементы размещаются в III-VIII группах периодической системы Д.И.Менделеева.
Для s- и р-элементов присуща интересная особенность: количество внешних (валентных) электронов равно номеру группы. Справедливо и обратное утверждение: по количеству валентных электронов в атомах можно установить, в какой группе находится данный элемент.
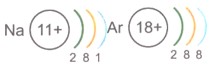
Третий период, в котором проходит застройка третьего энергетического уровня (n = 3), как и второй, содержит восемь элементов: два s-элемента (Na, Mg) и шесть р-элементов (Al, Si, P, S, Cl, Ar ), причем конфигурация внешнего энергетического уровня соответствующих элементов второго и третьего периодов аналогична. Например, у элементов VII группы фтора и хлора заполнения электронами внешних энергетических уровней происходит подобным образом, что хорошо видно при сравнении электронных формул:

Благодаря одинаковой электронной конфигурации внешнего электронного слоя, для изображения внешнего энергетического уровня элементов F и Cl можно использовать общую формулу ns 2 np 5 , где n — значение главного квантового числа для внешнего уровня и одновременно номер периода.
Элементы с одинаковой электронной конфигурацией внешнего энергетического уровня называются элементами-аналогами .
Необходимо помнить, что у элементов третьего периода остается свободным 3d-подуровень.
Элементы больших периодов
Четвертый и пятый периоды содержат по восемнадцать элементов. В атомов элементов четвертого периода происходит застройка четвертого энергетического уровня (n = 4), начиная с 4s-орбитали. Появление электрона в 4s-состоянии при наличии свободных 3d-орбиталей обусловлено экранированием ядра электронами, образующими плотный и симметричный слой 3s 2 3p 6 . В связи с отталкиванием от этого слоя для формообразующего девятнадцатого электрона атома калия (№19) и формообразующего двадцатого электрона атома кальция (№20) наиболее выгодным является 4s-состояние:

Застройка электронами внешнего 4s-подуровня атомов К и Са при наличии свободного 3d-подуровня согласуется с первым правилом Клечковского: сумма главного n и орбитального l квантовых чисел для 4s-подуровня меньше, чем для 3d:
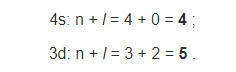
А согласно второму правилу Клечковского после 4s-подуровня, несмотря на одинаковую сумму (n + l = 5), будет заполняться электронами 3d, а не 4p, поскольку именно 3d имеет меньшее значение главного квантового числа:
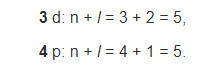
Итак, в десяти элементов — от скандия ( 21Sc) до цинка ( 30Zn) происходит заполнение электронами 3d-подуровня. Для сокращения записи электронных формул в квадратных скобках указывается символ предыдущего инертного элемента (в данном случае аргона Ar), что означает его электронную структуру, которая совпадает с электронными структурами внутренних электронных слоев рассматриваемого элемента. К примеру:
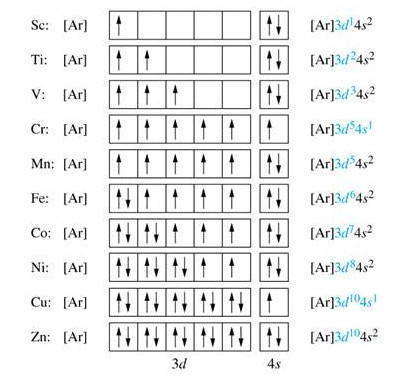
Элементы, в атомах которых заполняются d-орбитали второго снаружи энергетического уровня, называется d-элементами.
Электронная семья d-элементов, в атомах которых проходит заполнения электронами второго извне d-подуровня, размещаются в боковых подгруппах периодической системы Д.И.Менделеева.
Как показал анализ, в атомах некоторых d-элементов наблюдается самовольное перемещение электронов с n s-подуровня на ( n-1 ) d-подуровень. Такое явление называется проскоком электронов. Оно связано со стремлением атома иметь энергетически устойчивую конфигурацию, которой соответствуют полностью или наполовину застроенные электронами энергетические подуровни. Так, для атома хрома наблюдается процесс, когда электрон с 4s-подуровня переходит на 3d. Это приводит к энергетической стабилизации атома: 24Cr: [Ar] 4s 1 3d 5 .
В атоме элемента медь происходит такой же проскок электрона с 4s-подуровня на 3d: 29Сu: [Ar] 4s 1 3d 10 . В результате на внешнем уровне атома Сu остается только один электрон — именно этим объясняется, почему медь размещается в первой группе периодической системы в отличие от следующего элемента цинка ( 30Zn: [Ar] 4s 2 3d 10 ), который имеет два электрона на внешнем энергетическом уровне, что и определяет его принадлежность ко второй группе периодической системы.
Итак, четвертый период начинается 4s-элементами (двумя) и заканчивается 4р-элементами (шестью), а между ними располагаются десять 3d-элементов, в которых заполняется второй снаружи d-подуровень.
В пятом периоде заполнение энергетических уровней и подуровней происходит аналогично четвертому периоду, а именно: у атомов двух первых элементов ( 37Rb и 38Sr) застраиваются 5s-орбитали, у атомов следующих десяти (от 39Y до 48Cd) — 4d- орбитали, а еще в шести (от 49In до 54Xe) — 5p-орбитали. Надо отметить, что в пяти d-элементов пятого периода ( 41Nb, 42Mo, 44Ru, 45Rh, 47Ag) тоже, как и у атома хрома в четвертом периоде, наблюдается проскок одного, а в 46Pd — даже двух электронов с внешнего 5s-подуровня на предыдущей 4d-подуровень. Примеры электронных формул элементов пятого периода:
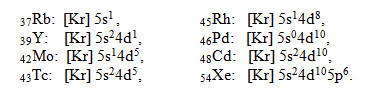
Шестой период , содержащий 32 элемента, начинается двумя s-элементами ( 55Cs, 56Ba), в атомах которых заполняется 6s орбиталь. В следующем элемента, лантанеа, формирующий, пятьдесят седьмой, электрон поступает на 5d-орбиталь (5d: n + l = 5 + 2 = 7), вопреки второму правилу Клечковского, вместо того, чтобы заполнять 4f-подуровень (4f: n + l = 4 + 3 = 7). Это явление обусловлено более резким уменьшением энергии 4f-электронов с ростом заряда ядра по сравнению с энергией 5d-электронов. Поэтому в 57La энергия 5d-электронов ниже, а в 58Се выше, чем энергия 4f-электронов. Но в следующих четырнадцати элементах от 58Се до 71Lu состояние 4f энергетически более выгодно, чем состояние 5d, поэтому в их атомах происходит застройка 4f-орбиталей.
Элементы, в атомах которых заполняются электронами f-орбитали третьего снаружи уровня, называются f-элементами.
Далее, начиная с 72Hf, продолжается заполнение 5d-орбиталей в десяти элементах до ртути 80Hg включительно. Период заканчивается р-элементами ( 81Tl — 86Rn), в атомах которых застраивается 6р подуровень. Проскоки электронов с внешнего 6s-подуровня на предыдущий 5d-подуровень наблюдаются в двух элементах: платине 78 Pt и золоте 79 Au. Примеры электронных структур элементов шестого периода:
Таким образом, шестой период состоит из двух s-элементов, шести р, десяти d- и четырнадцати f-элементов.
Седьмой период еще не завершен. Заполнение энергетических уровней и подуровней происходит в нем подобно тому, как и у атомов элементов шестого периода. Период начинается двумя s-элементами ( 87Fr, 88Ra ). За ними следуют d-элементы ( 89Ас, 90Th ), а затем тринадцать f-элементов ( 91Ра — 103Lr). Завершают периодическую систему d-элементы. Примеры электронных конфигураций элементов седьмого периода:
§12. Строение электронных оболочек атома

Общее число электронов в атоме известно — оно равно заряду ядра. Но электроны, обладая различным запасом энергии, по-разному располагаются в атоме. Чем выше энергия электрона, тем дальше он может находиться от ядра, и, следовательно, тем больше по размеру его орбиталь. И наоборот, электроны, обладающие меньшей энергией, движутся в основном вблизи ядра. Так образуются как бы оболочки (слои) из электронов с близкими значениями энергии, которые так и называются — электронные оболочки (электронные слои).
Электронный слой — это совокупность электронов с близкими значениями энергии.
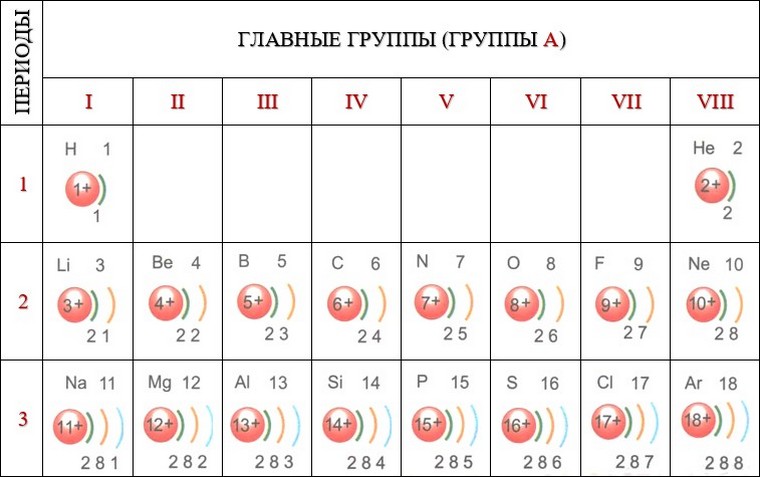
Число электронов на том или ином слое различно и в основном определяется их энергией. На первом электронном слое максимально может находиться 2 электрона. Схематично для атомов водорода и гелия это можно изобразить так, как показано на рисунке.
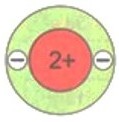
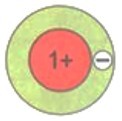
У атомов следующего элемента периодической системы лития Li имеется уже три электрона. Два расположены на первом электронном слое, который считается завершенным. Третий электрон обладает большей энергией, поэтому находится дальше от ядра, начиная формирование второго электронного слоя, который является внешним по отношению к первому слою.
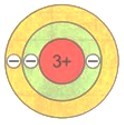
Графическое изображение распределения электронов по слоям называется электронной схемой атома.
У элементов, следующих за литием, возрастает заряд ядра атомов, а следовательно, и число электронов. Они постепенно заполняют второй электронный слой вплоть до 8 электронов у атома неона Ne.
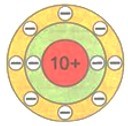
Восемь — это максимальное число электронов второго электронного слоя. У атома натрия Na, следующего за неоном элемента, начинается заполнение третьего электронного слоя: от одного электрона у атома натрия Na до восьми у атома аргона Аr.
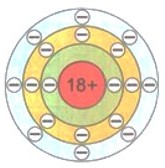
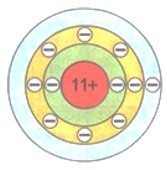
Упрощенно электронные схемы атомов изображают таким образом:
Внешний электронный слой, который содержит 8 электронов, называется завершенным.
Нетрудно сделать вывод, что число электронных слоев в атоме любого элемента совпадает с номером периода, в котором он находится. В этом заключается физический смысл (сущность) номера периода.
Сопоставим электронное строение атомов элементов первых трех периодов. На внешнем электронном слое атомов элементов одной группы содержится одинаковое число электронов. Так, литий Li, натрий Na, калий К имеют на внешнем слое по одному электрону, бериллий Be, магний Mg — по два, бор В, алюминий Аl — по три и т. д. У атомов благородных газов неона Ne и аргона Аr на внешнем слое по 8 электронов. Следовательно, строение внешнего электронного слоя атомов периодически повторяется.
Электроны внешнего слоя связаны с ядром слабее, чем остальные, поэтому подвижны.
Они определяют химические свойства данного атома, т. е. его способность взаимодействовать с другими атомами. Такие электроны называют валентными.
Нетрудно заметить, что у атомов элементов A-групп число валентных электронов равно номеру группы, обозначенному римской цифрой. Эта закономерность отражает физический смысл номера А-группы.
Именно в этом заключается физический смысл (сущность) периодическою закона.
ЭТО ИНТЕРЕСНО
Посмотрим в таблицу Д.И. Менделеева на количественное распределение элементов в периодах:
в первом периоде 2 элемента,
во втором периоде 8 элементов,
в третьем периоде 8 элементов,
в четвертом периоде 18 элементов,
в пятом периоде 18 элементов,
в шестом периоде 32 элемента,
в седьмом периоде 32 элемента.
А теперь посмотрим на распределение электронов по слоям:
на первом слое максимум 2 электрона,
на втором слое максимум 8 электронов,
на третьем слое максимум 8 электронов,
на четвертом слое максимум 18 электронов,
на пятом слое максимум 18 электронов,
на шестом слое максимум 32 электрона,
на седьмом слое максимум 32 электрона.
Если вы забыли максимальное количество электронов на слоях, достаточно посмотреть в таблицу Д. И. Менделеева на количество элементов в периоде, помня, что номер периода соответствует количеству электронных слоев.
Итак, сегодня мы узнали:
1. Электроны с близкими значениями энергии составляют электронный слой.
2. Число электронных слоев в атоме любого элемента равно номеру периода, в котором он находится.
3. На внешнем электронном слое атомов максимально может находиться не более восьми электронов. Такой электронный слой называется завершенным.
4. Электроны внешнего слоя называются валентными.
5. Периодическая повторяемость свойств атомов химических элементов объясняется периодическим повторением строения их внешних электронных слоев.
Что такое завершенный слой

«Строение электронных оболочек атомов»
Ключевые слова конспекта: строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева, завершенный электронный слой, валентный слой, энергетические уровни, правило октета, орбиталь,
Электронная оболочка атома — это все электроны атома. Электроны в электронной оболочке атома расположены слоями. Электроны в разных слоях различаются энергией взаимодействия с ядром атома. Чем дальше от ядра находится электрон, тем меньше энергия его взаимодействия с ядром.
Вместимость электронных слоев различная. В слое № 1, или в первом слое, у всех элементов, кроме водорода, находится 2 электрона. (В атоме водорода всего 1. электрон, и он — в первом слое.) Во втором слое может находиться не больше восьми электронов. В третьем слое максимально может расположиться 18 электронов. В четвертом слое максимально бывает 32 электрона.
Если N — максимальное число электронов на электронном слое с номером n, то для определения числа N можно воспользоваться формулой N = 2n 2 .
Завершенный электронный слой — это слой в атоме, содержащий максимально возможное для него число электронов.
Электронные слои заполняются так: сначала первый, потом второй и последующие — по мере уменьшения энергии их взаимодействия с ядром. Расположение по слоям электронов в атомах водорода, кислорода и магния:
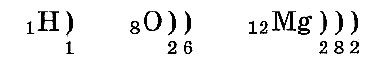
Число электронных слоев атома равно номеру периода химического элемента в таблице Менделеева. Поэтому у атома водорода один электронный слой, у кислорода — два слоя, а у магния — три слоя.
Валентный слой — это внешний электронный слой. У водорода это 1-й слой, у кислорода — 2-й слой, у магния — 3-й слой. Валентные электроны — это электроны внешнего слоя. Внешний слой всегда содержит не больше восьми электронов. Восьми-электронный внешний слой характеризуется повышенной устойчивостью. (Это — «правило октета».)

Зная максимальное число электронов в каждом электронном слое атома, можно составить схему расположения электронов по слоям в заданном элементе. Электронные слои атомов называют энергетическими уровнями.
Химические свойства атомов определяются свойствами их электронов. Движение электронов в атоме описывают с привлечением понятия орбитали. Каждый электрон в атоме находится на своей орбитали.

Орбиталь — это часть электронного облака, создаваемого электронами при движении в атоме. Орбиталь — это пространство около ядра, где чаще всего находится электрон.
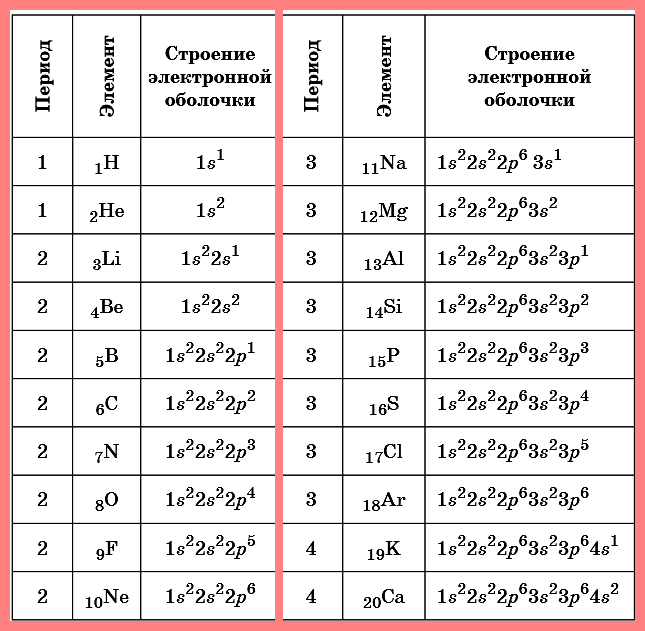
Электроны первых 30 химических элементов от водорода до цинка размещены на орбиталях трех видов — s , р и d . Вместимость любой орбитали — два электрона. На 1-м энергетическом уровне одна s-орбиталь.
Таблица. Строение электронных оболочек атомов
первых 20 элементов Периодической системы Д.И. Менделеева
Приведем некоторые сведения, которые следуют из электронной формулы атома на примере атома фтора: F 1s 2 2s 2 2р 5 .
Фтор — элемент 2-го периода, т.к. в его электронной формуле два электронных слоя. Сумма всех надстрочных индексов — 9 (общее число электронов), это и атомный номер фтора. Элементы, у которых очередные электроны помещаются на s- и р-орбиталях, относятся к главным подгруппам таблицы Менделеева. Сумма электронов 2-го внешнего слоя дает номер группы — VII.
Подготовка к ОГЭ по химии. 9 класс
Строение атома. Строение электронных оболочек атомов.
Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки. Ядро находится в центре атома и состоит из положительно заряженных протонов и незаряженных нейтронов, удерживаемых ядерными силами. Ядерное строение атома экспериментально доказал в 1911 г. английский физик Э.Резерфорд.
Число протонов определяет положительный заряд ядра и равно порядковому номеру элемента. Число нейтронов вычисляется как разность атомной массы и порядкового номера элемента. Элементы, имеющие одинаковый заряд ядра (одинаковое число протонов), но разную атомную массу (разное количество нейтронов) называются изотопами. Масса атома в основном сосредоточена в ядре, т.к. ничтожно малой массой электронов можно пренебречь. Атомная масса равна сумме масс всех протонов и всех нейтронов ядра.
Химический элемент — это вид атомов с одинаковым зарядом ядра. В настоящее время известно 118 различных химических элементов.
Все электроны атома образуют его электронную оболочку. Электронная оболочка имеет отрицательный заряд, равный общему количеству электронов. Число электронов в оболочке атома совпадает с числом протонов в ядре и равно порядковому номеру элемента. Электроны в оболочке распределены по электронным слоям согласно запасам энергии (электроны с близкими значениями энергий образуют один электронный слой): электроны с меньшей энергией находятся ближе к ядру, электроны с большей энергией находятся дальше от ядра. Число электронных слоёв (энергетических уровней) совпадает с номером периода, в котором располагается химический элемент.
Различают завершённые и незавершённые энергетические уровни. Уровень считается завершённым, если содержит максимально возможное количество электронов ( первый уровень — 2 электрона, второй уровень — 8 электронов, третий уровень — 18 электронов, четвёртый уровень — 32 электрона и т.д.). Незавершённый уровень содержит меньшее число электронов.
Уровень, максимально удалённый от ядра атома, называется внешним. Электроны, находящиеся на внешнем энергетическом уровне, называются внешними (валентными) электронами. Число электронов на внешнем энергетическом уровне совпадает с номером группы, в которой находится химический элемент. Внешний уровень считается завершённым, если содержит 8 электронов. Завершённым внешним энергетическим уровнем обладают атомы элементов 8А группы (инертные газы гелий, неон, криптон, ксенон, радон).
Область пространства вокруг ядра атома, в которой наиболее вероятно нахождение электрона, называют электронной орбиталью. Орбитали отличаются уровнем энергии и формой. По форме различают s-орбитали (сфера), p-орбитали (объёмная восьмёрка), d-орбитали и f-орбитали. На каждом энергетическом уровне есть свой набор орбиталей: на первом энергетическом уровне — одна s-орбиталь, на втором энергетическом уровне — одна s- и три p-орбитали, на третьем энергетическом уровне — одна s-, три p-, пять d-орбиталей, на четвертом энергетическом уровне одна s-, три p-, пять d-орбиталей и семь f-орбиталей. На каждой орбитале могут располагаться максимально два электрона.
Распределение электронов по орбиталям отражается с помощью электронных формул. Например, для атома магния распределение электронов по энергетическим уровням будет следующим: 2е, 8е, 2е. Данная формула показывает, что 12 электронов атома магния распределены по трём энергетическим уровням: первый уровень завершён и содержит 2 электрона, второй уровень завершён и содержит 8 электронов, третий уровень не завершён, т.к. содержит 2 электрона. Для атома кальция распределение электронов по энергетическим уровням будет следующим: 2е, 8е, 8е, 2е. Данная формула показывает, что 20 электронов кальция распределены по четырём энергетическим уровням: первый уровень завершён и содержит 2 электрона, второй уровень завершён и содержит 8 электронов, третий уровень не завершён, т.к. содержит 8 электронов, четвёртый уровень не завершён, т.к. содержит 2 электрона.
Что такое завершенный слой
На этом уроке вы узнаете, как устроена электронная оболочка атома, и сможете объяснить явление периодичности. Познакомитесь с моделями строения электронных оболочек атомов, с помощью которых можно предсказать и объяснить свойства химических элементов и их соединений.
I. Состояние электронов в атоме
Выдающийся датский физик Нильс Бор (Рис. 1) предположил, что электроны в атоме могут двигаться не по любым, а по строго определенным орбитам.
При этом электроны в атоме различаются своей энергией. Как показывают опыты, одни из них притягиваются к ядру сильнее, другие – слабее. Главная причина этого заключается в разном удалении электронов от ядра атома. Чем ближе электроны к ядру, тем они прочнее связаны с ним и их труднее вырвать из электронной оболочки. Таким образом, по мере удаления от ядра атома запас энергии электрона увеличивается.
Электроны, движущиеся вблизи ядра, как бы загораживают (экранируют) ядро от других электронов, которые притягиваются к ядру слабее и движутся на большем удалении от него. Так образуются электронные слои.
Каждый электронный слой состоит из электронов.
Электрон вращается вокруг ядра атома с невообразимой скоростью. Так, за 1 секунду он делает столько оборотов вокруг ядра атома, сколько оборотов делает пропеллер самолета вокруг оси за 5–5,5 лет непрерывной работы двигателя. Пропеллер самолета образует «облако», находящееся в одной плоскости, а электрон образует объемное облако –электронное облако, форма и размер которого зависят от энергии электрона.
Если обозначить точками все вероятные места нахождения электрона в атомном пространстве за некоторое время, то совокупность этих точек будет представлять собойэлектронное облако.
II. Электронное облако
Электронное облако – это модель, которая описывает состояние (движение) электрона в атоме.
Электронное облако не имеет строго очерченных границ и плотность его неравномерна.
Часть атомного пространства, в котором вероятность нахождения электрона наибольшая (~90%), называется орбиталью.
Виды электронных орбиталей
Форма орбитали в пространстве
Количество орбиталей в атоме.
Условное обозначение орбитали – клетка:
(электронное облако s – электрона)
Электронное облако такой формы может занимать в атоме одно положение
(электронное облако p – электрона)
Электронное облако такой формы может занимать в атоме три положения вдоль осей координат пространства x, y и z.
(электронное облако d – электрона)
Все d-орбитали (а их может быть уже пять) одинаковы по энергии, но по-разному расположены в пространстве. Да и по форме, напоминающей перевязанную лентами подушечку, одинаковы только четыре.
А пятая — вроде гантели, продетой в бублик
(электронное облако f – электрона)
Электронное облако такой формы может занимать в атоме семь положений.
Условное обозначение электрона – стрелка , направленная вверх↑ (электрон вращается вокруг собственной оси по часовой стрелке) или стрелка, направленная вниз↓ (электрон вращается вокруг собственной оси против часовой стрелки).
Число электронов в атоме определяют по порядковому номеру
О – 8 электронов, S – 16 электронов.
На одной орбитали могут находиться только ДВА электрона, которые вращаются вокруг своей оси в противоположных направлениях (по часовой стрелке и против часовой стрелке) – электроны с противоположными спинами:
Cледовательно, на s – орбитали максимально может разместиться два электрона (s 2 ); на p – орбитали максимально может разместиться шесть электронов (p 6 ) на d – орбитали максимально может разместиться десять электронов (d 10 ); f – четырнадцать электронов (f 14 ).
Располагаясь на различных расстояниях от ядра, электроны образуют электронные слои (энергетические уровни) – каждому слою соответствует определённый уровень энергии.
Условное обозначение уровня — скобка: )
Число энергетических уровней определяют по номеру периода, в котором находится химический элемент
О – 2 уровня, S – три уровня.

Для элементов главных подгрупп (А) число электронов на внешнем уровне = номеру группы.
+15P – V группа (А) – на внешнем уровне 5 электронов
Для элементов побочных подгрупп (В) число электронов на внешнем уровне = двум.
Исключения (один электрон) – хром, медь, серебро, золото и некоторые другие.
III. Формулы отражающие строение атомов первого и второго периодов
– схема строения атома, отображает распределение электронов по энергоуровням.
+1 Н 1s 1
– электронная формула, отображает число электронов по орбиталям.
— электронно-графическая формула – показывает распределение электронов по орбиталям и отображает спин электрона.


У элементов второго периода начинается заполнение второго энергетического уровня — он включает восемь электронов (n = 2, N = 8). Второй период содержит восемь элементов. У неона, элемента, завершающего второй период, первый и второй энергетические уровни оказываются целиком заполненными.

Американский химик Гилберт Льюис дал объяснение этому и выдвинул правило октета, в соответствии с которым устойчивым является восьмиэлектронный слой (за исключением 1 слоя: т. к. на нем может находиться не более 2 электронов, устойчивым для него будет двухэлектронное состояние).
IV. Распределение электронов по энергетическим уровням элементов третьего и четвертого периодов ПСХЭ
1. Порядок заполнения уровней и подуровней электронами
Электронные формулы атомов химических элементов составляют в следующем порядке:
- Сначала по номеру элемента в таблице Д. И. Менделеева определяют общее число электронов в атоме;
- Затем по номеру периода, в котором расположен элемент, определяют число энергетических уровней;
- Уровни разбивают на подуровни и орбитали, и заполняют их электронами в соответствии Принципом наименьшей энергии
- Для удобства электроны можно распределить по энергетическим уровням, воспользовавшись формулой N=2n2 и с учётом того, что:
- У элементов главных подгрупп (s-;p-элементы) число электронов на внешнем уровне равно номеру группы.
- У элементов побочных подгрупп на внешнем уровне обычно дваэлектрона (исключение составляют атомы Cu,Ag,Au,Cr,Nb,Mo,Ru,Rh, у которых на внешнем уровне один электрон, у Pd на внешнем уровне нольэлектронов);
- Число электронов на предпоследнем уровне равно общему числу электронов в атоме минус число электронов на всех остальных уровнях.
Порядок заполнения электронами атомных орбиталей определяется :
Принципом наименьшей энергии
Шкала энергий:

2. Семейства химических элементов
Элементы, в атомах которых происходит заполнение электронами s-подуровня внешнего энергетического уровня, называются s-элементами. Это первые 2 элемента каждого периода, составляющие главные подгруппы I и II групп.
Элементы, в атомах которых электронами заполняется p-подуровень внешнего энергетического уровня, называются p-элементами. Это последние 6 элементов каждого периода (за исключением I и VII), составляющие главные подгруппы III—VIII групп.
Элементы, в которых заполняется d-подуровень второго снаружи уровня, называются d-элементами. Это элементы вставных декад IV, V, VI периодов.
Элементы, в которых заполняется f-подуровень третьего снаружи уровня, называются f-элементами. К f-элементам относятся лантаноиды и актиноиды.
В третьем периоде происходит заполнение третьего энергетического уровня. Третий уровень (n = 3) может максимально вмещать 18 электронов. Однако элементов в третьем периоде всего восемь. К концу третьего периода (у аргона) полностью заполняются 3s- и 3p-подуровни, а 3d-подуровень остается пустым, поэтому третий уровень не заполняется до конца.

В четвертом периоде у первых двух элементов (калия и кальция) электроны идут на четвертый энергетический уровень (4s-подуровень), а затем у последующих десяти элементов (от скандия до цинка) завершается заполнение третьего энергетического уровня (3d-подуровня).

«Проскок» или «провал» электрона
У атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место «провал» электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома. Например, электронная формула атома меди, исходя из вышенаписанного, должна иметь вид: Cu 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 9 . Однако в действительности один из двух 4s-электронов «проваливается» на 3d-подуровень, и атом меди имеет следующую конфигурацию: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 .
Для элементов IБ-подгруппы характерна конфигурация внешнего слоя: ns 1 (n−1)d 10 .
Для элементов Cr и Mo характерна конфигурация внешнего слоя: ns 1 (n−1)d 5 .
Особо следует отметить палладий, у которого «проваливаются» два электрона:
Pd1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 0 4d 10
V. Тест
Решите тестовые задания (один верный вариант ответа).
1. Заряд ядра атома фосфора равен
2. Количество энергоуровней в атоме равно
а) порядковому номеру элемента;
б) номеру группы;
в) заряду ядра атома;
г) номеру периода
3. Число нейтронов в атоме цинка равно
4. В ряду элементов Na, Mg, Al, Cl металлические свойства
в) не изменяются;
г) сначала убывают, а затем возрастают
5. Формула высшего оксида RO2 характерна для
6. Электронная формула строения атома меди, это-
а) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 ;
б) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 9 ;
в) 1s 2 2s 2 2p 6 3s 1 3p 6 4s 2 3d 10 ;
г) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 11 .
7. Заряд ядра атома кальция равен
8. Число электронов на внешнем энергоуровне для элементов главных подгрупп равно
а) номеру периода;
б) номеру группы;
в) порядковому номеру элемента;
г) атомной массе.
9. Число нейтронов в атоме железа равно
10. В ряду элементов C, Si, Ge, Sn способность отдавать валентные электроны
б) не изменяется;
г) сначала увеличивается, а затем уменьшается.
11. Формула летучего водородного соединения для элемента с электронным строением атома 1s22s22p2 – это
§ 40. Строение электронных оболочек атомов
Свойства электронов описываются законами микромира. Экспериментально и теоретически установлено, что электроны как микрочастицы обладают двойственной природой, т. е. для них характерны свойства как частицы (имеют определённую массу, размеры ит.д.), так и волны (не имеют траектории движения, определённого положения в пространстве и обладают другими волновыми свойствами). Последнее вы узнаете из курсов физики и химии старших классов.

Быстро движущийся электрон может находиться в любой точке пространства, окружающего ядро атома, и на разном удалении от него, образуя электронную оболочку. Поэтому принято говорить о вероятности пребывания электрона в той или иной части внутриатомного пространства (рис. 72). Электрон движется вокруг ядра с огромной скоростью, при которой его отрицательный заряд как бы размазывается в пространстве. Максимальная плотность отвечает наибольшей вероятности пребывания электрона в данной области атомного пространства.
Электроны в атоме различаются своей энергией. Чем ближе электроны находятся к ядру, тем они прочнее связаны с ним и их труднее «вырвать» из электронной оболочки. Чем дальше располагаются электроны от ядер атомов, тем легче их «оторвать».
В электронной оболочке атома электроны располагаются в определённом порядке. Условно можно считать, что они размещаются слоями. Как уже говорилось, эти слои не имеют чётких границ и постепенно переходят друг в друга.
Каждый электронный слой состоит из электронов с близкими значениями энергии, поэтому их ещё называют энергетическими уровнями. Число энергетических уровней, или электронных слоёв, в атоме совпадает с номером периода периодической системы, в котором находится соответствующий химический элемент. Число энергетических уровней в атоме: n = 1, 2, 3, 4, 5, б, 7.
Установлено, что в первом слое (ближайшем к ядру атома) находится максимальное число электронов — 2. Во втором слое может располагаться максимально 8 электронов, в третьем слое — 18 электронов, а в четвёртом — 32 электрона. Таким образом, максимальное число электронов, находящихся на энергетическом уровне, можно определить по формуле: 2n 2 , где n — номер энергетического уровня.
Слой в атоме, содержащий максимально возможное для него число электронов, называют завершённым электронным слоем.
Например, атом водорода имеет в периодической системе Д.И. Менделеева порядковый номер 1, следовательно, заряд ядра атома равен +1, и в его электронной оболочке находится 1 электрон.
Следующий элемент в 1-м периоде — гелий. Заряд ядра атома гелия +2, количество электронов -2.
У гелия электронный слой завершён. У лития появляется второй электронный слой, поэтому он находится во 2-м периоде периодической системы Д.И. Менделеева.
Далее в атомах элементов 2-го периода происходит заполнение второго электронного слоя до 8 электронов (у неона).
У следующего по порядку атома (у натрия) появляется третий электронный слой.
Слой, для которого характерна наименьшая энергия взаимодействия электрона с ядром, называется внешним. Внешний электронный слой всегда содержит не больше 8 электронов (кроме элементов 1-го периода).
Электронный слой • Энергетический уровень • Завершённый электронный слой • Внешний электронный слой
Вопросы и задания

1. Почему правильно говорить о вероятности пребывания электрона в той или иной части атомного пространства?

2. Изобразите схемы строения электронной оболочки атомов: а) магния, б) фосфора, в) хлора.

3. Схема распределения электронов по электронным слоям 2, 8, 6 соответствует атому

4. Соедините стрелками распределение электронов по электронным слоям и названия соответствующих элементов.
Зависимость химических свойств элементов от строения их атомов
Согласно теории строения атома в основе химических реакций лежат процессы перестройки электронных оболочек атома – электронные взаимодействия. В химических реакциях участвуют главным образом электроны внешних слоев (валентные электроны). Обычно это одиночные (непарные, неспаренные) электроны.
Максимально заполненные орбитали наиболее устойчивы. Электронные слои, орбитали которых заполнены максимально, называются завершенными. Внешний электронный слой является завершенным, если имеет электронную конфигурацию s 2 p 6 (восемь электронов), кроме гелия.
Атомы инертных элементов (Не, Ne, Аr, Кr, Хе, Rn) имеют завершенные внешние электронные слои и поэтому с большим трудом вступают в химические реакции. Атомы всех других элементов имеют незавершенные внешние электронные слои.
У атомов металлов во внешнем слое, как правило, содержится меньше четырех электронов, и они слабо связаны с атомом. Атомы металлов, вступая в химическую реакцию, теряют валентные электроны. Как известно, активность металлов различна. Например, натрий и калий — более активные металлы, чем золото и платина. Для сравнения активности металлов обычно используют специальную величину — энергию ионизации I.
Энергия ионизации — это количество энергии, необходимое для отрыва наиболее слабо связанного электрона от атома.
Энергию ионизации выражают в электрон-вольтах (эВ). Значения энергий ионизации более активных металлов меньше, чем менее активных. Щелочные металлы имеют самые низкие значения энергий ионизации
У атомов неметаллов во внешнем электронном слое содержится четыре и больше электронов, которые прочно связаны с атомом. Атомы неметаллов, вступая в химическую реакцию, обычно присоединяют электроны. Для сравнения неметаллических свойств используют специальную величину – сродство к электрону Е.
Сродство к электрону — это количество энергии, которое выделяется при присоединении одного электрона к нейтральному атому.
Сродство к электрону также выражают в электрон-вольтах (эВ). Наибольшие значения сродства к электрону у элементов главной подгруппы седьмой группы (F, C1, Вr, I), т.е. у типичных неметаллов.
С увеличением заряда ядра атомов у элементов одного периода уменьшается радиус атома, а количество внешних электронов увеличивается. Вследствие этого притяжение внешних электронов к ядру усиливается, энергия ионизации и сродство к электрону увеличиваются. Поэтому к концу периода металлические свойства элементов ослабляются, а неметаллические усиливаются.
В больших периодах металлические свойства ослабляются, а неметаллические усиливаются более медленно, чем в малых периодах. Это объясняется тем, что большие периоды содержат переходные элементы. На внешнем слое атомов переходных элементов находятся два s-электрона, а заполняются предпоследний слой у d-элементов и третий с конца у f-элементов.
В главных подгруппах с увеличением порядкового номера элемента (то есть сверху вниз) металлические свойства элементов усиливаются, а неметаллические ослабляются. Количественные изменения приводят к качественным. Отсюда следует, что самый активный металл — франций, самый активный неметалл — фтор. Деление элементов на металлы и неметаллы относительно. Как известно, существуют элементы с амфотерными свойствами.
Число электронов во внешнем слое атомов изменяется периодически с возрастанием заряда ядер атомов. Поэтому и свойства химических элементов изменяются периодически.
В настоящее время периодический закон формулируется так:
Свойства химических элементов, а также формы и свойства их соединений, находятся в периодической зависимости от величины заряда их атомных ядер или порядкового номера элемента в периодической системе.
Химическая связь.
Электронная теория строения атомов объясняет, как атомы соединяются в молекулы, т.е. природу и механизм образования химической связи.
Под химической связью понимают электрические силы притяжения, удерживающие частицы друг около друга.
Частицы, которые принимают участие в образовании химических связей, могут быть атомами, молекулами или ионами. В основе теории химической связи лежат представления об электронных взаимодействиях. Наиболее прочными группировками электронов являются завершенные внешние электронные слои атомов инертных элементов. Незавершенные внешние электронные слои всех остальных элементов являются неустойчивыми группировками электронов. При соединении атомов с незавершенными внешними электронными слоями происходит перестройка их электронных оболочек: непарные электроны различных атомов образуют общие электронные пары.
Основными типами химической связи являются ковалентная, ионная, металлическая и водородная.
Ковалентная связь
Рассмотрим образование молекулы водорода Н2 из атомов. Электронная конфигурация атома водорода Is 1 , т. е. на внешнем электронном слое (он единственный) находится один непарный электрон. При образовании молекулы водорода из двух атомов, имеющих непарные s-электроны с антипараллельными спинами, происходит перекрывание s-орбиталей и образуется общая электронная пара (рис. 4а).

Рис. 4 Перекрывание: а — s-орбиталей; 6- s- и р-орбиталей; в — р-орбиталей
Схематически это можно изобразить с помощью электронных формул:
Общая электронная пара одинаково принадлежит обоим атомам, каждый атом получает устойчивую оболочку из двух электронов. Наибольшая электронная плотность общего электронного облака проявляется в области между ядрами. Молекула водорода образуется за счет взаимодействия общей электронной пары с ядрами обоих атомов.
Связь атомов с помощью общих электронных пар называется ковалентной.
В молекулах фтора F2, хлора С12, кислорода О2, азота N2 связь между атомами ковалентная. Она образуется в молекулах фтора и хлора с помощью общей электронной пары (рис. 4в), в молекуле азота — с помощью трех общих электронных пар. Схематически это можно изобразить так:


Во всех этих случаях каждый атом образует завершенный устойчивый внешний электронный слой из восьми электронов.
В молекулах, которые состоят из разных элементов, связь тоже может быть ковалентной. Рассмотрим образование молекулы хлороводорода. Электронные конфигурации атомов водорода и хлора
H 1s 1 ; Cl 1s 2 2s 2 2p 6 3s 2 3p 5
показывают, что внешние электронные слои этих атомов имеют по одному непарному электрону. При сближении орбитали этих электронов перекрываются, образуя общую электронную пару (рис. 4б).
Ковалентная связь может образоваться между двумя атомами, из которых один имеет пару электронов, а другой — свободную орбиталь. Например, при взаимодействии аммиака NH3 и хлороводорода НCl пара s-электронов атома азота, которые не участвуют в образовании связей в молекуле аммиака пара электронов) становится общей для водорода и азота, получается ион аммония
Такой механизм образования ковалентной связи называется донорно-акцепторным. В нашем примере донором электронной пары является атом азота, а акцептором — ион водорода (он имеет свободную орбиталь). Донорно-акцепторный механизм образования ковалентной связи наблюдается в комплексных соединениях ([Ag(NH3)2]0H, K4[Fe(CN)6]).
Электроны, которые участвуют в образовании химических связей, называются валентными. У элементов главных подгрупп валентные электроны расположены на s- и р-орбиталях внешнего электронного слоя. У элементов побочных подгрупп (за исключением лантаноидов и актиноидов) валентные электроны расположены на s-орбиталях внешнего слоя и на d-орбиталях предпоследнего электронного слоя. Валентными электронами могут быть не только непарные электроны атома в нормальном (невозбужденном) состоянии, но и парные. Например, в нормальном состоянии атом углерода имеет два непарных электрона.
Однако в большинстве своих соединений атом углерода образует четыре ковалентных связи (СН4, СС14, СН3ОН и т. д.). Это становится возможным потому, что при поглощении энергии (420 кДж/моль) у атома углерода один 2s-электрон переходит на 2p-орбиталь:
Такой атом углерода называется возбужденным. Он имеет четыре непарных электрона и может образовать четыре ковалентных связи.
Если общие электронные пары обозначать чертой, то электронная формула превращается в структурную:
| : | |||
| H — Cl | H – O — H | H – — H | H — — :H |
Электронные и структурные формулы показывают последовательность соединения атомов в молекуле. Например, в молекуле аммиака атомы водорода соединяются с атомами азота, но между собой не соединяются.
Вещества с ковалентными связями могут быть твердыми (парафин, лед), жидкими (вода, спирт), газообразными (кислород, азот, аммиак) при обычных условиях.
Структурные формулы не отражают пространственного расположения атомов в молекуле. Изобразить его можно с помощью модели (рис. 5),