Усиление металлических и неметаллических свойств в таблице
Периодическая таблица Дмитрия Ивановича Менделеева очень удобна и универсальна в своём использовании. По ней можно определить некоторые характеристики элементов, и что самое удивительное, предсказать некоторые свойства ещё неоткрытых, не обнаруженных учёными, химических элементов (например, мы знаем некоторые свойства предполагаемого унбигексия, хотя его ещё не открыли и не синтезировали).
Что такое металлические и неметаллические свойства
Эти свойства зависят от способности элемента отдавать или притягивать к себе электроны. Важно запомнить одно правило, металлы – отдают электроны, а неметаллы – принимают. Соответственно металлические свойства – это способность определённого химического элемента отдавать свои электроны (с внешнего электронного облака) другому химическому элементу. Для неметаллов всё в точности наоборот. Чем легче неметалл принимает электроны, тем выше его неметаллические свойства.
Металлы никогда не примут электроны другого химического элемента. Такое характерно для следующих элементов;
- натрия;
- калия;
- лития;
- франция и так далее.
С неметаллами дела обстоят похожим образом. Фтор больше всех остальных неметаллов проявляет свои свойства, он может только притянуть к себе частицы другого элемента, но ни при каких условиях не отдаст свои. Он обладает наибольшими неметаллическими свойствами. Кислород (по своим характеристикам) идёт сразу же после фтора. Кислород может образовывать соединение с фтором, отдавая свои электроны, но у других элементов он забирает отрицательные частицы.
Список неметаллов с наиболее выраженными характеристиками:
Неметаллические и металлические свойства объясняются тем, что все химические вещества стремятся завершить свой энергетический уровень. Для этого на последнем электронном уровне должно быть 8 электронов. У атома фтора на последней электронной оболочке 7 электронов, стремясь завершить ее, он притягивает ещё один электрон. У атома натрия на внешней оболочке один электрон, чтобы получить 8, ему проще отдать 1, и на последнем уровне окажется 8 отрицательно заряженных частиц.
Благородные газы не взаимодействуют с другими веществами именно из-за того, что у них завершён энергетический уровень, им не нужно ни притягивать, ни отдавать электроны.

Как изменяются металлические свойства в периодической системе
Периодическая таблица Менделеева состоит из групп и периодов. Периоды располагаются по горизонтали таким образом, что первый период включает в себя: литий, бериллий, бор, углерод, азот, кислород и так далее. Химические элементы располагаются строго по увеличению порядкового номера.
Группы располагаются по вертикали таким образом, что первая группа включает в себя: литий, натрий, калий, медь, рубидий, серебро и так далее. Номер группы указывает на количество отрицательных частиц на внешнем уровне определённого химического элемента. В то время, как номер периода указывает на количество электронных облаков.
Металлические свойства усиливаются в ряду справа налево или, по-другому, ослабевают в периоде. То есть магний обладает большими металлическими свойствами, чем алюминий, но меньшими, нежели натрий. Это происходит потому, что в периоде количество электронов на внешней оболочке увеличивается, следовательно, химическому элементу сложнее отдавать свои электроны.
В группе все наоборот, металлические свойства усиливаются в ряду сверху вниз. Например, калий проявляется сильнее, чем медь, но слабее, нежели натрий. Объяснение этому очень простое, в группе увеличивается количество электронных оболочек, а чем дальше электрон находится от ядра, тем проще элементу его отдать. Сила притяжения между ядром атома и электроном в первой оболочке больше, чем между ядром и электроном в 4 оболочке.
Сравним два элемента – кальций и барий. Барий в периодической системе стоит ниже, чем кальций. А это значит, что электроны с внешней оболочки кальция расположены ближе к ядру, следовательно, они лучше притягиваются, чем у бария.
Сложнее сравнивать элементы, которые находятся в разных группах и периодах. Возьмём, к примеру, кальций и рубидий. Рубидий будет лучше отдавать отрицательные частицы, чем кальций. Так как он стоит ниже и левее. Но пользуясь только таблицей Менделеева нельзя однозначно ответить на этот вопрос сравнивая магний и скандий (так как один элемент ниже и правее, а другой выше и левее). Для сравнения этих элементов понадобятся специальные таблицы (например, электрохимический ряд напряжений металлов).

Как изменяются неметаллические свойства в периодической системе
Неметаллические свойства в периодической системе Менделеева изменяются с точностью до наоборот, нежели металлические. По сути, эти два признака являются антагонистами.
Неметаллические свойства усиливаются в периоде (в ряду справа налево). Например, сера способна меньше притягивать к себе электроны, чем хлор, но больше, нежели фосфор. Объяснение этому явлению такое же. Количество отрицательно заряженных частиц на внешнем слое увеличивается, и поэтому элементу легче закончить свой энергетический уровень.
Неметаллические свойства уменьшаются в ряду сверху вниз (в группе). Например, фосфор способен отдавать отрицательно заряженные частицы больше, чем азот, но при этом способен лучше притягивать, нежели мышьяк. Частицы фосфора притягиваются к ядру лучше, чем частицы мышьяка, что даёт ему преимущество окислителя в реакциях на понижение и повышение степени окисления (окислительно-восстановительные реакции).
Сравним, к примеру, серу и мышьяк. Сера находится выше и правее, а это значит, что ей легче завершить свой энергетический уровень. Как и металлы, неметаллы сложно сравнивать, если они находятся в разных группах и периодах. Например, хлор и кислород. Один из этих элементов выше и левее, а другой ниже и правее. Для ответа придётся обратиться к таблице электроотрицательности неметаллов, из которой мы видим, что кислород легче притягивает к себе отрицательные частицы, нежели хлор.

Периодическая таблица Менделеева помогает узнать не только количество протонов в атоме, атомную массу и порядковый номер, но и помогает определить свойства элементов.
Видео
Видео поможет вам разобраться в закономерности свойств химических элементов и их соединений по периодам и группам.
Поставь лайк, это важно для наших авторов, подпишись на наш канал в Яндекс.Дзен и вступай в группу Вконтакте
Что такое завершенный энергетический уровень
В с п о м н и т е, что такое атом, из чего состоит атом, изменяется ли атом в химических реакциях.
Атом – это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Число электронов в ходе химических процессов может изменяться, но заряд ядра всегда остается неизменным. Зная распределение электронов в атоме (строение атома), можно предсказать многие свойства данного атома, а также свойства простых и сложных веществ, в состав которых он входит.
Строение атома, т.е. состав ядра и распределение электронов вокруг ядра, несложно определить по положению элемента в периодической системе.
В периодической системе Д.И.Менделеева химические элементы располагаются в определенной последовательности. Эта последовательность тесно связана со строением атомов этих элементов. Каждому химическому элементу в системе присвоен порядковый номер, кроме того, для него можно указать номер периода, номер группы, вид подгруппы.
Зная точный «адрес» химического элемента – группу, подгруппу и номер периода, можно однозначно определить строение его атома.
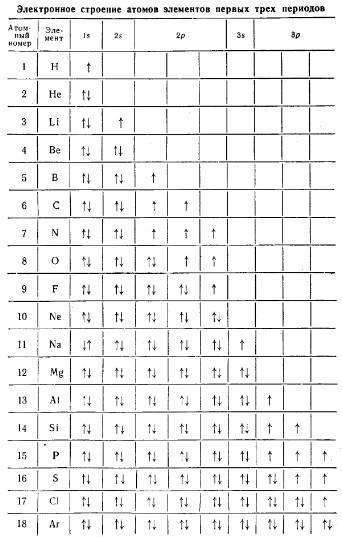
Период – это горизонтальный ряд химических элементов. В современной периодической системе семь периодов. Первые три периода – малые, т.к. они содержат 2 или 8 элементов:
1-й период – Н, Не – 2 элемента;
2-й период – Li … Nе – 8 элементов;
3-й период – Na . Аr – 8 элементов.
Остальные периоды – большие. Каждый из них содержит 2–3 ряда элементов:
4-й период (2 ряда) – K . Kr – 18 элементов;
6-й период (3 ряда) – Сs . Rn – 32 элемента. В этот период входит ряд лантаноидов.
Группа – вертикальный ряд химических элементов. Всего групп восемь. Каждая группа состоит из двух подгрупп: главной подгруппы и побочной подгруппы. Например:

Главную подгруппу образуют химические элементы малых периодов (например, N, P) и больших периодов (например, As, Sb, Bi).
Побочную подгруппу образуют химические элементы только больших периодов (например, V, Nb,
Ta).
Визуально эти подгруппы различить легко. Главная подгруппа «высокая», она начинается с 1-го или 2-го периода. Побочная подгруппа – «низкая», начинается с 4-го периода.
Итак, каждый химический элемент периодической системы имеет свой адрес: период, группу, подгруппу, порядковый номер.
Например, ванадий V – это химический элемент 4-го периода, V группы, побочной подгруппы, порядковый номер 23.
Задание 3.1. Укажите период, группу и подгруппу для химических элементов с порядковыми номерами 8, 26, 31, 35, 54.
Задание 3.2. Укажите порядковый номер и название химического элемента, если известно, что он находится:
а) в 4-м периоде, VI группе, побочной подгруппе;
б) в 5-м периоде, IV группе, главной подгруппе.
Каким образом можно связать сведения о положении элемента в периодической системе со строением его атома?
Атом состоит из ядра (оно имеет положительный заряд) и электронов (они имеют отрицательный заряд). В целом атом электронейтрален.
Положительный заряд ядра атома равен порядковому номеру химического элемента.
Ядро атома – сложная частица. В ядре сосредоточена почти вся масса атома. Поскольку химический элемент – совокупность атомов с одинаковым зарядом ядра, то около символа элемента указывают следующие его координаты:

По этим данным можно определить состав ядра. Ядро состоит из протонов и нейтронов.
Протон p имеет массу 1 (1,0073 а. е. м.) и заряд +1. Нейтрон n заряда не имеет (нейтрален), а масса его приблизительно равна массе протона (1,0087 а. е. м.).
Заряд ядра определяют протоны. Причем число протонов равно (по величине) заряду ядра атома, т.е. порядковому номеру.
Число нейтронов N определяют по разности между величинами: «масса ядра» А и «порядковый номер» Z. Так, для атома алюминия:
N = А – Z = 27 –13 = 14n,

Задание 3.3. Определите состав ядер атомов, если химический элемент находится в:
а) 3-м периоде, VII группе, главной подгруппе;
б) 4-м периоде, IV группе, побочной подгруппе;
в) 5-м периоде, I группе, главной подгруппе.
Как известно, ядро атома в химических процессах не изменяется. А что изменяется? Переменным оказывается общее число электронов в атоме и распределение электронов. Общее число электронов в нейтральном атоме определить несложно – оно равно порядковому номеру, т.е. заряду ядра атома:

Электроны имеют отрицательный заряд –1, а масса их ничтожна: 1/1840 от массы протона.
Отрицательно заряженные электроны отталкиваются друг от друга и находятся на разных расстояниях от ядра. При этом электроны, имеющие приблизительно равный запас энергии, находятся на приблизительно равном расстоянии от ядра и образуют энергетический уровень.
Число энергетических уровней в атоме равно номеру периода, в котором находится химический элемент. Энергетические уровни условно обозначают так (например, для Al):

Задание 3.4. Определите число энергетических уровней в атомах кислорода, магния, кальция, свинца.
На каждом энергетическом уровне может находиться ограниченное число электронов:
• на первом – не более двух электронов;
• на втором – не более восьми электронов;
• на третьем – не более восемнадцати электронов.
Эти числа показывают, что, например, на втором энергетическом уровне может находиться 2, 5 или 7 электронов, но не может быть 9 или 12 электронов.
Важно знать, что независимо от номера энергетического уровня на внешнем уровне (последнем) не может быть больше восьми электронов. Внешний восьмиэлектронный энергетический уровень является наиболее устойчивым и называется завершенным. Такие энергетические уровни имеются у самых неактивных элементов – благородных газов.
Как определить число электронов на внешнем уровне остальных атомов? Для этого существует простое правило: число внешних электронов равно:
• для элементов главных подгрупп – номеру группы;
• для элементов побочных подгрупп оно не может быть больше двух.
Рис. 5.
Схема определения числа
внешних электронов атомов
Задание 3.5. Укажите число внешних электронов для химических элементов с порядковыми номерами 15, 25, 30, 53.
Задание 3.6. Найдите в периодической системе химические элементы, в атомах которых имеется завершенный внешний уровень.
Очень важно правильно определять число внешних электронов, т.к. именно с ними связаны важнейшие свойства атома. Так, в химических реакциях атомы стремятся приобрести устойчивый, завершенный внешний уровень (8е). Поэтому атомы, на внешнем уровне которых мало электронов, предпочитают их отдать.
Химические элементы, атомы которых способны только отдавать электроны, называют металлами. Очевидно, что на внешнем уровне атома металла должно быть мало электронов: 1, 2, 3.
Если на внешнем энергетическом уровне атома много электронов, то такие атомы стремятся принять электроны до завершения внешнего энергетического уровня, т. е. до восьми электронов. Такие элементы называют неметаллами.
В о п р о с. К металлам или неметаллам относятся химические элементы побочных подгрупп? Почему?
О т в е т. Металлы и неметаллы главных подгрупп в таблице Менделеева отделяет линия, которую можно провести от бора к астату. Выше этой линии (и на линии) располагаются неметаллы, ниже – металлы. Все элементы побочных подгрупп оказываются ниже этой линии.
Задание 3.7. Определите, к металлам или неметаллам относятся: фосфор, ванадий, кобальт, селен, висмут. Используйте положение элемента в периодической системе химических элементов и число электронов на внешнем уровне.
Для того, чтобы составить распределение электронов по остальным уровням и подуровням, следует воспользоваться следующим а л г о р и т м о м.
1. Определить общее число электронов в атоме (по порядковому номеру).
2. Определить число энергетических уровней (по номеру периода).
3. Определить число внешних электронов (по виду подгруппы и номеру группы).
4. Указать число электронов на всех уровнях, кроме предпоследнего.
5. Рассчитать число электронов на предпоследнем уровне.
Например, согласно пунктам 1–4 для атома марганца определено:

Всего 25е; распределили (2 + 8 + 2) = 12e; значит, на третьем уровне находится: 25 – 12 = 13e.
Получили распределение электронов в атоме марганца:

Задание 3.8. Отработайте алгоритм, составив схемы строения атомов для элементов № 16, 26, 33, 37. Укажите, металлы это или неметаллы. Ответ поясните.
Составляя приведенные выше схемы строения атома, мы не учитывали, что электроны в атоме занимают не только уровни, но и определенные подуровни каждого уровня. Виды подуровней обозначаются латинскими буквами: s, p, d.
Число возможных подуровней равно номеру уровня. Первый уровень состоит из одного
s-подуровня. Второй уровень состоит из двух подуровней – s и р. Третий уровень – из трех подуровней – s, p и d.
На каждом подуровне может находиться строго ограниченное число электронов:
на s-подуровне – не больше 2е;
на р-подуровне – не больше 6е;
на d-подуровне – не больше 10е.
Подуровни одного уровня заполняются в строго определенном порядке: s p d.
Таким образом, р-подуровнь не может начать заполняться, если не заполнен s-подуровень данного энергетического уровня, и т.д. Исходя из этого правила, несложно составить электронную конфигурацию атома марганца:
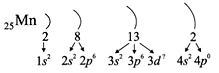
В целом электронная конфигурация атома марганца записывается так:
25Мn 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 .
Здесь и далее приняты следующие обозначения:

Задание 3.9. Составьте электронные конфигурации атомов для химических элементов № 16, 26, 33, 37.
Для чего необходимо составлять электронные конфигурации атомов? Для того, чтобы определять свойства этих химических элементов. Следует помнить, что в химических процессах участвуют только валентные электроны.
Валентные электроны находятся на внешнем энергетическом уровне и незавершенном
d-подуровне предвнешнего уровня.
Определим число валентных электронов для марганца:

или сокращенно: Мn … 3d 5 4s 2 .
Что можно определить по формуле электронной конфигурации атома?
1. Какой это элемент – металл или неметалл?
Марганец – металл, т.к. на внешнем (четвертом) уровне находится два электрона.
2. Какой процесс характерен для металла?
Атомы марганца в реакциях всегда только отдают электроны.
3. Какие электроны и сколько будет отдавать атом марганца?
В реакциях атом марганца отдает два внешних электрона (они дальше всех от ядра и слабее притягиваются им), а также пять предвнешних d-электронов. Общее число валентных электронов – семь (2 + 5). В этом случае на третьем уровне атома останется восемь электронов, т.е. образуется завершенный внешний уровень.
Все эти рассуждения и заключения можно отразить при помощи схемы (рис. 6):
Рис. 6.
Схема отдачи электронов атомом марганца
Полученные условные заряды атома называют степенями окисления.
Рассматривая строение атома, аналогичным способом можно показать, что типичными степенями окисления для кислорода является –2, а для водорода +1.
В о п р о с. С каким из химических элементов может образовывать соединения марганец, если учесть полученные выше степени его окисления?
О т в е т. Только с кислородом, т.к. его атом имеет противоположную по заряду степень окисления. Формулы соответствующих оксидов марганца (здесь степени окисления соответствуют валентностям этих химических элементов):

Строение атома марганца подсказывает, что большей степени окисления у марганца быть не может, т.к. в этом случае пришлось бы затрагивать устойчивый, теперь уже завершенный предвнешний уровень. Поэтому степень окисления +7 является высшей, а соответствующий оксид Мn2О7 – высшим оксидом марганца.
Для закрепления всех этих понятий рассмотрим строение атома теллура и некоторые его свойства:
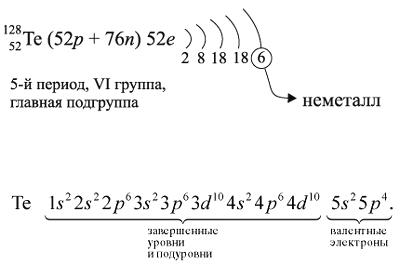
Как неметалл, атом Te может принять 2 электрона до завершения внешнего уровня и отдать «лишние» 6 электронов:

Задание 3.10. Изобразите электронные конфигурации атомов Nа, Rb, Cl, I, Si, Sn. Определите свойства этих химических элементов, формулы их простейших соединений (с кислородом и водородом).
Практические выводы
1. В химических реакциях участвуют только валентные электроны, которые могут находиться только на двух последних уровнях.
2. Атомы металлов могут только отдавать валентные электроны (все или несколько), принимая положительные степени окисления.
3. Атомы неметаллов могут принимать электроны (недостающие – до восьми), приобретая при этом отрицательные степени окисления, и отдавать валентные электроны (все или несколько), при этом они приобретают положительные степени окисления.
Сравним теперь свойства химических элементов одной подгруппы, например натрия и рубидия:
Nа . 3s 1 и Rb . 5s 1 .
Что общего в строении атомов этих элементов? На внешнем уровне каждого атома по одному электрону – это активные металлы. Металлическая активность связана со способностью отдавать электроны: чем легче атом отдает электроны, тем сильнее выражены его металлические свойства.
Что удерживает электроны в атоме? Притяжение их к ядру. Чем ближе электроны к ядру, тем сильнее они притягиваются ядром атома, тем труднее их «оторвать».
Исходя из этого, ответим на вопрос: какой элемент – Nа или Rb – легче отдает внешний электрон? Какой из элементов является более активным металлом? Очевидно, рубидий, т.к. его валентные электроны находятся дальше от ядра (и слабее удерживаются ядром).
Вывод. В главных подгруппах сверху вниз металлические свойства усиливаются, т.к. возрастает радиус атома, и валентные электроны слабее притягиваются к ядру.
Сравним свойства химических элементов VIIa группы: Cl …3s 2 3p 5 и I …5s 2 5p 5 .
Оба химических элемента – неметаллы, т.к. до завершения внешнего уровня не хватает одного электрона. Эти атомы будут активно притягивать недостающий электрон. При этом чем сильнее притягивает атом неметалла недостающий электрон, тем сильнее проявляются его неметаллические свойства (способность принимать электроны).
За счет чего происходит притяжение электрона? За счет положительного заряда ядра атома. Кроме того, чем ближе электрон к ядру, тем сильнее их взаимное притяжение, тем активнее неметалл.
В о п р о с. У какого элемента сильнее выражены неметаллические свойства: у хлора или йода?
О т в е т. Очевидно, у хлора, т.к. его валентные электроны расположены ближе к ядру.
Вывод. Активность неметаллов в подгруппах сверху вниз убывает, т.к. возрастает радиус атома и ядру все труднее притянуть недостающие электроны.
Сравним свойства кремния и олова: Si …3s 2 3p 2 и Sn …5s 2 5p 2 .
На внешнем уровне обоих атомов по четыре электрона. Тем не менее эти элементы в периодической системе находятся по разные стороны от линии, соединяющей бор и астат. Поэтому у кремния, символ которого находится выше линии В–At, сильнее проявляются неметаллические свойства. Напротив, у олова, символ которого находится ниже линии В–At, сильнее проявляются металлические свойства. Это объясняется тем, что в атоме олова четыре валентных электрона удалены от ядра. Поэтому присоединение недостающих четырех электронов затруднено. В то же время отдача электронов с пятого энергетического уровня происходит достаточно легко. Для кремния возможны оба процесса, причем первый (прием электронов) преобладает.
Выводы по главе 3. Чем меньше внешних электронов в атоме и чем дальше они от ядра, тем сильнее проявляются металлические свойства.
Чем больше внешних электронов в атоме и чем ближе они к ядру, тем сильнее проявляются неметаллические свойства.
Основываясь на выводах, сформулированных в этой главе, для любого химического элемента периодической системы можно составить «характеристику».
Периодический закон Д.И.Менделеева: свойства химических элементов, а также свойства простых и сложных веществ, образованных ими, находятся в периодической зависимости от заряда ядер их атомов.
Физический смысл периодического закона: свойства химических элементов периодически повторяются потому, что периодически повторяются конфигурации валентных электронов (распределение электронов внешнего и предпоследнего уровней).
Так, у химических элементов одной и той же подгруппы одинаковое распределение валентных электронов и, значит, похожие свойства.
Например, у химических элементов пятой группы пять валентных электронов. При этом в атомах химических элементов главных подгрупп – все валентные электроны находятся на внешнем уровне: … ns 2 np 3 , где n – номер периода.
У атомов элементов побочных подгрупп на внешнем уровне находятся только 1 или 2 электрона, остальные – на d-подуровне предвнешнего уровня: … (n – 1)d 3 ns 2 , где n – номер периода.
Задание 3.12. Составьте краткие электронные формулы для атомов химических элементов № 35 и 42, а затем составьте распределение электронов в этих атомах по алгоритму. Убедитесь, что ваше предсказание сбылось.
Как заполняются электронные уровни, подуровни и орбитали по мере усложнения атома.
Если говорить более строго, то относительное расположение подуровней обусловлено не столько их большей или меньшей энергией, сколько требованием минимума полной энергии атома.
Распределение электронов по атомным орбиталям происходит, начиная с орбитали, имеющей наименьшую энергию (принцип минимума энергии), т.е. электрон садится на ближайшую к ядру орбиталь. Это значит, что сначала заполняются электронами те подуровни, для которых сумма значений квантовых чисел (n + l) была минимальной. Так энергия электрона на 4s-подуровне меньше энергии электрона, находящегося на 3d-подуровне. Следовательно, заполнение электронами подуровней происходит в следующем порядке: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d ~ 4f < 6p < 7s < 6d ~ 5f < 7p.
Исходя из этого требования, минимум энергии достигается у большинства атомов тогда, когда их подуровни заполняются в показанной выше последовательности. Но есть и исключения, которые вы можете найти в таблицах «Электронные конфигурации элементов», однако эти исключения редко приходится принимать во внимание при рассмотрении химических свойств элементов.
Атом хрома имеет электронную конфигурацию не 4s 2 3d 4 , a 4s 1 3d 5 . Это является примером того, как стабилизация состояний с параллельными спинами электронов преобладает над незначительной разницей энергетических состояний подуровней 3d и 4s (правила Гунда), то есть энергетически выгодными состояниями для d-подуровня являются d 5 и d 10 .Энергетические диаграммы валентных подуровней атомов хрома и меди представлены на рис.2.1.1.
Подобный переход одного электрона с s-подуровня на d-подуровень происходит еще у 8 элементов: Cu, Nb, Mo, Ru, Ag, Pt, Au. У атома Pd происходит переход двух s-электронов на d-подуровень: Pd 5s 0 4d 10 .

Рис.2.1.1. Энергетические диаграммы валентных подуровней атомов хрома и меди
Правила заполнения электронных оболочек:
1. Сначала выясняем, сколько всего электронов содержит атом интересующего нас элемента. Для этого достаточно знать заряд его ядра, который, всегда равен порядковому номеру элемента в Периодической таблице Д.И. Менделеева. Порядковый номер (число протонов в ядре) в точности равен и числу электронов во всем атоме.
2. Последовательно заполняем орбитали, начиная с 1s-орбитали, имеющимися электронами, учитывая принцип минимальной энергии. При этом нельзя располагать на каждой орбитали более двух электронов с противоположно направленными спинами (правило Паули).
3. Записываем электронную формулу элемента.
Атом – это сложная, динамически устойчивая микросистема взаимодействующих частиц: протонов р + , нейтронов n 0 и электронов е — .
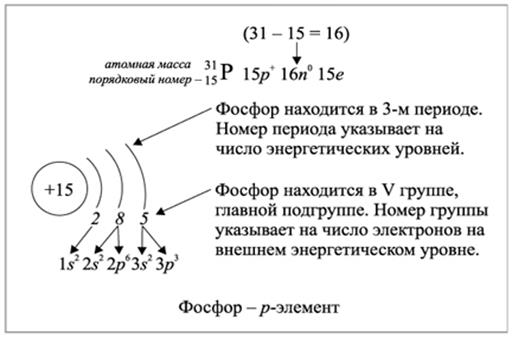
Рис.2.1.2. Заполнение энергетических уровней электронами элемента фосфора
Электронную структуру атома водорода (z = 1) можно изобразить следующим образом:
+1Н 1s 1 , n = 1 ↑, где квантовая ячейка (атомная орбиталь) обозначается в виде линии или квадрата, а электроны – в виде стрелок.
Каждый атом последующего химического элемента в периодической системе представляет собой многоэлектронный атом.
Атом лития, так же как и атом водорода и гелия, имеет электронную структуру s-элемента, т.к. последний электрон атома лития «садится» на s-подуровень:
+3Li 1s 2 2s 1 2p 0
В атоме бора появляется первый электрон в p-состоянии:
+5В 1s 2 2s 2 2p 1
Запись электронной формулы проще показать на конкретном примере. Допустим, нам надо выяснить электронную формулу элемента с порядковым номером 7. В атоме такого элемента должно быть 7 электронов. Заполним орбитали семью электронами, начиная с нижней 1s-орбитали.
Итак, 2 электрона расположатся на 1s-орбитали, еще 2 электрона — на 2s-орбитали, а оставшиеся 3 электрона смогут разместиться на трех 2p-орбиталях.
Электронная формула элемента с порядковым номером 7 (это элемент азот, имеющий символ “N”) выглядит так:
+7N 1s 2 2s 2 2p 3
Рассмотрим действие правила Гунда на примере атома азота: N 1s 2 2s 2 2p 3 . На 2-м электронном уровне есть три одинаковых p-орбитали: 2px, 2py, 2pz. Электроны заселят их так, что на каждой из этих p-орбиталей окажется по одному электрону. Объясняют это тем, что в соседних ячейках электроны меньше отталкиваются друг от друга, как одноименно заряженные частицы. Полученная нами электронная формула азота несет очень важную информацию: 2-й (внешний) электронный уровень азота заполнен электронами не до конца (на нем 2 + 3 = 5 валентных электронов) и до полного заполнения не хватает трех электронов.
Внешним уровнем атома называется самый далекий от ядра уровень, на котором есть валентные электроны. Именно эта оболочка соприкасается при столкновении с внешними уровнями других атомов в химических реакциях. При взаимодействии с другими атомами азот способен принять 3 дополнительных электрона на свой внешний уровень. При этом атом азота получит завершенный, то есть максимально заполненный внешний электронный уровень, на котором расположатся 8 электронов.

Завершенный уровень энергетически выгоднее незавершенного, поэтому атом азота должен легко реагировать с любым другим атомом, способным предоставить ему 3 дополнительных электрона для завершения его внешнего уровня.

Рис.2.1.3. Заполнение энергетических уровней у s-, p-,d- и f- элементов электронами
Изменение свойств атомов в зависимости от строения их оболочек

Из рассмотренных электронных конфигураций атомов элементов первых трех периодов наглядно прослеживается периодичность в изменении свойств элементов, открытая Д. И. Менделеевым. Каждый период начинается элементом, в атомах которого застраивается новый энергетический уровень, причем главное квантовое число n для этого уровня равно номеру периода. В конце каждого периода стоит химический инертный элемент, имеющим на внешнем уровне восемь электронов (в случае гелия— два электрона). Элементы, атомы которых обладают сходными электронными оболочками, попадают в определенную группу периодической системы. Например, щелочные металлы (конфигурация n s 1 ) попадают в первую группу, а инертные газы, имеющие завершенный энергетический уровень (ns 2 p 6 ),— в восьмую группу, в зависимости от строения электронных оболочек атомов все химические элементы можно разбить на четыре основных семейства: s-, р-, d-, f-элементы. Эта классификация основана на том, в какой степени заполнены соответствующие s-, р-, d- и f— подуровни. Следует, однако, и метить, что периодическое чередование d- и f-элементов в седьмом периоде нарушается. Поэтому размещение в периодической системе элементов, следующих за акти нием (актиноидов), представляет большую трудность.
Рис. Атомные радиусы металлов
Радиус атомов
Поскольку электроны находятся в непрерывном движении и изменяют форму своих орбит, точно определить размер атома невозможно. Это обусловлено также и тем, что на распределение электронов в атоме оказывает большое влияние внешнее окружение. Размер атома не является поэтому некоторой постоянной и абсолютной ве личиной; он может слегка изменяться, например, в зависимости от соединения, в которое входит данный атом. Тем не менее различные физические методы позволяю определить расстояние, разделяющее центры двух сосед них одинаковых частиц, и рассчитать так называемый «атомный радиус».
Атомные радиусы являются периодической функцией порядкового номера элемента. Это отчетливо видно из рисунка. В пределах одного периода атомные радиусы уменьшаются слева направо, что обусловлено возрастанием положительного заряда ядер. Появление нового электронного слоя в атомах элементов следующего периода резко увеличивает их размер, поэтому в группах периодической системы атомные радиусы увеличиваются сверху вниз.
Энергии ионизации атомов
Поглотив из вне определенное количество энергии нейтральный атом теряет свой электрон и превращаете в положительно заряженный ион, например:
Li→Li + +ē, К → К + + ē.
Этот процесс можно рассматривать как переход электрона с энергетического уровня, для которого главное квантовое число равно ni , на уровень с п = п∞. Энергия, необходимая для отрыва электрона, называется энергией ионизации. Она выражается в кдж/моль или электрон вольтах (1 эв = 96,43 кдж/моль).
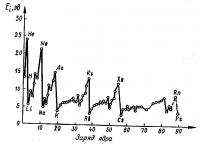
На величину энергии ионизации оказывают влияние многие факторы, главными из которых являются заряд ядра Z, атомный радиус R, общее число квантовых слоев п, степень застроенности данного энергетического подуровня. Например, увеличение Z приводит к упрочнению связи электрона с ядром, а с возрастанием R эта связь ослаблястся. На рисунке 10 приведена кривая зависимости энергий ионизации от порядковых номеров элементов. Видна четко выраженная периодичность в изменении этих энергий. Минимумы на кривой соответствуют щелочным металлам, атомы которых имеют на внешнем уровне один электрон, расположенный на большом расстоянии от ядра. При переходе от элемента к элементу в пределах одного периода наблюдается постепенное увеличение энергий ионизации, вызываемое ростом зарядов ядер атомов при одновременном уменьшении их радиусов. Наименьшим значением энергии ионизации обладают в каждом периоде атомы благородных газов, имеющие на внешнем уровне два (гелий) или восемь электронов. Повышенное значение энергии ионизации наблюдается также у атомов с полностью или наполовину заполненными подуровнями. Проследим в качестве примера за изменением
Особенности строения электронных оболочек атомов элементов
Электроны имеют много общего со всеми студентами.
Все студенты живут в общагах. А теперь представь, что у электронов есть свои, «электронные» общаги. И они живут по своим, «электронным» законам. Ты можешь спросить, а это как? Сейчас во всем разберемся!
Энергетические уровни, подуровни и орбитали
Пусть электрон — это студент. А где обычно живут студенты? — В общаге! Итак, нарисуем общежитие для электронов:
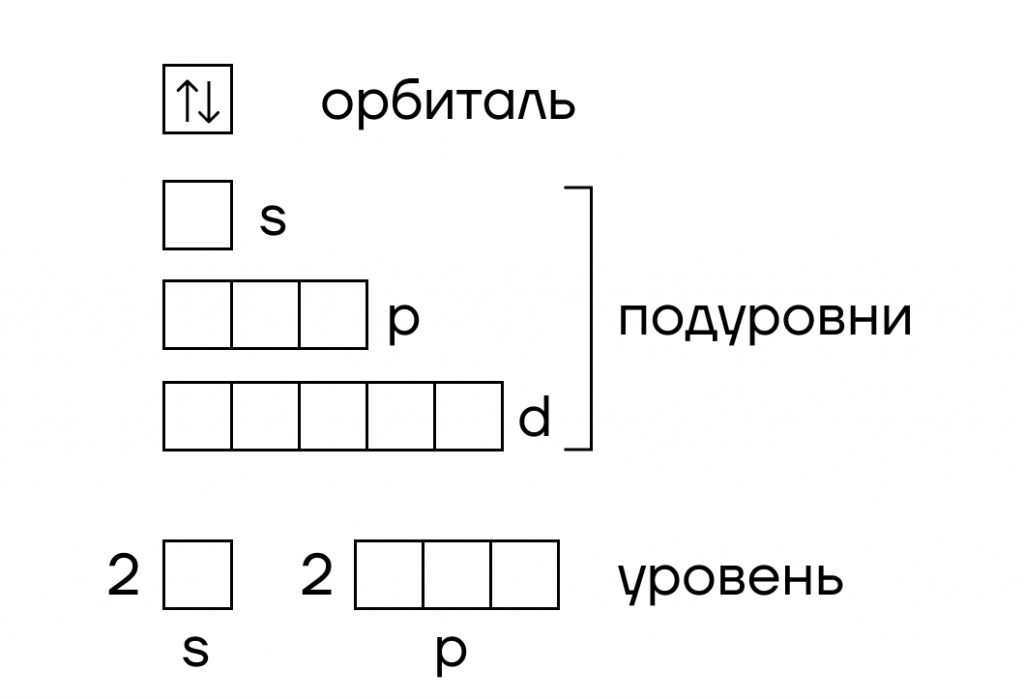
- В нём есть отдельные комнаты, которые называются атомными орбиталями — в них могут проживать максимум 2 электрона;
- Блоки с общей кухней, в которые эти комнаты собираются — их мы назовем энергетическими подуровнями;
- И целые этажи, в которые собираются отдельные блоки, которые являются энергетическими уровнями.
Все электроны живут на энергетических уровнях, каждый из которых имеет энергетические подуровни.
| Подуровни обозначают в данном порядке по мере отдаления от ядра: s → p → d → f → g. |
Первый энергетический уровень имеет один s-подуровень, второй – два подуровня (s- и p-подуровни), третий – три подуровня (s-, p-, d-подуровни) и т.д.
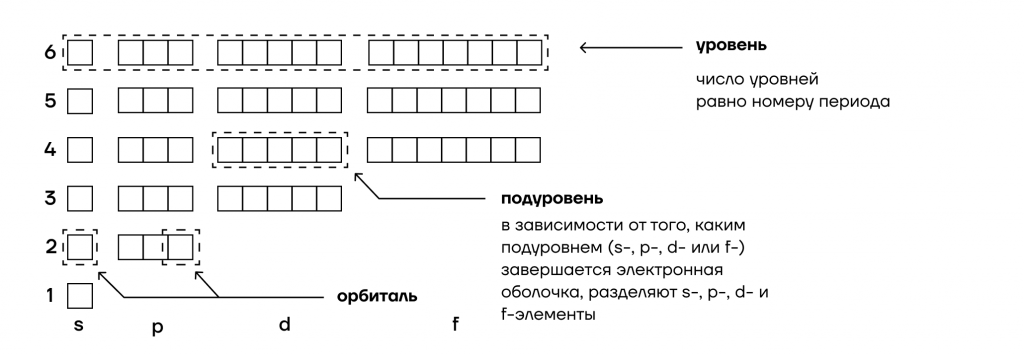
В свою очередь, подуровни состоят из атомных орбиталей. Орбитали имеют свои кодовые имена, которые обозначаются буквами. Мы их обозначаем следующим образом: s-, p-, d- и f-орбитали. Их просто запоминаем, никакой логики тут нет.
Каждую атомную орбиталь также можно представить в виде геометрических фигур. Так, s-орбиталь представляет собой шар, p-орбиталь имеет форму гантелек, d-орбиталь – форму нескольких гантелек.
Для изображения строения электронных слоёв атома (электронной конфигурации) пользуются условной записью.
Расположение электронов
Удобно представлять атомные орбитали в виде ячеек, в которых располагаются два электрона, их обозначаем в виде двух стрелочек, первая направлена вверх, а вторая — вниз.

Важно замечание: атомная орбиталь вмещает максимально два электрона!
Это называется принципом Паули. Он гласит, что два электрона не могут иметь одинаковые спины. Спин — характеристика электрона, проще всего его можно представить как вращение электрона по часовой стрелке и против часовой, поэтому в ячейке они расположены в противоположном направлении (т.е. +1/2 и -1/2).
Например, на картинке представлена электронно-графическая формула атома углерода. Стрелочками обозначены электроны, которые занимают атомные орбитали. Несколько атомных орбиталей на одном энергетическом уровне образуют подуровни.
Можно составить общую табличку с информацией о том, как распределяются электроны по энергетическим уровням и подуровням:
Атомные подуровни заполняются электронами в порядке увеличения их энергии. Этот порядок выглядит следующим образом:
| 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → … |
Схематично порядок заполнения энергетических подуровней представлен на картинке:
При заполнении этих ячеек удобно пользоваться правилом Хунда (или правилом «трамвайного вагона»):
После того, как мы заполнили все электроны по своим местам, мы можем составить электронную конфигурацию атома, которая будет отражать порядок заполнения электронов по подуровням в текстовом виде.
Например, у гелия 2 электрона, которые располагаются на 1-ом электронном уровне, на s-подуровне. Тогда его электронная конфигурация будет выглядеть как 1s 2 (большая цифра обозначает уровень, буква – подуровень, а маленькая цифра – число ē на подуровне)

Фактчек
- Электроны располагаются на электронных подуровнях, причем их число определяется порядковым номером элемента.
- Энергетические подуровни состоят из атомных орбиталей, которые для удобства обозначаются ячейками;
- По принципу Паули на каждой атомной орбитали могут располагаться максимально два электрона, причем их спины должны быть противонаправлены;
- Электроны располагаются по подуровням так, чтобы энергия системы была минимальна.
Проверь себя
Задание 1.
В квантовой ячейке максимально может располагаться:
- 1 электрон;
- 2 электрона;
- 3 электрона;
- 4 электрона.
Задание 2.
Атомные подуровни заполняются электронами:
- в порядке увеличения их энергии;
- в порядке уменьшения их энергии;
- в периодическом порядке.
Задание 3.
d-подуровень содержит:
- 1 атомную орбиталь;
- 3 атомные орбитали;
- 5 атомных орбиталей;
- 7 атомных орбиталей.
Задание 4.
s-орбиталь имеет форму:
- шара;
- гантели;
- эллипса;
- нескольких гантелей.
Ответы: 1. — 2; 2. — 1; 3. — 3; 4. — 1.
Распределение электронов по подуровням. Разбор первого задания ЕГЭ.
Напомню, что любой энергетический уровень можно разделить на орбитали (подуровни) – области вокруг ядра, в которых с наибольшей вероятностью встречаются определенные электроны. Их распределение не случайно, а согласованно с их энергией.
Для начала, определим максимальное количество электронов на подуровнях:
Распределение электронов по подуровням. Разбор первого задания ЕГЭ.
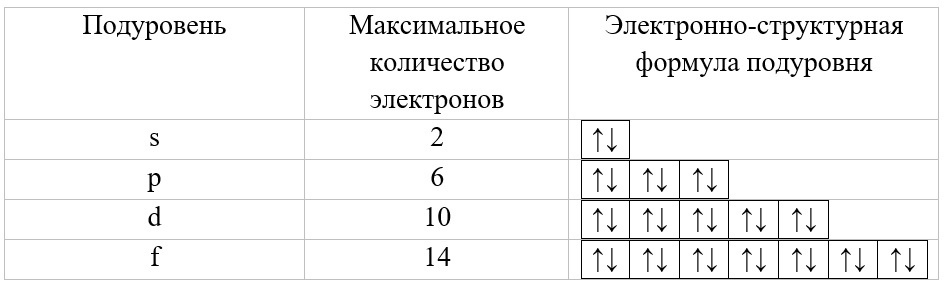
Максимальное количество электронов на подуровнях
Каждый уровень начинается с s-подуровня, далее, если количество электронов достаточно большое, заполняется p-подуровень, затем d- и f-орбитали.
Для лучшего понимания распределения электронов начните с построения планетарной модели атома. Рассмотрим на примере брома.
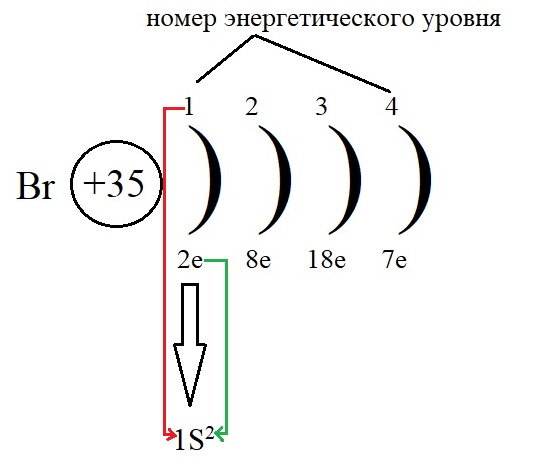
Начинаем запись структуры электронной оболочки атома с обозначения номера уровня, к которому принадлежат электроны (на рисунке обозначено красной стрелкой).
Затем называем подуровень (s, p, d, f).
Определяем количество электронов на этом уровне (зеленая стрелка на рисунке).
На первом уровне всего два электрона, оба поместились на s-подуровне, раз больше электронов на внутренней оболочке нет, может приступить с следующим уровням по тому же алгоритму:
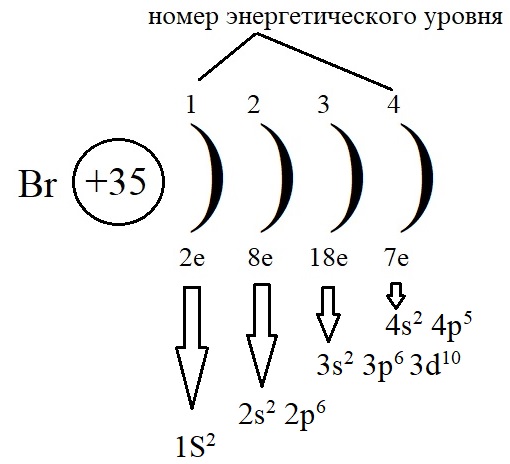
Электронно-структурная формула брома может быть записана двумя распространенными методами
Способ 1. Каждый последующий уровень имеет большую энергию и записывается выше:
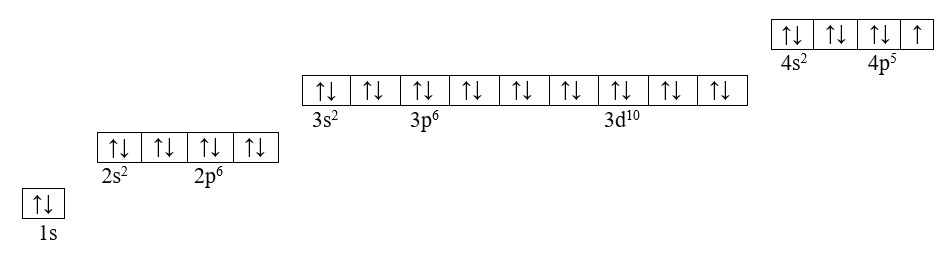
Способ 2. Более компактный, заключается в записи электронов каждого уровня с новой строки:
По электронно-структурной формуле легко понять, что у брома на внешнем уровне есть один неспаренный р-электрон и ему, до завершения внешнего энергетического уровня, не хватает одного электрона.
Попробуем применить полученные знания в решении первых заданий ЕГЭ по химии:
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Задание 1: определите, атомы каких из указанных в ряду элементов имеют три неспаренных электрона в основном состоянии.
Решение: у элементов А-подгрупп неспаренные электроны могут находиться только на внешнем уровне, поэтому далее будем рассматривать только его.

Верный ответ: 14
Обратите внимание на электронно-структурную формулу фтора и мышьяка. Их внешний энергетический уровень можно было записать и другим, к сожалению, неверным способом:
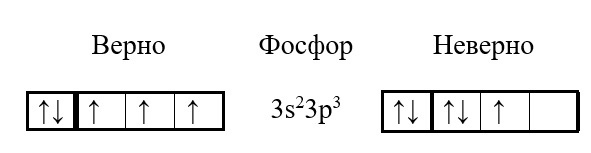
Всё, потому что есть еще одно правило, которым нужно пользоваться при построении структуры атома – правило Гунда (Хунда), которое определяет порядок заполнения электронами внутри орбитали таким образом, чтобы было заполнено как можно больше ячеек.
Рассмотрим еще одно задание:
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Задание 2: определите, атомам каких из указанных элементов до завершения внешнего энергетического уровня не хватает одного электрона.
Решение: для решения данного задания нет необходимости составлять структурные формулы, достаточно знать, что большинства элементов на внешнем уровне наиболее выгодным количеством электронов будет восемь (легко запомнить, так как количество электронов на внешнем уровне определяется по номеру группы, всего групп в ПС восемь, значит, максимум электронов на внешнем слое тоже восемь).
Таким образом, калий, находящийся в первой группе, имеет всего один электрон на внешнем уровне, до завершения внешней электронной оболочки ему не хватает целых семь электронов.
Фтор – элемент седьмой подгруппы, у него семь электронов на внешнем уровне, до «идеальной» оболочки ему не хватает одного электрона. Это первый правильный ответ.
Литий, как и калий относится к первой группе. Ему не хватает целых семь электронов.
Хлор, как же как и фтор, относится к седьмой группе, ему не хватает одного электрона до восьмиэлектронного внешнего энергетического уровня. Это наш второй верный ответ.
Алюминий – элемент третьей группы. До завершения внешнего слоя ему не хватает пять электронов.
Верный ответ: 24
Таким образом всем элементам IА-подгруппы не хватает семи электронов, IIА – шести, IIIА – пяти, IVА – четырех и так далее. Это может вам заметно сэкономить время на экзамене.
Решение задания ЕГЭ химия
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Задание 3: определите, атомам каких из указанных элементов до завершения внешнего энергетического уровня не хватает трёх электронов.
Решение: исходя из вышенаписанного, трех электронов до завершения внешнего энергетического уровня может не хватать элементам пятой группы Периодической системы. Это мышьяк и висмут.
Энергетические уровни атомов
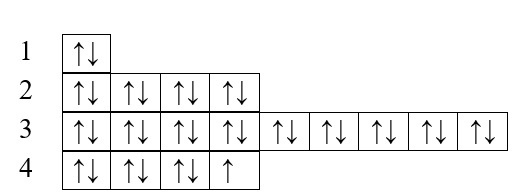
Чем ближе к атомному ядру находится электронная оболочка атома, тем сильнее притягиваются ядром электроны и тем больше их энергия связи с ядром. Поэтому расположение электронных оболочек удобно характеризовать энергетическими уровнями и подуровнями и распределением по ним электронов. Число электронных энергетических уровней равно номеру периода, в котором находится данный элемент. Сумма чисел электронов на энергетических уровнях равна порядковому номеру элемента.
Электронная структура атома представлена на рис. 1.9 в виде диаграммы распределения электронов по энергетическим уровням и подуровням. Диаграмма состоит из электронных ячеек, изображенных квадратами. Каждая ячейка символизирует одну электронную орбиталь, способную принять два электрона с противоположными спинами, обозначаемыми стрелками вверх и вниз.

Рис. 1.9. Распределение электронов но энергетическим уровням и подуровням атомов 1—4-го периодов таблицы элементов
Электронная диаграмма атома построена в последовательности повышения номера энергетического уровня. В том же направлении повышается энергия электрона и понижается энергия его связи с ядром. Для наглядности можно представить, что ядро атома находится «внизу» диаграммы. Число электронов в атоме элемента равно числу протонов в ядре, т.е. порядковому номеру элемента в периодической таблице.
Первый энергетический уровень состоит всего из одной орбитали, которую обозначают символом s. Эту орбиталь заполняют электроны водорода и гелия. У водорода один электрон, и водород одновалентен. У гелия два парных электрона с противоположными спинами, гелий имеет нулевую валентность и не образует соединений с другими элементами. Энергии химической реакции недостаточно для того, чтобы возбудить атом гелия и перевести электрон на второй уровень.
Второй энергетический уровень состоит из .«-подуровня и /.(-подуровня, имеющего три орбитали (ячейки). Литий третий электрон посылает на 2«-подуровень. Один непарный электрон обусловливает одновалентность лития. Бериллий вторым электроном заполняет тот же подуровень, поэтому в невозбужденном состоянии у бериллия два парных электрона. Однако незначительной энергии возбуждения оказывается достаточно для того, чтобы перевести один электрон на ^-подуровень, что делает бериллий двухвалентным.
Подобным образом происходит дальнейшее заполнение 2р-под- уровня. Кислород в соединениях двухвалентен. Более высокие валентности кислород не проявляет из-за невозможности распаривания электронов второго уровня и перевода их на третий энергетический уровень.
В отличие от кислорода сера, расположенная под кислородом в той же подгруппе, может проявлять в своих соединениях валентности 2, 4 и 6 благодаря возможности распаривания электронов третьего уровня и перемещения их на ^-подуровень. Заметим, что возможны и другие валентные состояния серы.
Элементы, у которых заполняется s-подуровень, называются «-элементами. Аналогично образуется последовательность р-элементов. Элементы s- и р-подуровней входят в главные подгруппы. Элементы побочных подгрупп — это ^-элементы (неправильное название — переходные элементы).
Удобно подгруппы обозначать символами электронов, благодаря которым образовались входящие в подгруппу элементы, например s’-подгруппа (водород, литий, натрий и др.) или //-подгруппа (кислород, сера и др.).
Если периодическую таблицу построить так, чтобы номера периодов повышались снизу вверх, а в каждую электронную ячейку помещать сначала по одному, а затем по два электрона, получится длиннопериодная периодическая таблица, напоминающая по форме диаграмму распределения электронов по энергетическим уровням и подуровням.