Обследование иммунитета. Иммунограмма. Субпопуляции лимфоцитов и интерфероновый статус. Хронические инфекции
Ведущей деятельностью нашей клиники является лечение и диагностика заболеваний иммунной системы. Будем рады помочь Вам в восстановлении правильной работы иммунитета, проведении и расшифровки иммунограммы. Сдать анализ на иммунный статус (иммунограмму) в нашей клинике Вы можете 7 дней в неделю. По Вашему желанию предложим Вам помощь врача иммунолога.
Основная функция иммунной системы человека – это определение, нейтрализация и удаление из организма генетически чужеродных веществ. Это могут быть бактерии, вирусы, грибы, различные токсины и т.д. Если одно из звеньев иммунной системы ослабевает или наоборот, чрезмерно активируется – возможно заболевание. Это может быть инфекция (например, вирус герпеса, молочница и др.), аллергия, злокачественная опухоль (здоровая иммунная система ежедневно уничтожает появляющиеся опухолевые клетки), аутоиммунное заболевание (атака иммунитета против здоровых тканей организма). Разные клетки и молекулы иммунитета выполняют различную работу. Лекарств «для всего иммунитета» не бывает, поэтому до начала лечения нужно определить причину нарушения работы иммунитета (сделать иммунограмму). Иммунограмма – это серия анализов, которые помогают определить, где именно, в каком из процессов иммунитета произошла поломка. В показателях иммунограммы обычно видно, что некоторые процессы в иммунитете идут нормально, а некоторые подавлены или наоборот, чрезмерно активированы. Иммунологическое лечение должно попадать точно в цель, работать точно там, где есть нарушения. Главная задача любого лечения иммунитета – это помочь восстановиться ослабленным иммунным процессам, не мешать правильно работающим процессам, а чрезмерно активированные – «охладить». Просто сдать кровь на иммунограмму недостаточно: нужно соотнести показатели иммунограммы с общим состоянием организма, текущими заболеваниями, качеством сна и психического самочувствия.
Что такое иммунограмма?
Иммунограмма это комплексное исследование основных показателей иммунной системы человека. Обычно, основным материалом для исследования иммунного статуса служит венозная кровь, но для исследования могут использоваться слюна, ликвор и соскоб из носоглотки.
Что показывает иммунограмма? Основные параметры:
- Состояние клеточного иммунитета. Определяются маркеры иммунокомпетентных клеток, количество разных видов клеток иммунитета и их процентное соотношение. Виды клеток иммунитета – как рода войск: у каждого вида клеток своя работа.
- Состояние гуморального иммунитета. Исследуется уровень иммуноглобулинов IgA, IgG, IgM, IgE. Иммуноглобулины – это антитела, которые могут связывать чужеродные агенты. Исследуются циркулирующие иммунные комплексы (ЦИК).
- Интерфероновый статус. Исследуются интерфероны или интерфероновый статус. Интерфероны – это сигнальные молекулы, которые передают возбуждающие или тормозящие сигналы от клетки к клетке. Интерфероны обладают и прямым уничтожающим действием на вирусы и опухолевые клетки. Интерфероновый статус поможет оценить содержание интерферонов альфа и гамма в крови, способность клеток иммунной системы вырабатывать интерфероны.
- Система комплемента – компоненты комплемента С3 и С4. Комплемент – это элемент врожденного иммунитета т.е. комплекс белков, предназначенный для защиты организма от чужеродных агентов. Система комплемента работает вне зависимости от наличия/отсутствия иммунологической памяти к конкретным микробам: распознает микробы по их общим признакам.
- Функция фагоцитоза. Это способность иммунных клеток захватывать чужеродные организмы. Фагоцитирующая функция нейтрофилов, обычно, проверяется с помощью НСТ-теста (тест с нитросиним тетразолием).
- В ряде случае определяются аутоиммунные маркеры. Это циркулирующие иммунные комплексы, антинуклеарный фактор и различные аутоантитела, направленные против тканей собственного организма.
- Может определяться иммуноглобулин Е (IgE). IgE участвует в аллергических реакциях.
- Эозинофильный катионный белок (ECP). Белок, высвобождающийся при аллергическом процессе. По высокому уровню эозинофильного катионного белка можно определить текущий аллергический процесс, инвазию крупными паразитами.
- Состояние и работа вилочковой железы. Это железа, в которой созревают и проходят «обучение» Т-лимфоциты. Для этого можно посмотреть соответствующие маркеры в анализе крови на иммунный статус и оценить строение и размеры вилочковой железы с помощью компьютерной томографии (КТ органов грудной клетки).
| Клетки: | Маркеры: |
| В-лимфоциты | CD19, CD20, CD22 |
| Клетки естественные киллеры (NK-клетки) | CD3-CD16+CD56+ |
| Все Т-лимфоциты, включая Т-хелперы, Т-цитотоксические, Т-киллеры | CD3 |
| Т-киллеры | CD3+CD16+CD56+ |
| Т-хелперы | CD3+CD4+ |
| Цитотоксические Т-лимфоциты (старое название – Т-супрессоры) | CD3+СD8+ |
| Клетки, с которыми может соединяться интерлейкин-2. К ним относятся регуляторные Т-клетки, которые могут участвовать в торможении воспалительных реакций. | CD3+CD25+ |
Реже смотрятся другие специфические параметры (расширенная иммунограмма), в зависимости от целей и задач поисков.
Расшифровка иммунограммы – это процесс, который выполняется врачом по результатам исследования иммунограммы и других исследований, включая рентгеновские снимки, УЗИ и осмотр пациента. Без присутствия пациента иммунограмму достаточно трудно интерпретировать и не всегда это возможно сделать правильно. Например, если иммунитет был изначально снижен, а пациент заболел каким-то воспалительным заболеванием (к примеру, активировался вирус герпеса), то во время активного воспалительного процесса иммунитет будет работать более агрессивно и иммунограмма может стать ложно-нормальной. Картина чрезмерно активированного иммунитета может наблюдаться, если у пациента изначально был нормальный иммунитет, но он недавно переболел или перенес вакцинацию, травму. Расшифровка иммунограммы может проводиться одновременно с осмотром пациента в кабинете у врача иммунолога. Здесь важен полноценный физикальный осмотр пациента врачом иммунологом, с оценкой состояния лимфатических узлов, слизистых оболочек, органов дыхания, суставов, кожи и др. Это помогает правильно расшифровать и интерпретировать иммунограмму, с учетом персональных особенностей и текущего состояния здоровья.
Подготовка к исследованию иммунного статуса. Иммунограмма делается в комплексе с общим анализом крови. Сдавать кровь на иммунограмму нужно утром, натощак. Для того, чтобы избежать искажения результатов в анализе, мы рекомендуем воздержаться от приема алкоголя и курения за 1-2 дня до исследования иммунного статуса. Сдавать кровь на иммунограмму не рекомендуется во время менструации и на фоне острых инфекционных заболеваний, протекающих с высокой температурой.
Иммунограмму можно сдать в нашей клинике. По результатам исследования мы предложим Вам консультацию врача иммунолога, который даст расшифровку иммунограммы, порекомендует соответствующее лечение или направит надо дополнительное обследование, если требуется.
Стоимость анализа на иммунитет (иммунограммы) зависит от количества показателей, которые нужно учитывать при назначении лечения.
Зачем нужна иммунограмма
Иммунитет – сложная система. Планируя лечение, мы должны четко представлять себе, какие именно нарушения в иммунной системе произошли и почему. Тогда и лечение можно с уверенностью направить именно туда, где оно требуется. Не существует лекарства «Для всей иммунной системы». Современные лекарства позволяют избирательно, «точечно» помочь тому или иному иммунному процессу, а иммунограмма помогает определить эффективные и безопасные точки приложения лечения. Такое лечение и надежнее, и требует меньше медикаментов и отвечает критериям безопасности.
Мы можем предложить Вам полноценное лабораторное обследование иммунитета и помощь аллерголога-иммунолога при “расшифровке” анализов на иммунитет. Действует выгодное спецпредложение
| Вид иммунограммы | Результат иммунограммы |
| Иммунограмма стандартная |  |
| Иммунограмма расширенная |  |
| Интерфероновый статус |  |
Образцы результатов исследований с расшифровкой
Основные показания для обследования иммунитета
Мы обследуем иммунную систему, если заболевание протекает при ее участии. В основном, это:
- Наличие хронического воспаления где-либо, когда иммунитет не в силах справиться с инфекцией (тонзиллит, фарингит, бронхит, цистит, пиелонефрит, гастрит, дисбактериоз, простатит, уреаплазма, молочница, герпес и др.);
- Наличие аутоиммунного, ревматического заболевания, когда иммунитет может проявлять агрессию к здоровым тканям организма, принимая их за чужеродные;
- Частые (более 6 раз в год) и длительные заболевания «простудами»: инфекционные заболевания кожи, слизистых, дыхательных путей с длительным течением и низкой эффективностью при лечении антибиотиками
- Аллергия;
- Нейроинфекции, в т.ч., арахноидит;
- Риск онкологических заболеваний (снижение противоопухолевого иммунитета, неблагоприятная наследственность, радиоактивное облучение и др.), состояние после операций, химиотерапии, лучевой терапии.
- Повышение температуры на протяжении 2-х недель без причины
- Увеличение лимфатических узлов
- Снижение массы тела без видимой причины
- Чувство усталости, боли в мышцах, потеря работоспособности
- Частые рецидивы герпеса, молочницы, тонзиллита, фарингита, ринита, гайморита, дерматита цистита, пиелонефрита, бронхита и других хронических воспалительных заболеваний
Обследование на наличие инфекций
Одновременно с исследованием иммунной системы мы обычно уточняем наличие в организме инфекций и характер их взаимодействия с иммунитетом. Человек постоянно взаимодействует с микробами. В норме микробы оказываются под контролем иммунной системы и во внутренние среды организма не проникают. Но если работа иммунитета нарушена – заражение происходит легко. Лечение таких инфекций правильнее проводить в комплексе с восстановлением иммунной системы. Поэтому правильное обследование перед лечением – это «Иммунограмма + Инфекции». Действует выгодное спецпредложение
Иммунодепрессант: понятие, виды, особенности
Иммуномодулирующие препараты и иммунодепрессанты имеют еще и другое название – иммуносупрессоры. Они используются для замедления работы и размножения клеток иммунной системы. Их нужно принимать тогда, когда нужно остановить иммунные реакции, например, при пересадке органов, аутоиммунных патологиях, костно-мышечной системы и прочих серьезных заболеваниях.
Особенности иммунодепрессантов
Применять иммуносупрессивные средства нужно тогда, когда другие методы лечения испробованы и не достигнуты желаемые результаты, а шансы на положительный исход намного выше рисков от их использования. Из перечня лекарств-иммунодепрессантов практически все имеют иммуносупрессивную активность, оказывают широкое действие. Их применение понижает антибактериальный и противоопухолевый иммунитет, повышает риск появления инфекционных заражений, онкопатологии.

Поскольку заболевания и осложнения состояния здоровья во многих случаях имеют неблагоприятный исход, то противопоказания для лечения иммуносупрессорами несущественны.
Ученые работают над тем, чтобы придать лекарству узкую сферу действия, то есть, чтобы оно действовало на одну конкретную проблему, не затрагивая другие клетки.
С учетом действия препарата на иммунитет человека, их относят к нескольким группам:
Полностью подавляющие иммунную систему;
Для облегчения проявлений аутоиммунных заболеваний;
Противовоспалительное действие – необходимы при нарушении работы мозга.
Есть и другая классификация препаратов:
Также есть несколько поколений этих средств:
Принцип действия
Иммуноспрессоры имеют определенный механизм работы:
«Азатиоприн» и «Метотрексат» препятствуют разделению клеток, приостанавливают образование белковых элементов. Результат происходит медленно и с момента использования будет заметен только через пол года. Эти препараты имеют противоопухолевое действие. Также если принимать его в небольшом количестве, то будет достигнут противовоспалительный результат. Первый препарат содержит меньшее количество токсичных веществ.
«Циклоспорин». Достигается селективное и обратимое воздействие на клеточный иммунный ответ. Повышается продолжительность функционирования аллогенных трансплантатов разных органов.
Глюкокортикоиды. Отличаются сильным иммунодепрессивным эффектом. Останавливают работу макрофагов, лимфоцитов, не позволяя им попадать в кровь. Если принимать в большом количестве, то будет приостановлена работа иммуноглобулина. Отличаются выраженным и быстрым противовоспалительным действием.
Препараты золота, собираясь в зараженных суставных тканях, уменьшают фагоцитарную работу макрофагов, снижают содержание иммуноглобулина в плазме, что приводит к уменьшению его разрушительного воздействия на суставы. Результат будет заметен спустя 6 месяцев.
Даклизумаб. Это очень сильный препарат, от которого достигается более мощный цитостатический эффект.
Клинико-фармакологические принципы
Чтобы достигнуть желаемого результата от применения лекарственных препаратов, нужно учитывать некоторые клинико-фармакологические принципы:
Большие дозы – маленькие дозы;
Маленькое противовоспалительное действие – большое противовоспалительное действие;
Быстрое лечение – продолжительное лечение;
Разное время достижения результата – эффект будет заметен через конкретный промежуток времени (день, неделя, месяц, полгода);
Подавление производства ДНК – подавление разделения РНК.
Особенности применения
При приеме этих лекарственных препаратов нужно учитывать меры предосторожности. Во-первых, их нужно с осторожностью принимать при беременности, грудном вскармливании, проблемах работы почек и печени, инфекционных заражениях, нарушенной функции костного мозга. Их прописывают при следующих заболеваниях и хирургических вмешательствах:
пересадка органов и тканей;
миокард в хронической форме.
Средства с избирательным воздействием не мешают появлению защитных клеток при инфекционных заболеваниях и практически никак не сказываются на противоопухолевом иммунитете.
Разница между иммунодепрессантов и иммуностимуляторов
Иммунитет человека иногда нуждается в коррекции. В таком случае стоит прибегать к помощи особых лекарственных препаратов – иммунодепрессантов и иммуностимуляторов. Стоит понимать разницу между ними:
при продолжительном хроническом заболевании защитная функция организма нарушается и отмечаются аутоиммунные сбои, то есть происходит самоатака клеток. В этом случае необходима коррекция иммуносупрессорами. Их прописывают при разных аллергиях, чрезмерной работе лимфоцитных клеток, после пересадки тканей и органов;
при заражении вредными микроорганизмами запускается производство особых клеток. Если же их количества недостаточно, то человек заболевает. Для повышения выработки защитных клеток стоит использовать иммуностимуляторы. Как правило их нужно принимать при таких серьезных проблемах, как: хронические медленно протекающие заболевания с регулярными рецидивами, которые спровоцированы микробной и вирусной инфекцией.
Как видно, оба этих средства направлены на улучшение иммунитета индивида.
Можно сделать вывод, что эти препараты обладают широким действием и используются при различных заболеваниях и показаны при пересадке тканей и органов. К тому же у них нет побочных реакций, которые могли бы нанести вред здоровью и жизни человека. Вы также можете приобрести препараты для улучшения кровообращения через наш каталог.
Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. Администрация сайта, редакторы и авторы статей не несут ответственности за любые последствия и убытки, которые могут возникнуть при использовании материалов сайта.
Взаимодействие ВИЧ с Т-супрессорами
Дж. Леви с сотрудниками Калифорнийского университета установили, что иммунная система организма способна контролировать размножение вируса СПИД в зараженных клетках, а Т-супрессоры подавлять размножение ВИЧ. Учитывая, что только цитотоксические клетки и Т-супрессоры способна подавлять размножение ВИЧ, а их рецепторы устроены таким образом, что антиген связывается лишь одновременно с белками МНС класса1, в отличие от Т-хелперов, связывающихся с белками МНС класса 2, можно сделать заключение о возможном повреждении ВИЧ белков МНС класса 2.
- В чем опасность ЗППП
- Венерические заболевания
- Группы риска заражения ЗППП
- Диагностика ЗППП
- ЗППП — заболевания, передающиеся половым путем
- Инкубационный период ЗППП
- Инфекционные заболевания
- ИППП – инфекции, передающиеся половым путем
- Легенды и мифы о венерических заболеваниях
- Лечение ЗППП
- Подготовка к анализам на инфекции
- Последствия и осложнения ЗППП
- Профилактика заболеваний, передающихся половым путем (ЗППП)
- Профилактика ЗППП
- Пути передачи ЗППП
- Симптомы и признаки ЗППП
- СПИД
- Анализы на ВИЧ и СПИД
- Взаимодействие ВИЧ с другими клетками организма
- Взаимодействие ВИЧ с моноцитами
- Взаимодействие ВИЧ с Т-супрессорами
- ВИЧ-2
- ВИЧ-инфекция
- Влияние ВИЧ на Т-хелперы
- Возможности разработки вакцин
- Гены и белки ВИЧ
- Диагностика ВИЧ инфекции
- Заключение
- Клинические проявления ВИЧ инфекции
- Ко-факторы ВИЧ-инфекции
- Лечение ВИЧ и СПИД
- Лечение ВИЧ инфекции
- Макрофаги и вич
- Механизмы взаимодействия ВИЧ с различными звеньями иммунной системы
- Новые варианты вируса СПИД
- Оппортунистические инфекции и опухоли
- Особенности инфицирования и заболевания детей
- Патогенез и клиника ВИЧ инфекции
- Передача ВИЧ инфекции
- Последствия ВИЧ и СПИДа
- Профилактика СПИДа и ВИЧ-инфекции
- Пути передачи ВИЧ
- Регуляция экспрессии вирусных генов
- Результаты взаимодействия ВИЧ с В-клетками
- Симптомы ВИЧ
- Система интерферона при ВИЧ инфекции
- СПИД-ассоциированный комплекс
- Строение вирусной частицы ВИЧ
- Строение генома и экспрессия генов ВИЧ
До 31 августа «Знакомство с доктором» на первичный прием врача скидка 20%
* Подробности уточняйте у администраторов1 670

Специально для сохранения и восстановления здоровья людей в 2000 году была основана многопрофильная клиника «ЕВРОМЕДПРЕСТИЖ», в которой работают лучшие специалисты из 25 областей медицины. Наши врачи, в совершенстве владеющие своим ремеслом, готовы бороться с любым Вашим недугом!





Большое спасибо хочу сказать врачу-маммологу Афанасьевой Алле Леонидовне. Обратилась к ней из-за появившегося уплотнения в груди и весьма неприятными и болезненными ощущениями. Первое, что приходит в голову — рак.Пришла к ней практически в панике и истерике. Алла Леонидовна очень внимательно отнеслась ко мне и моим проблемам, ее забота оставила неизгладимые впечатления о ней и клинике Евромедпрестиж в целом. Здесь работают душевные люди и отличные профессионалы.
Ломакина Н.П. прекрасный врач-терапевт, которая помимо своих профессиональных качеств еще и прекрасный, добрый человек, переживающий за каждого пациента. Хочется выразить огромную благодарность за ее поддержку!
у моего папы целый букет и остеохондроз и радикулит и грыжа. если бы я не повела его в клинику, так бы и сидел на одних обезболивающих, ничего не делал. А сейчас и он и я можем сказать, как нам повезло, что мы попали именно к Игорю Анатольевичу в Евромедпрестиж, он очень помог папе!
Уже далеко не первый год лечусь у Галина Сергея Васильевича. Он однозначно профессионал с золотыми руками. А также не обделен качествами доброго и отзвчивого человека. После посещения данного доктора, помимо действенного лечения получаешь еще и заряд позитивной энергии. Всегда рекомендую его всем знакомым. А теперь рекомендую еще и читающим данный отзыв!
Хочу сказать спасибо всем медсестрам физиотерапии. Длительное время ходила на процедуры, попадала к разным девочкам и всех их объединяет одно — доброта, приветливость, благожелательное отношение к пациентам любого возраста, профессионализм.
был в клинике на приеме у уролога, врач внимательный анализы проверяет досканально, консультацию проводит на доступном для пациента языке. в процессе разбора моей проблемы выяснили, что необходима консультация другого специалиста, а по урологии все слава богу в порядке
Самый лучший и любимый врач — это Черноморченко Татьяна Валерьевна! Это врач с большой буквы, профессиональные качества которой говорят сами за себя. Ее метод УВТ вернули мне веру в собственные физические силы и помогли спасти мою семейную жизнь. Огромное, человеческое спасибо данном доктору!
Нашли кисту и начали настаивать на операции, конечно дали время на раздумья. С учетом того, что опыта в операциях у меня еще никогда не было, ночь была просто кошмарная. Перерыв весь интернет, нашла то что хотела — можно попробовать вылечить медикаментозным способом. Мой врач не хотел лечить медикоментозно от слова совсем. Подруга порекомендовала обратиться к Булатовой Л.Н. и в данный момент я безумно благодарна данному врачу. После осмотра, она назначила консервативное лечение, но предупредила о необходимости строго его соблюдения. Лечение было трудным, но стоящим, ведь за полгода мы смогли кисту побороть. Однозначно буду ходить только к Булатовой Л.Н.
Благодарю терапевта Ломакину Наталью Петровну за ее высокие профессиональные качества, а также очень доброе и отзывчивое отношение к своим пациентам! Очень давно наблюдаюсь именно у нее, и с каждым разом все больше влюбляюсь в данного специалиста. Она никогда не упустит малейшие детали симптомов и общего состояния, всегда подберет максимально эффективную стратегию лечения и выбора препаратов. Очень редко можно встретить такого врача, к которому хочется возвращаться. Действительно человек работающий по призванию, а не по професии!
Бесконечно благодарна гастроэнтерологу Рябовой Марине Анатольевне. Заболевание ЖКТ не отпускает на протяжении многих лет. Но ни один врач не назначал таких глубоких обследований, как назначила Марина Анатольевна. Это действительно профессионал с большой буквы, грамотный и вежливый специалист. Безумно рада, что попала именно к ней.
Я приходила к этому доктору уже не первый и сейчас посещала ее для профилактики. Алла Леонидовна прекрасный врач. Я всегда советую ее!
Выражаю огромную благодарность Афанасьевой Алле Леонидовне. Она врач с большой буквы, всегда подходит с максимумом профессионализма, но при этом остается с очень приятным человеческим отношением. Это действительно доктор от Бога. Желаю вам только успехов, здоровья и счастья!
Механизмы действия онкогенов и опухолевых супрессоров. Введение
Канцерогенез — многоступенчатый процесс накопления мутаций и других генетических изменений, приводящих к нарушениям ключевых клеточных функций, таких как регуляция пролиферации и дифференцировки, естественной гибели клеток ( апоптоз ), морфогенетических реакций клетки, а также, вероятно, к неэффективному функционированию факторов специфического и неспецифического противоопухолевого иммунитета . Только совокупность таких изменений, приобретаемая, как правило, в результате довольно длительной эволюции неопластических клонов, в ходе которой происходит отбор клеток с необходимыми признаками, может обеспечить развитие злокачественного новообразования. Вероятность возникновения в одной клетке нескольких генетических изменений резко повышается при нарушениях работы систем, контролирующих целостность генома. Поэтому мутации, ведущие к генетической нестабильности, также являются неотъемлемым этапом опухолевой прогрессии. Более того, некоторые врожденные аномалии систем генетического контроля являются фактором, предопределяющим неизбежное возникновение новообразования: они настолько увеличивают вероятность появления в каждой клетке организма различных онкогенных мутаций, что у индивидуума раньше или позже в какой-то из клеток пролиферирующего клона под давлением отбора обязательно накопится необходимая совокупность изменений и образуется опухоль.
Значительный прогресс в понимании механизмов канцерогенеза связан с открытием сначала онкогенов и протонкогенов, а затем — опухолевых супрессоров и мутаторных генов . Онкогены — это клеточные или вирусные (вносимые вирусом в клетку) гены, экспрессия которых может привести к развитию новообразования. Протоонкогены — нормальные клеточные гены, усиление или модификация функции которых превращает их в онкогены. Опухолевые супрессоры ( антионкогены , рецессивные опухолевые гены) — клеточные гены, инактивация которых резко увеличивает вероятность возникновения новообразований, а восстановление функции, наоборот, может подавить рост опухолевых клеток. Следует заметить, что причисляемые к опухолевым супрессорам так называемые «мутаторные» гены, т.е. гены, нарушения функции которых тем или иным способом увеличивает темп возникновения мутаций и/или других генетических изменений, могут и не влиять на рост неопластических клеток. Однако их инактивация столь сильно увеличивает вероятность появления различных онкогенных мутаций, что образование опухоли становится лишь делом времени.
Принадлежность к онкогенам или опухолевым супрессорам определяется несколькими критериями: а) закономерным характером изменений структуры и/или экспрессии данного гена в клетках определенных или различных новообразований; б) возникновением в юном или молодом возрасте определенных форм опухолей у индивидов с передающимися по наследству герминальными (т.е. произошедшими в половой клетке) мутациями данного гена; в) резким повышением частоты появления опухолей у трансгенных животных, либо экспрессирующих активированную форму данного гена — в случае онкогенов, либо несущих инактивирующие мутации («нокаут») данного гена — в случае опухолевых супрессоров; г) способностью вызывать в культивируемых in vitro клетках морфологическую трансформацию и/или неограниченный рост (онкогены), либо подавление клеточного роста и/или выраженности признаков трансформации (опухолевые супрессоры).
Два последних десятилетия характеризовались бурным открытием все новых и новых онкогенов и опухолевых супрессоров. К настоящему времени известно около сотни потенциальных онкогенов (клеточных и вирусных) и около двух десятков опухолевых супрессоров. Были описаны генетические события, приводящие к активации протоонкогенов или инактивации опухолевых супрессоров [1-6]. Обнаружено, что механизм действия вирусных онкогенов связан с активацией клеточных протоонкогенов ( ретровирусы ) или инактивацией опухолевых супрессоров ( ДНК-содержащие вирусы ) [7-11]. Выявлены характерные для тех или иных форм новообразований человека изменения онкогенов и опухолевых супрессоров, в том числе высокоспецифичные аномалии, используемые для постановки диагноза [3,12] (табл. 1, 2).
Таблица 1.
Некоторые изменения протоонкогенов, характерные для новообразований человекаПротоонкоген Функция белка Изменения Новообразования* ERBB1 (EGF-R) рецепторная тирозинкиназа амплификация и гиперэкспрессия гена глиобластомы и другие нейрогенные опухоли ERBB2 (HER2) рецепторная тирозинкиназа амплификация и/или гиперэкспрессия гена рак молочной железы PDGF-Rb рецепторная тирозинкиназа хромосомные транслокации, образующие химерные гены TEL/ PDGF-Rb, CVE6/PDGF-Rb , кодирующие постоянно активированные рецепторы хронический миеломоноцитарный лейкоз, острый миелобластный лейкоз SRC нерецепторная тирозинкиназа мутации в кодоне 531, отменяющие негативную регуляцию киназной активности часть опухолей толстого кишечника на поздних стадиях K-RAS, N-RAS,H-RAS участвует в передаче митогенных сигналов и регуляции морфогенети-ческих реакций мутации в кодонах 12,13,61, вызывающие образование постоянно активированной GTP-связанной формы Ras 60-80% случаев рака поджелудочной железы; 25-30% различных солидных опухолей и лейкозов PRAD1/циклинD1 регулирует клеточный цикл амплификация и/или гиперэкспрессия гена рак молочной и слюнных желез C-MYC фактор транскрипции, регулирует клеточный цикл и активность теломеразы а) хромосомные транслокации, перемещающие ген под контроль регуляторных элементов генов иммуноглобулинов;
б) амплификация и/или гиперэкспрессия гена; мутации, стабилизирую-щие белока) лимфома Бэркита
б) многие формы новообразованийCTNNB1 (beta-катенин) а) транскрипционный фактор, регулирет c-MYC и циклин D1;
б) связываясь с кадхерином, участвует в образовании адгезионных контактовмутации, увеличивающие количество несвязанного с Е-кадхерином beta-катенина, который функционирует как транскрипционный фактор наследственный аденоматозный полипоз толстой кишки;различные формы спорадических опухолей BCL2 подавляет апоптоз, регулируя проницаемость митохондриальных и ядерных мембран хромосомные транслокации, перемещающие ген под контроль регуляторных элементов генов иммуноглобулинов фолликулярная лимфома ABL регулирует клеточный цикл и апоптоз хромосомные транслокации, ведущие к образованию химерных генов BCR/ABL, продукты которых стимулируют пролиферацию клеток и подавляют апоптоз все хронические миелоидные лейкозы, часть острых лимфобластных лейкозов MDM2 инактивирует р53 и pRb амплификация и/или гиперэкспрессия гена часть остеосарком и сарком мягких тканей *Курсивом выделены наследственные формы заболеваний, возникающие при мутациях в половых клетках. В остальных случаях мутации происходят в соматических клетках, которые образуют опухоли
Таблица 2.
Формы опухолей человека, возникающие при инактивации некоторых опухолевых супрессоров и мутаторных геновГен Функция белка Новообразования* p53 транскрипционный фактор; регулирует клеточный цикл и апоптоз, контролирует целостность генома синдром Ли-Фраумени
и большинство форм спорадических опухолейINK4a-ARF ингибирование Cdk4**, активация р53** наследственные меланомыи многие спорадические опухоли Rb контролирует вход в S-фазу, регулируя активность фактора транскрипции E2F наследственные ретинобластомы и многие формы спорадических опухолей TbR-II рецептор второго типа для цитокина TGF-b наследственные и спорадические раки толстой кишки SMAD2, SMAD 3 передают сигнал от активированных рецепторов TGF-b к Smad4 рак толстой кишки, легкого, поджелудочной железы SMAD4/DPC4 транскрипционный фактор; опосредует действие цитокина TGF-b, приводящее к активации ингибиторов Cdk — p21WAF1, p27KIP1, p15INK4b ювенильный гамартоматозный полипоз желудка и кишечника; различные формы спорадических опухолей Е-кадхерин участвует в межклеточных взаимодействиях; инициирует передачу сигналов, активирующих р53, p27KIP1 наследственные раки желудка и многие формы спорадических опухолей APC связывает и разрушает цитоплазматический beta-катенин, препятствует образованию транскрипционных комплексов beta-катенин/Tcf наследственный аденоматозный полипоз и спорадические опухоли толстой кишки VHL подавляет экспрессию гена VEGF (фактора роста эндотелия сосудов) и других генов, активируемых при гипоксии синдром фон Хиппеля-Линдау (множественные гемангиомы); светлоклеточные карциномы почки WT1 транскрипционный фактор; связываясь с р53, модулирует экспрессию р53-респонсивных генов наследственные нефробластомы (опухоль Вилмса) PTEN/MMAC1 фосфатаза; стимулирует апоптоз, подавляя активность PI3K-PKB/Akt сигнального пути болезнь Коудена (множественные гамартомы); многие спорадические опухоли NF1 (нейрофибромин) белок семейства GAP;переводит онкоген ras из активной в неактивную форму нейрофиброматоз первого типа NF2 (мерлин) участвует во взаимодействиях мембраны с цитоскелетом нейрофиброматоз второго типа; спорадические менингиомы, мезотелиомы и др. опухоли BRCA1 повышает активность р53 и других факторов транскрипции, связываясь с RAD51 участвует в узнавании и/или репарации повреждений ДНК наследственные опухоли молочной железы и яичников; различные формы спорадических опухолей BRCA2 траскрипционный фактор с активностями гистоновой ацетил-трансферазы; связываясь с RAD51 участвует в репарации ДНК наследственные опухоли молочной железы и яичников; различные формы спорадических опухолей MSH2, MLH1, PMS1, PMS2 репарация неспаренных участков ДНК (mismatch repair) неполипозный рак толстой кишки и яичников; многие спорадические опухоли * Курсивом выделены наследственные формы заболеваний, возникающие при мутациях в половых клетках.
**Локус INK4a/ARF кодирует два белка: p16 INK4a — ингибитор циклинзависимых киназ Cdk4/6 и p19 ARF (Alternative Reading Frame) — продукт альтернативной рамки считывания, который, связывая р53 и Mdm2, блокирует их взаимодействие и препятствует деградации р53 [13, 14]. Делеции и многие точечные мутации в локусе INK4a/ARF вызывают одновременно инактивацию супрессорных активностей обоих этих белков [15].Однако долгое время знания о каждом из онкогенов или опухолевых супрессоров представлялись дискретными, в значительной мере не связанными между собой. И лишь в самые последние годы стала вырисовываться общая картина, показывающая, что подавляющее большинство известных протоонкогенов и опухолевых супрессоров являются компонентами нескольких общих сигнальных путей, контролирующих клеточный цикл, апоптоз, целостность генома, морфогенетические реакции и дифференцировку клеток . Очевидно, изменения именно в этих сигнальных путях в конце концов и приводят к развитию злокачественных новообразований. Далее приведены сведения об основных мишенях действия онкогенов и опухолевых супрессоров.
Иммунодепрессанты – препараты, снижающие иммунитет

Разработчик сайтов, журналист, редактор, дизайнер, программист, копирайтер. Стаж работы — 25 лет. Область интересов: новейшие технологии в медицине, медицинский web-контент, профессиональное фото, видео, web-дизайн. Цели: максимально амбициозные.
- Запись опубликована: 19.07.2020
- Reading time: 3 минут чтения
Иммунодепрессанты – это лекарственные препараты, направленные на снижение иммунного ответа организма или, проще говоря, ослабление иммунной системы. Они используются в трансплантологии для предотвращения отторжения трансплантата, а также при лечении аллергий и аутоиммунных заболеваний. Иммунодепрессанты чаще всего используются у пациентов с трансплантацией органов. Недавно имплантированная почка, легкое или сердце рассматриваются иммунной системой как инородное тело, с которым необходимо бороться. Это связано с тем, что ДНК клеток донора никогда не идентична ДНК клеток реципиента, хотя во время квалификации пациента для трансплантации совместимость тканей является одним из наиболее важных параметров.
Все, что воспринимается иммунной системой как «чужое», начинает уничтожаться. Цель иммуносупрессивных препаратов состоит в том, чтобы ослабить иммунную систему настолько, чтобы она не смогла отрицать пересаженный орган или начала лояльно относиться к аллергену. Правильно подобранная иммуносупрессия является одним из элементов, гарантирующих успешную пересадку или снятие мучительных симптомов аллергии.
Виды иммунодепрессантов
Иммунодепрессанты делятся на 6 групп:
- ингибиторы кальциневрина – такролимус, циклоспорин;
- цитостатические препараты – циклофосфамид, азатиоприн;
- ингибиторы серин – треонин киназы сиролимус, эверолимус;
- моноклональные антитела – базиликсимаб;
- глюкокортикостероиды – метилпреднизолон, преднизон, преднизолон;
- другие иммунодепрессанты – микофенолат мофетил, микофенолат натрия.
Ингибиторы кальциневрина
Ингибиторы кальциневрина не имеют полностью понятного описания механизма действия. Считается, что они косвенно ингибируют активность Т-лимфоцитов, блокируя действие кальциневрина – белка, который является частью сигнального пути в иммунной системе.
Такролимус – по своей структуре относится к группе макролидов. Он используется для предотвращения отторжения органа после трансплантации, а также для лечения острого отторжения органа. Кроме того, такролимус используется при лечении атопического дерматита (АД).
Но этот препарат вызывает ряд побочных эффектов, что делает терапию рискованной. Побочные эффекты этого лекарства включают головную боль, мышечную дрожь и проблемы с почками. Этот препарат также может влиять на уровень сахара в организме и вызывать гипергликемические состояния.
Циклоспорин – пептид, вырабатываемый грибом Tolypocladium inflatum, Это лекарство используется для предотвращения отторжения трансплантата после пересадки сердца, почек, печени, поджелудочной железы, тонкого кишечника и кожи. Этот препарат также предотвращает реакции GvH («трансплантат против хозяина») при трансплантации костного мозга. Циклоспорин также используется при АД, ревматоидном артрите (RA) и кератите.
Побочные эффекты препарата включают, прежде всего, нарушение жирового обмена в организме, тремор мышц, головные боли, артериальную гипертензию и гирсутизм – чрезмерный рост волос на теле по мужскому типу. При использовании циклоспорина не следует употреблять сок грейпфрута из-за возможного увеличения концентрации циклоспорина в крови.
Ингибиторы кальциневрина
Цитостатические препараты
Цитостатические препараты представляют собой гетерогенную группу препаратов, влияющую на деление клеток.
Циклофосфамид – цитостатический препарат, механизм действия которого заключается в разрыве связей между ДНК и белками и фрагментации цепи ДНК. Циклофосфамид используется в качестве иммунодепрессанта при трансплантации костного мозга и органов. Кроме того, препарат используется для лечения аутоиммунных заболеваний – ревматоидного и псориатического артрита, а также для лечения рака.
Основными побочными эффектами являются лейкопения и тромбоцитопения. Лечение циклофосфамидом может вызвать активизацию вторичных инфекций из-за снижения иммунитета, иногда даже со смертельным исходом.
Азатиоприн – это производное меркаптопурина, обладающее иммунодепрессивным и цитотоксическим действием. Как работает это лекарство, понятно не до конца. Вероятно, оно нарушает синтез ДНК.
Препарат используется для увеличения выживаемости людей с пересадками сердца, почек и печени, а также для снижения доз стероидов у людей, перенесших пересадку почки. Кроме того, азатиоприн используется при лечении язвенного колита и при аутоиммунных заболеваниях, например, ревматоидного артрита.
Наиболее распространенные побочные эффекты препарата – разные виды инфекций, вызванные ослабленной иммунной системой. Кроме того, наблюдается угнетение костного мозга и лейкопения. Людей, которых лечат этим лекарством, не следует вакцинировать живыми вирусными вакцинами.

Цитостатические препараты
Ингибиторы серин / треонинкиназы
Ингибиторы серин-треонин-киназы представляют собой группу препаратов, целью которых является блокирование действия серин-треонинкиназы (mTOR). Задача mTOR-киназы – регулировать рост, пролиферацию, движение клеток и синтез генетического материала в организме.
Сиролимус , также называемый рапамицином, является макролидным антибиотиком со структурой белка. Впервые он был выделен из Streptomyces hygroscopicus из образца почвы с острова Пасхи. Это лекарство работает путем блокирования активации Т-лимфоцитов.
Сиролимус используется для предотвращения отторжения трансплантата, лекарство может использоваться в сочетании с кортикостероидами.
Наиболее распространенные побочные эффекты этого препарата – инфекции мочевыводящих путей, тромбоцитопения, анемия, гиперхолестеринемия и гиперкалиемия.
Эверолимус – синтетическое производное сиролимуса, проявляющее аналогичный эффект. В дополнение к предотвращению отторжения трансплантата, это лекарство используется для лечения нейроцеллюлярных карцином, нейроэндокринных опухолей поджелудочной железы, рака молочной железы и почек.
Это лекарство для предотвращения отторжения трансплантата используется только в сочетании с другим лекарством. Эверолимус оказывает негативное влияние на заживление ран, а также может вызывать диабет. Очень распространены с этим лекарством инфекции с вирусами, бактериями или грибами, особенно в верхних дыхательных путях.
Моноклональные антитела
Моноклональные антитела – генетически сконструированные антитела, проявляющие специфичность только для одного антигена. Моноклональные антитела также используются в онкологии. Зарегистрированный в Европе препарат, принадлежащий к этой группе, – базиликсимаб, который показан для профилактики острого отторжения трансплантатов почки. Лекарства из этой группы предназначены для стационарного лечения.

Моноклональные антитела
Глюкокортикоиды
Глюкокортикостероиды – это стероидные гормоны, используемые в медицине при необходимости противовоспалительного, противоаллергического и иммунодепрессивного действия. Кортикостероиды влияют на организм, изменяя работу многих органов и воздействуя на иммунную систему.
Метилпреднизолон – синтетический глюкокортикостероид с длительным и сильным противовоспалительным и иммунодепрессивным действием. Это лекарство используется в дополнение к иммуносупрессивной терапии после трансплантации органов. Кроме того, этот препарат применяется при эндокринных заболеваниях, кожных заболеваниях и заболеваниях костно-суставной системы.
Препарат может увеличить риск желудочно-кишечных кровотечений, снизить толерантность к глюкозе и может увеличить риск инфекции.
Преднизон – превращает в активную форму в организме преднизолон. Этот препарат работает путем ингибирования пролиферации цитотоксических Т-лимфоцитов, он используется для предотвращения отторжения трансплантата, а также показан при лечении эндокринных расстройств, ревматических заболеваний и при паллиативном лечении больных раком.
Наиболее распространенные побочные эффекты – задержка воды и натрия, гиперкалиемический ацидоз и застойная болезнь сердца.
Другие иммунодепрессанты
Микофенолат мофетил и мофетил натрия – Т- и В – лимфоцит цитостатические препараты. Эти препараты быстро и почти полностью всасываются после перорального введения. Соли микофеноловой кислоты используются в профилактике острого отторжения трансплантата в сочетании с циклоспорином и глюкокортикоидами.
Эти препараты очень часто вызывают сепсис, желудочно-кишечный кандидоз и инфекцию мочевыводящих путей.
Как убить Т-супрессоры для достижения результата иммунотерапии
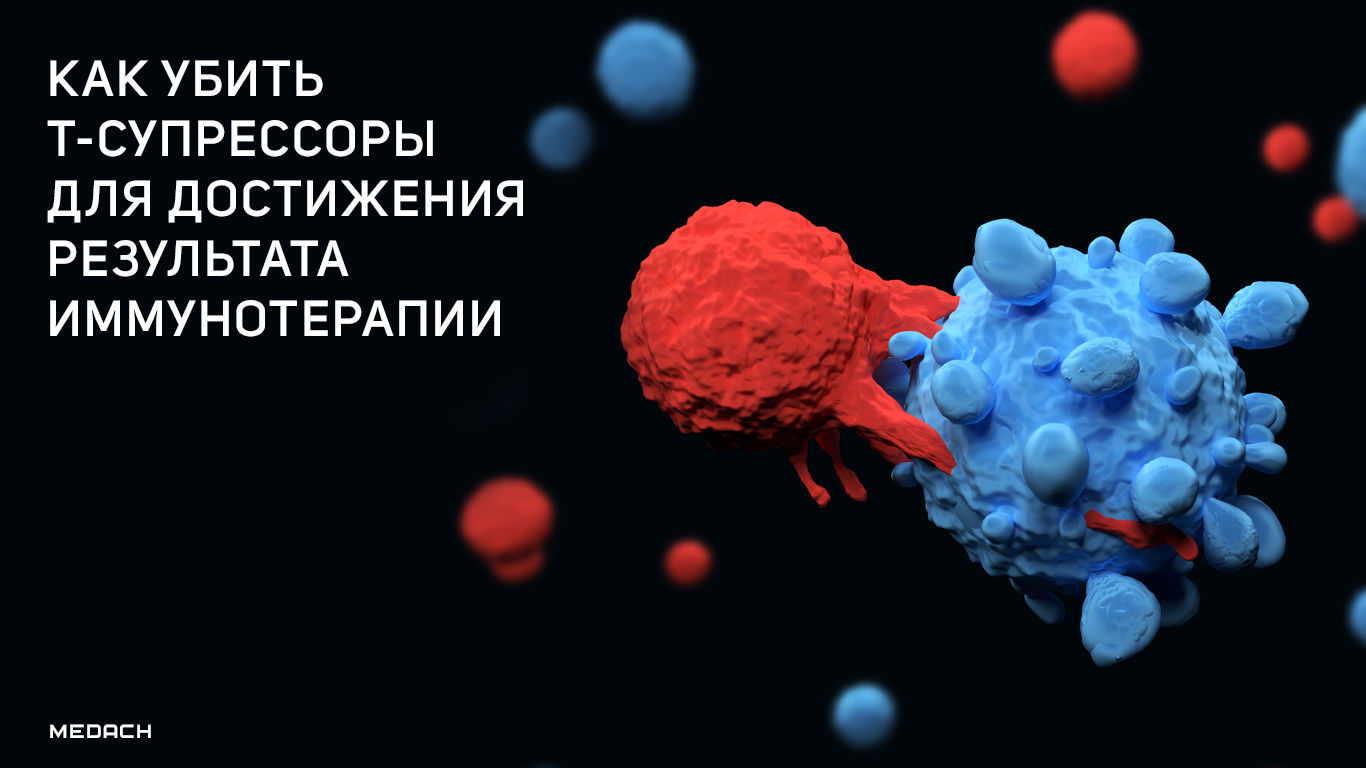
Долгое время одной из труднодостижимых целей иммунотерапии было достижение истощения функциональных возможностей Т-супрессоров при сохранении должной активности органоспецифичных эффекторных Т-клеток. Новое исследование, в котором описана разработка антител к цитокиновому рецептору CD25, модифицированных для того, чтобы истощить пул Т-супрессоров без блокады связывания цитокина ИЛ-2, оживляет интерес к этому терапевтическому направлению.
Регуляторные Т-клетки (Т-супрессоры), представляющие собой CD4+ Т-клетки с высокой экспрессией α-цепи цитокинового рецептора ИЛ-2 CD25 [1], сдерживают распространение воспаления для предотвращения аутоиммунного ответа, а также могут подавлять жизненно важные провоспалительные реакции. Однократная инъекция PC61 [моноклональное микроантитело к мышиному CD25, полученное из мышиных IgG1 — прим. перев.] мышам с опухолями приводит к истощению периферических CD25+ клеток и усиливает киллинг опухолевых клеток. Это подтверждает роль проонкогенного воздействия Т-супрессоров при раке [2, 3]. После этого открытия высокое соотношение T-супрессоров и эффекторных T-клеток (T-эффекторов) в опухолевом микроокружении (ОМО) стало расцениваться как признак плохого онкологического прогноза [4]. Следовательно, предполагается, что истощение пула T-супрессоров в ОМО человека сдвигает иммунологический баланс в провоспалительную сторону и состояние антиопухолевой защиты. К сожалению, не существует уникального поверхностного мембранного маркера, который помогал бы отличать Т-супрессоры от Т-эффекторов и, как следствие, позволял бы избирательно истощать пул клеток T-супрессоров. Однако CD25 постоянно экспрессируется в высокой степени в Т-супрессорах, но только время от времени и в более низких значениях — в T-эффекторах, что может предоставить терапевтическое окно для таргетного воздействия антител на эти молекулы, что позволит устранять Т-супрессоры, а не Т-эффекторы, внутри опухолевой ткани. В этом выпуске «Nature Cancer» Quezada с соавт. описывают антитела, которые связывают CD25, но не блокируют провоспалительную сигнализацию посредством IL-2, что улучшает функцию Т-эффекторов в контексте истощения Т-супрессоров [5].
В первых клинических испытаниях, посвященных таргетному воздействию на CD25 для достижения избирательного истощения T-супрессоров, использовались гуманизированные моноклональные антитела к CD25 (препарат даклизумаб, ранее одобренный Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США; первоначально был разработан для ослабления иммунного ответа, вызванного реакцией отторжения аллотрансплантата) [6, 7]. Хотя кажется удивительным, что лекарство, изначально разработанное для блокирования Т-эффекторов, могло быть модифицировано для прицельного воздействия преимущественно на T-супрессоры и сохранения функционала Т-эффекторов, но благодаря механизму, лежащему в основе функционирования даклизумаба, эта концепция правдоподобна. В то время как функция Т-эффекторов усиливается за счет сигнализации с помощью IL-2, Т-супрессорам этот сигнал жизненно необходим для поддержания своего супрессивного фенотипа [8]. Поскольку механизм действия даклизумаба связан с блокадой связывания IL-2 с его рецептором, было высказано предположение, что T-супрессоры, которых больше в ОМО и которые характеризуются более высокой экспрессией CD25, испытают заметно более выраженное воздействие, чем Т-эффекторы при приеме этого лекарства. Действительно, в ходе клинических испытаний было выявлено значимое, но не полное истощение пула Т-супрессоров и усиление реакции на противораковую вакцину при своевременном введении даклизумаба, но, увы, эффекта на размеры или прогрессирование опухоли это не возымело, вследствие чего дальнейшее развитие этой концепции было приостановлено [7].
Quezada с соавт. использовали «целостный» подход для переосмысления возможностей терапии антителами к CD25 (анти-CD25-антитела), возвращая надежду на то, что эта стратегия все еще может быть использована в иммунотерапии [5]. В своей предыдущей работе эта группа исследователей обнаружила, что вариант PC61 с замененным Fc-фрагментом способствовал антителозависимой клеточной цитотоксичности T-супрессоров в ОМО и синергично действовал вместе с иммунотерапией, направленной против рецептора PD-1 (мембранный рецептор, ингибирующий иммунный ответ), для отторжения сформировавшихся опухолей мыши [9]. Основное внимание здесь уделено вариабельному домену антитела; авторами впервые было продемонстрировано, что PC61 одинаково блокирует интерлейкиновую [ИЛ-2] сигнализацию в инфильтрирующих опухоль T-эффекторах и T-супрессорах, что приводит к безудержному росту опухоли на моделях мышей. Напротив, введение этим мышам анти-CD25-антител, не блокирующих ИЛ-2-путь сигнализации (в качестве монотерапии) с замененным Fc-фрагментом (анти-CD25NIB-антитела) значительно предотвращало опухолевый рост, обеспечивая истощение T-супрессоров при сохранении экспрессии цитолитического гранзима B Т-эффекторами. Эти результаты предполагают, что блокада ИЛ-2-сигнализации Т-эффекторам, расположенным внутри опухоли, может объяснять отсутствие эффекта, наблюдаемого при применении даклизумаба (см. рис. 1).
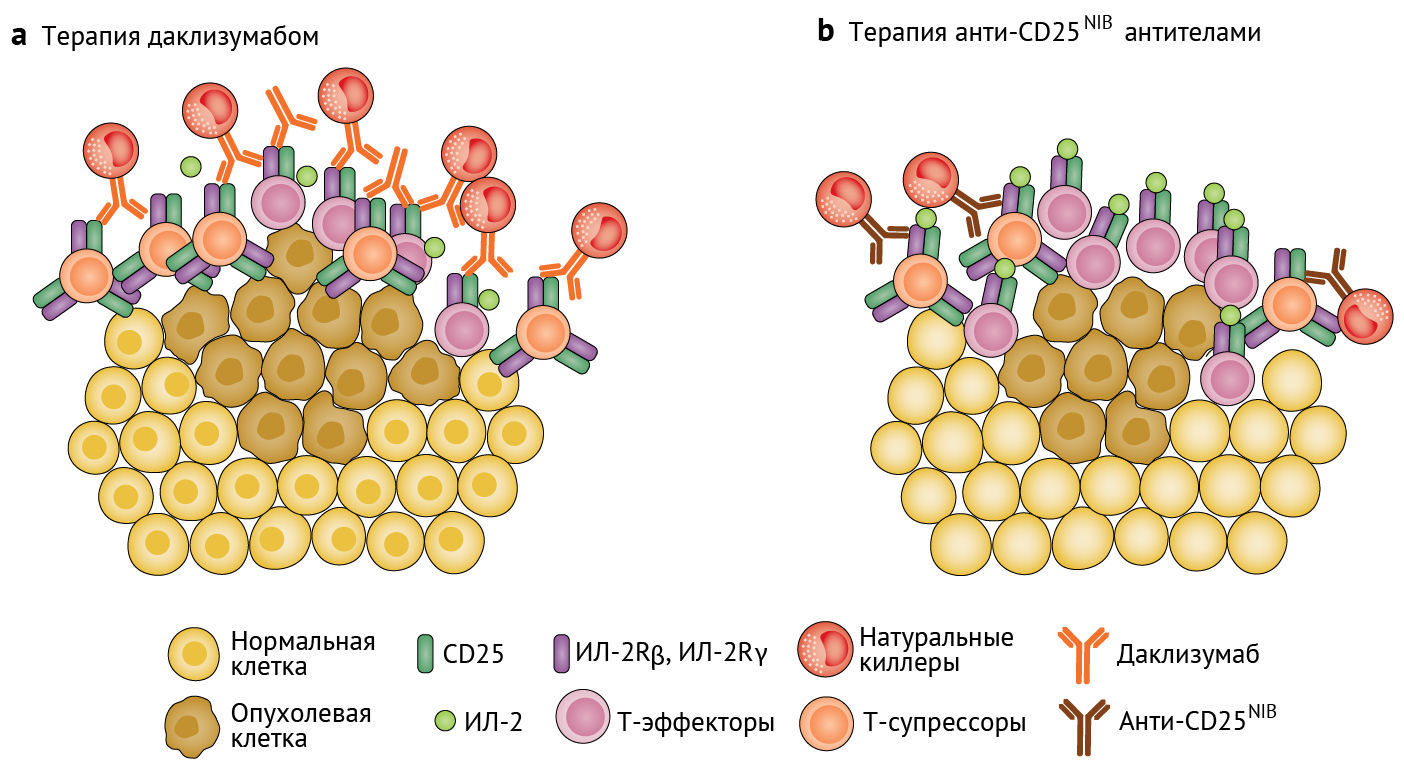
Рисунок 1 | Анти-CD25NIB-антитела приводят к истощению Т-супрессоров организма, усиливая киллинг опухолевых клеток
а — Связывание даклизумаба с CD25 на поверхности ЛИО блокирует сигнализацию посредством ИЛ-2, что приводит к перепрограммированию CD45RA-T-супрессоров в более провоспалительный фенотип, а также снижению функции Т-эффекторов. Взаимодействие Fc-области даклизумаба с ингибирующими Fc-рецепторами на NK-клетках приводит к субоптимальному истощению T-супрессоров.
b — Anti-CD25NIB-антитела допускают ИЛ-2-сигнализацию, обеспечивая активацию Т-эффекторов и элиминацию опухоли. Афукозилированный Fc-домен иммуноглобулина IgG2a максимально истощает Т-супрессоры с фенотипом CD25hi, сохраняя при этом T-эффекторы с фенотипом CD8+ CD25lo, способные убивать опухоль.Хотя усиление иммунологически «горячих» опухолей, обладающих устойчивой инфильтрацией иммунокомпетентными клетками, с помощью иммунотерапии было результативным, лечение «холодных» опухолей, лишенных резидентного иммунного ответа, оставалось особой проблемой и иногда требовало применения нескольких лекарственных средств. Комбинированная терапия блокады иммунологической контрольной точки антителами к иммуномодулирующему рецептору CTLA-4 вместе с вакциной из облученных опухолевых клеток, секретирующих цитокин GM-CSF (GVAX), предотвращала опухолевый рост в модели «холодной» меланомы B16, тогда как монотерапия эффекта не давала [10]. Сходным образом Quezada с соавт. показывают, что анти-CD25NIB-антитела вместе GVAX вызывают регрессию опухолей B16 и повышают выживаемость [5]. Метод мультипараметрической проточной цитометрии лимфоцитов, инфильтрирующих опухоль (ЛИО), после комбинированной терапии показывает истощение T-супрессоров и активацию CD25hi CD4+ T-клеток, в то время как CD25lo CD8+ T-эффекторы, которые важны для киллинга опухолевых клеток, сохраняются. Хотя это важное открытие, необходимо выяснить, оказывает ли в этой модели эффект комбинация PC61 с GVAX. Это важно для уточнения того, в блокаде ли ИЛ-2-сигнализации заключается разница в терапевтическом воздействии PC61 и анти-CD25NIB-антител. Кроме того, было показано, что блокирование CD25 даклизумабом ведет к функциональной перестройке нестабильных CD45RA-Т-супрессоров (но не CD45RA+ T-супрессоров) в клетки с более выраженным провоспалительным фенотипом [7]. Однако пока не ясно, оказывают ли анти-CD25NIB-антитела аналогичный механистический эффект, так как CD4RA не проверялись в эксперименте (не включались в проточную панель цитометрии). Исследования, посвященные транскриптомике ЛИО в отдельно взятой клетке, могли бы решить эту проблему, а также теоретически идентифицировать гены, которые придают большую устойчивость и сохранение функционала ЛИО при воздействии анти-CD25NIB-антител. Это может служить вектором развития будущих разработок препаратов и биомаркеров для диагностики.
Чтобы адаптировать свои выводы к потенциальному клиническому исследованию, Quezada с соавт. провели скрининг среди антител по признаку их способности связывать человеческий CD25 и индуцировать антителозависимую клеточную цитотоксичность без нарушения ИЛ-2-сигнализации. В ходе этого «отбора кандидатов» было выявлено соединение, которое имело сродство к CD25, сходное с даклизумабом, и сохранявшее ИЛ-2-сигнализацию, взаимодействуя с ИЛ-2 в ином участке связывания. Человеческие анти-CD25NIB-антитела истощают пул T-супрессоров (но не CD8+ Т-клеток) в опухолях легких и колоректальной зоне человека. Аналогичные эффекты наблюдались у мышей, которым были привиты гетеротопные трансплантаты опухолей поджелудочной железы человека.
К сожалению, природа терапевтических эффектов моноклональных антител подразумевает не локальное, а глобальное воздействие. Поскольку врожденная нехватка T-супрессоров приводит к безудержной лимфопролиферации и иммунопатологиям, истощение их пула у взрослого может увеличить риск аутоиммунных реакций. Фактически, даклизумаб уменьшает системное содержание T-супрессоров у пациентов, а токсические эффекты, связанные с воздействием этого препарата и другими способами провоспалительной иммунотерапии, включают воспалительные процессы дерматологической локализации, желудочно-кишечного тракта, легочной ткани, артрит и в редких случаях диабет первого типа. Мышиные модели не могут служить полноценным отражением размера организма, степени патогенной нагрузки или характеристик биологии T-супрессоров у человека. Кроме того, каждое антитело, применяемое с терапевтической целью, обладает собственной аффинностью, иммуногенностью и способностью связываться не только со своей мишенью. Все это не всегда можно смоделировать в аналогичной молекуле лекарственного средства. Таким образом, масштабные исследования иммунотерапии на животных представляют собой важный пункт на пути к клиническим испытаниям на людях. Наряду с выявлением потенциально серьезных побочных эффектов, вызванных иммунотерапией, с помощью исследований на животных в перспективе можно сформировать критерии противопоказаний для испытаний на людях и обеспечить высокую осведомленность среди возможных участников испытаний о потенциально переносимых побочных эффектах. Таким образом, Quezada и его коллеги лечат здоровых яванских макак с помощью анти-CD25NIB-антител, истощающих периферический пул T-супрессоров обезьян без большой токсичности для животных [5]. Хотя авторами и отмечено некоторое воспаление на поверхности слизистой оболочки, соответствующее нарушенному балансу между иммунной системой и комменсальной микробиотой, этот эффект проявлялся только при дозах, превышающих физиологические, и оказывался обратимым. Данные свидетельства открывают путь к испытаниям на людях. Однако оптимизм в отношении этого метода иммунотерапии должен быть осторожным: введение человеку в ходе клинических испытаний незначительного количества суперагонистических антител к корецептору CD28, также хорошо переносимых у негоминидных приматов, приводило к серьезным токсическим эффектам [11].
Чтобы улучшить доставку препарата к месту воздействия, будущие разработки могут включать анти-CD25NIB, посылаемые Т-клетками, генетически запрограммированными на экспрессию антиген-специфических Т-клеточных рецепторов и химерных антигенных рецепторов (ХАР). T-супрессоры внутри опухолевой ткани представляют препятствие для воздействия на солидную опухоль [12]. Так как «вооруженные» ХАР Т-клетки изначально разрабатывались для обнаружения или выделения связывающих частей PD-1, чтобы ограничить иммуностимулирующее воздействие [13], эта же технология может быть адаптирована и для анти-CD25NIB. Генная инженерия молекулярных циклов может дополнительно ограничить секрецию антител на клетки, нацеленные на T-супрессоры, что будет способствовать локальному воздействию препарата.
Впечатляющие эффекты анти-CD25NIB на противоопухолевый иммунитет, о которых сообщается в данной работе, вызовут новый интерес к методу элиминации T-супрессоров в ОМО. Клинические испытания даклизумаба, проведенные ранее, могут быть пересмотрены. Теперь можно применить сочетание вакцины, разработанной на основе дендритных клеток, и антител, не блокирующих ИЛ-2-сигнализацию (описанные выше). Эта комбинация может стимулировать развитие опухолевых антиген-специфичных ЛИО, не способствующих патологическому воздействию Т-супрессоров на аутоиммунитет. Обнаружение терапевтического окна станет способом уравновесить местное истощение T-супрессоров для обеспечения противоопухолевого ответа, а также поддержания системной толерантности к препарату и гомеостазу иммунной системы. Более того, необходимо соблюдать осторожность при определении правильной дозировки, так как если будут достигнуты уровни насыщения антителами, воздействие T-эффекторов также может быть устранено, что нивелирует преимущество описываемого метода перед даклизумабом. Как и в случаях со всеми лекарственными препаратами, только тщательные, хорошо контролируемые и спланированные клинические испытания на людях окончательно определят, могут ли анти-CD25NIB-антитела претендовать на место эффективного метода иммунотерапии. Тем не менее, открытия Quezada с соавт. поднимут интерес к возможностям этой иммуномодуляционной стратегии для ряда опухолей.
Иммунокоррекция и принципы ее применения
Г лавная функция иммунной системы заключается в устранении чужеродных аллергенов. Для этого она обладает сложнейшим набором постоянно взаимодействующих неспецифических и специфических механизмов. Неспецифические механизмы относятся к врожденным, а специфические приобретаются в процессе «иммунологического обучения».
Неспецифический (врожденный) иммунитет
Главные клеточные компоненты неспецифического иммунитета – фагоциты, основная функция которых – захватывать и переваривать проникающие извне микроорганизмы. Фагоциты подразделяются на нейтрофилы, моноциты (в крови) и макрофаги (в тканях). Макрофаги занимают в организме стратегически важные позиции, располагаясь между паренхимой того или иного органа и клетками, выстилающими изнутри кровеносные сосуды и полости. Таковы, например, альвеолярные макрофаги (в легких), купферовы клетки (в синусах печени), синовиальные клетки (в суставных полостях), мезангиальные фагоциты (в почках) и другие. К врожденному иммунитету относятся: белки комплемента (главные растворимые компоненты системы врожденного иммунитета), а также белки острой фазы и цитокины. Цитокины – полипептиды, секретируемые моноцитами и лимфоцитами при их взаимодействии со специфическими и неспецифическими антигенами, с иными неспецифическими стимуляторами.
Специфический иммунитет приобретается в результате контакта организма с антигеном или пассивной иммунизации, имеет приспособительное значение и характеризуется формированием иммунологической памяти. Его клеточными носителями служат лимфоциты, а растворимыми – иммуноглобулины.
Лимфоциты подразделяются на три подгруппы: 1) тимусного происхождения (Т–клетки, которые, в свою очередь, подразделяются на Т–хелперы, Т–супрессоры и Т–киллеры); 2) костномозгового происхождения (В–клетки – продуценты иммуноглобулинов); 3) нулевые лимфоциты («ни Т ни В»), к которым относятся часть киллеров (натуральные киллеры (НК)) и некоторые другие мононуклеарные клетки. Лимфоциты представлены различными клонами, и каждый клон специализирован для распознавания определенного антигена с помощью специфических рецепторов.
Заболеваний иммунной системы подразделяются на 3 основные группы:
1) иммунодефицитные состояния,
2) аллергические заболевания,
3) аутоиммунные процессы.
Иммунодефицитные состояния, в свою очередь, подразделяются на первичные (генетически обусловленные дефекты Т– или В–лимфоцитов, фагоцитирующих клеток, комплемента) и вторичные (недостаточность иммунной системы, возникшая как следствие какого–то заболевания у ранее здорового человека).
Как показывает практика, наиболее распространенными являются именно вторичные иммунодефицитные состояния, способствующие возникновению и осложняющие течение практически любого часто возникающего и/или хронического заболевания, что объясняет регулярное назначение врачами общей практики иммуномоделирующих препаратов.
Существует несколько классификаций иммунотропных препаратов, одна из них принадлежит Марковой Т.П.
Классификация иммунотропных
препаратов (Маркова Т.П.)
I. Препараты бактериального происхождения:
– лизаты микроорганизмов: бронхо–мунал, рибомунил, ВП–4 (вакцина поликомпонентная), биостим, ИРС–19, имудон, солкоуровак, рузам, Флонивин–БС, сальмозан, продигиозан, пирогенал;
– синтетические препараты (ликопид).
II. Препараты растительного происхождения – элеутеракокк, китайский лимонник, жень–шень, боярышник, левзея, Иммунал.
III. Мед и продукты пчеловодства – прополис, маточное молочко.
IV. Гормоны, цитокины и медиаторы.
1. Препараты тимуса:
– природного происхождения (тактивин,тималин, тимотропин);
– синтетические препараты (тимоген, имунофан).
2. Препараты костного мозга:
– природного происхождения (миелопид);
– синтетические препараты (серамил).
3. Интерфероны:
– природного происхождения (интерферон лейкоцитарный, лейкинферон);
– рекомбинантные препараты (реальдерон, реаферон, интрон А, виферон).
4. Индукторы выработки интерферона:
– природного происхождения – саврац, кагасин, мегасин, кагоцел, гозалидон, ридостин, ларифан;
– синтетические препараты – циклоферон, амиксин, полудан, полигуацил, амплиген.
5. Интерлейкины (беталейкин, ронколейкин).
6. Моноцито–гранулоцито–макрофагальные колониестимулирующие факторы – лейкомакс, граноцит, нейпоген, лейкоцитарный трансфер–фактор.
7. Фактор некроза опухоли.
V. Производные полиэтиленпиперазина – полиоксидоний.
VI. Препараты, содержащие нуклеиновые кислоты:
– природного происхождения: нуклеинат натрия, зимозан;
– синтетические препараты: метилурацил, пентоксил.
VII. Сульфонопиримидиновые производные – диуцифон.
VIII. Производные имидазола – левамизол.
IX. Производные аминофталгидразида – галавит.
X. Иммуноглобулины:
• иммуноглобулин человека нормальный;
• иммуноглобулин человека донорский;
• иммуноглобулин человека для в/в введения: актогамм, цитотект, интраглобин;
• иммуноглобулин противоаллергический.
XI. Моноклональные антитела:
• антитела против IgE (omalizumab);
• антитела к фактору некроза опухоли – альфа (infliximab).
XII. Иммунодепрессанты – циклоспорин, антилимфоцитарный глобулин, тимодепрессин.
Назначение препаратов химической или биологической природы, обладающих иммунотропной активностью с лечебной или профилактической целью при заболеваниях, связанных с нарушениями иммунитета, называется иммунотерапией, а сами препараты можно разделить на четыре большие группы [1]:
• иммуномодуляторы;
• иммунокорректоры;
• иммуностимуляторы;
• иммунодепрессанты.
Иммуномодуляторы – лекарственные средства, обладающие иммунотропной активностью, которые в терапевтических дозах восстанавливают функции иммунной системы (эффективную иммунную защиту).
Иммунокорректоры – средства и воздействия (в том числе и лекарственные), обладающие иммунотропностью, которые нормализуют конкретное нарушенное то или иное звено иммунной системы (компоненты или субкомпоненты Т–клеточного иммунитета, В–клеточного иммунитета, фагоцитоза, комплемента). Таким образом, иммунокорректоры – это иммуномодуляторы «точечного» действия.
Иммуностимуляторы – средства, усиливающие иммунный ответ (лекарственные препараты, пищевые добавки, адъюванты и другие различные агенты биологической или химической природы, стимулирующие иммунные процессы).
Иммунодепрессанты – средства, подавляющие иммунный ответ (лекарственные препараты, обладающие иммунотропностью или препараты неспецифического действия и другие различные агенты биологической или химической природы, угнетающие иммунные процессы). Наиболее часто применяются в случае аллергических и аутоиммунных процессов.
Главной мишенью применения иммуномодулирующих препаратов являются вторичные иммунодефициты, которые проявляются в частных, рецидивирующих, трудно поддающихся лечению инфекционно–воспалительных заболеваниях различных локализаций. В основе любого хронического инфекционно–воспалительного процесса лежат те или иные изменения в иммунной системе, которые и являются одной из причин существования этого процесса.
Прежде, чем назначать какую–либо иммунотерапию рекомендовано исследование иммунного статуса пациента с целью выявления иммунной дисфункции (структурных и/или функциональных изменений). Лабораторное иммунологическое обследование должно включать [2]:
– определение состояния гуморального звена по уровню продукции иммуноглобулинов классов А, М, G, Е, содержанию CD72+ или CD19+ лимфоцитов, циркулирующих иммунных комплексов;
– оценку Т–клеточного звена с определением основных субпопуляций лимфоцитов, иммунорегуляторного индекса;
– исследование интерферонового статуса с определением уровня сывороточного интерферона, спонтанной продукции интерферона и т.д.; желательна оценка ответа лейкоцитов на медикаментозные стимулы продукция интерферона под действием индукторов его синтеза;
– состояние системы фагоцитов по поглотительной способности нейтрофилов, спонтанной и стимулированной люминолзависимой хемилюминесценции;
– при возможности, контроль за уровнем основных провоспалительных цитокинов (ИЛ1, ФНО, ИЛ4, ИЛ6, и др.).
Однако исследование параметров иммунной системы не всегда может выявить эти изменения. Поэтому при наличии в организме хронического инфекционно–воспалительного процесса или в случае частой подверженности простудным заболеваниям можно назначать больному иммуномодулирующие препараты даже в том случае, если иммунодиагностическое исследование не выявит существенных отклонений в иммунном статусе [3].
Кроме того, исследование иммунологического статуса пациента по разным причинам проводится довольно редко. Вот почему назначение иммуномодулирующей терапии для обеспечения более быстрого выздоровления и/или достижения более длительной ремиссии основного заболевания пациента происходит эмпирически. В этом случае чаще других рекомендуются неспецифические стимуляторы систем противоинфекционной защиты, а именно – препараты растительного происхождения. Достоинства этой группы препаратов – их доступность, безопасность (они относятся к безрецептурным препаратам).
Среди них наибольшей популярностью пользуются препараты эхинацеи (Echinacea purpurea, Echinacea angustifolia, Echinacеa pallida) [4]. Родина этого многолетнего растения из семейства астровых – Северная Америка. С давних времен индейцы использовали эхинацею в лечении инфекционных заболеваний. В медицине чаще применяют Е. рurpurea.
По данным литературы, выделены основные группы биологически активных веществ эхинацеи пурпурной [5]:
Алкамиды. У этой группы биологически активных веществ выявлено [5, 6] стимулирующее действие на фагоцитарную активность гранулоцитов, а также противовоспалительное действие за счет ингибирования продукции эйкозаноидов.
Арабиногалактоны. В данной группе веществ обнаружен интерферониндуцирующий эффект.
Глюкопротеиды. Обнаружено их слабое пролиферативное действие на В–лимфоциты.
Официальным препаратом, представленным на современном фармацевтическом рынке, содержащим экстракт E. рurpurea, является Иммунал, выпускаемый фармацевтической компанией Lek. Следует отметить, что в изготовлении Иммунала используется свежевыжатый сок цветущего растения, а не настойка, не экстракт, поэтому Иммунал обеспечивает более полный состав и высокое содержание активных веществ. Кроме того, входящие в состав Иммунала полисахариды стимулируют костномозговое кроветворение, способствуя повышению количества гранулоцитов в периферической крови, а также активизируют фагоцитарные системы организма.
Иммунал прошел ряд клинических исследований (в том числе в НИИ Иммунологии [5]), доказывающих его эффективность в качестве средства, уменьшающего заболеваемость острыми респираторными вирусными инфекциями. Рядом других исследователей доказана его эффективность в отношении гриппа [4]. Иммунал также рекомендован не только в целях профилактики. Прием препарата в период заболевания уменьшает его длительность и тяжесть течения.
Особый интерес представляет прием Иммунала в педиатрической практике. Иммунал является единственным препаратом на основе эхинацеи, эффективность и безопасность которого доказана клиническими исследованиями, проведенными в НИИ гриппа РАМН, и разрешенным к применению у детей, начиная с 1 года.
Таким образом, Иммунал является эффективным и безопасным иммуностимулирующим препаратом.
В заключение следует напомнить некоторые общие принципы применения иммуномодуляторов у больных с недостаточностью антиинфекционной защиты [3]:
1. Иммуномодуляторы назначают в комплексной терапии одновременно с антибиотиками, противогрибковыми, противопротозойными или противовирусными средствами.
2. Целесообразным является раннее назначение иммуномодуляторов, с первого дня применения химиотерапевтического этиотропного средства.
3. Иммуномодуляторы, действующие на фагоцитарное звено иммунитета, можно назначать больным как с выявленными, так и с невыявленными нарушениями иммунного статуса, т.е. основанием для назначения препарата является клиническая картина заболевания.
4. При наличии в данном лечебно–профилактическом учреждении соответствующей материально–технической базы применение иммуномодуляторов целесообразно проводить на фоне иммунологического мониторинга. Этот мониторинг следует проводить вне зависимости от того, выявлены какие–либо исходные изменения в иммунной системе или нет.
5. Иммуномодуляторы можно применять при проведении иммунореабилитационных мероприятий в виде монотерапии (в частности, при неполном выздоровлении после перенесенного острого инфекционного заболевания).
6. Наличие понижения какого–либо параметра иммунитета, выявленного при иммунодиагностическом исследовании у практически здорового человека, не обязательно является основанием для назначения ему иммуномодулирующей терапии. Такие люди должны находиться на учете в соответствующем лечебно–профилактическом учреждении и составлять группу наблюдения по иммунному статусу.
Применяя иммунотропные препараты, необходимо иметь в виду, что среди их кажущегося многообразия всего лишь для относительно небольшого числа доказано иммуномодулирующее свойство, то есть способность в терапевтических дозах восстанавливать функцию иммунной системы, осуществлять эффективную иммунную защиту [3].Литература
1. Хаитов Р.М., Пинегин Б.В. Иммуномодуляторы и некоторые аспекты их клинического применения. //Клиническая медицина, 1996, т. 74, N8, 7–12.
2. Дидковский Н.А., Малашенкова И.К. Принципы иммунокорригирующей терапии вторичных иммунодефицитов, ассоциированных с хронической вирусно–бактериальной инфекцией //РМЖ, 2002, т.10, №21.
3. Хаитов Р.М., Пинегин Б.В. Основные принципы иммуномодулирующей терапиии //Аллергия, астма и клиническая иммунология, 2001.
4. Маркова Т.П.. Растительный иммуностимулирующий препарат – Иммунал. Перспективы применения в медицине //РМЖ, 2002, т.10, №28.
5. Царев С.В. Эффективность Иммунала как неспецифического иммуностимулятора //РМЖ, 2003, т. 11, №16.
6. Stotzem C.D., Hungerland U. Medical Science Research. – 1992. – 20. – 719–720. – Part 4, page 335–336.Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.