Что такое супрессия иммунитета
5.6. МЕХАНИЗМЫ СУПРЕССИИ ИММУННОГО ОТВЕТА
До недавнего момента казалось очевидным, что супрессирующая функция в иммунной системе обеспечивается одной субпопуляцией Т-лимфоцитов-супрессоров. В настоящее время указанная субпопуляция не идентифициро-вана, однако все большее количество фактов указывает на то, что супрессия иммунного ответа является многокомпонентным процессом.
Какие же механизмы супрессии иммунного ответа очевидны?
Прежде всего важная роль в подавлении специфических иммуно-логических механизмов защиты может быть отведена субпопуляции Тh3, ко-торая продуцирует трансформирующий фактор роста (TGF В). Последний останавливает пролиферацию антигенстимулированных лимфоцитов и про-дукцию ими провоспалительных лимфокинов.
-интерферон, продуцируемый Тh1, супрессирует дифференцировку Тh2, эффекторные реакции эозинофилов, тормозит функцию IgE-проду-цирующих клеток и обеспечивает снижение титра IgE.
Определенная супрессорная функция может быть отведена и ИЛ-10, про-дуцируемому Тh3 и Тh4.
ИЛ-10 может продуцироваться также макрофагами, В-лимфоцитами, ке-ратиноцитами. ИЛ-10 является ингибитором синтеза цитокинов макрофага-ми, подавляет образование -интерферона, ИЛ-2, ИЛ-3, ФНО, гранулоцитар-ного и макрофагального колониестимулирующего факторов.
Важная роль в супрессии иммунного ответа на фоне массивной антиген-ной стимуляции бактериально-токсическими факторами отводится гипотала-мо-гипофизарно-надпочечниковой системе.
Динамика взаимодействия различных цитокинов и гормональных факто-ров в иммунном ответе при инфекционном стрессе может быть представлена следующим образом.
Антигенстимулированный макрофаг продуцирует ИЛ-1, ИЛ-6, ФНО, во-влекает в процессы дифференцировки Тh1, секретирующие ИЛ-2, ФНО, -интерферон, лимфотоксин.
В свою очередь, ИЛ-1, ИЛ-6, ФНО с кровотоком достигают гипо-таламических структур, связываются со специфическими рецепторами и стимулируют продукцию кортикотропинреализующего фактора (CRF). По-следний, как известно, усиливает секрецию АКТГ гипофизом с последую-щим усилением освобождения глюкокортикоидов надпочечниками.
Глюкокортикоиды снижают продукцию многих провоспалительных цито-кинов в клетках мононуклеарной фагоцитирующей системы и в лимфоидной ткани, подавляют активность Тh1 и продукцию ими ИЛ-2, -интерферона, стимулируют апоптоз тимоцитов и периферических антигенстимулирован-ных лимфоцитов. Снижение продукции -интерферона приводит к подавле-нию макрофагальной реакции.
Защитный характер иммуносупрессии, обеспечиваемый глюкокор-тикоидами, заключается еще и в том, что беспредельная активация продук-ции цитокинов при септической инфекции может явиться одним из факторов развития бактериально-токсического шока и гибели организма.
Индуцируемый различными факторами, в том числе и глюкокор-тикоидами, апоптоз является генетически запрограммированной гибелью лимфоцитов, связавших антиген вне связи с МНС или другими необходимы-ми сигналами. Морфологически апоптоз проявляется постепенной фрагмен-тацией ДНК, ядра, цитоплазматических структур, которые остаются окру-женными цитоплазматической мембраной, не поступают в межклеточное пространство и, соответственно, не индуцируют развитие воспаления.

29-30 апреля 2022 года в Москве прошел традиционный Московский международный салон образования

28 апреля 2022 г. в историческом высотном здании Москвы на Садовой-Спасской 21/1 состоялись НАУЧНЫЕ ФОРУМЫ И ВЕСЕННЯЯ СЕССИЯ РАЕ
29-30 апреля 2022 г. на платформе МОСКОВСКОГО САЛОНА ОБРАЗОВАНИЯ в рамках международной научной конференции «АКТУАЛЬНЫЕ ПРОБЛЕМЫ НАУКИ И ОБРАЗОВАНИЯ» для педагогов высших учебных заведений, профессоров, научных сотрудников состоялась панельная дискуссия «Наука и образование в современной России»

25 -27 апреля 2022 г. в Москве (ГК Измайлово) состоялись очное заседание XV международного конкурса научно-исследовательских и творческих работ учащихся «СТАРТ В НАУКЕ»
Академия Естествознания приняла участие в Московском Международном Салоне образования-2021
Что такое супрессия иммунитета
Лекарства подавляющие иммунитет (иммунодепрессанты)
Как профилактика отторжения трансплантата, так и лечение аутоиммунных заболеваний требуют подавления иммунных реакций. Однако иммунная супрессия влечет за собой ослабление защитных сил против инфекционных возбудителей и повышение риска развития опухоли в отдаленный период.
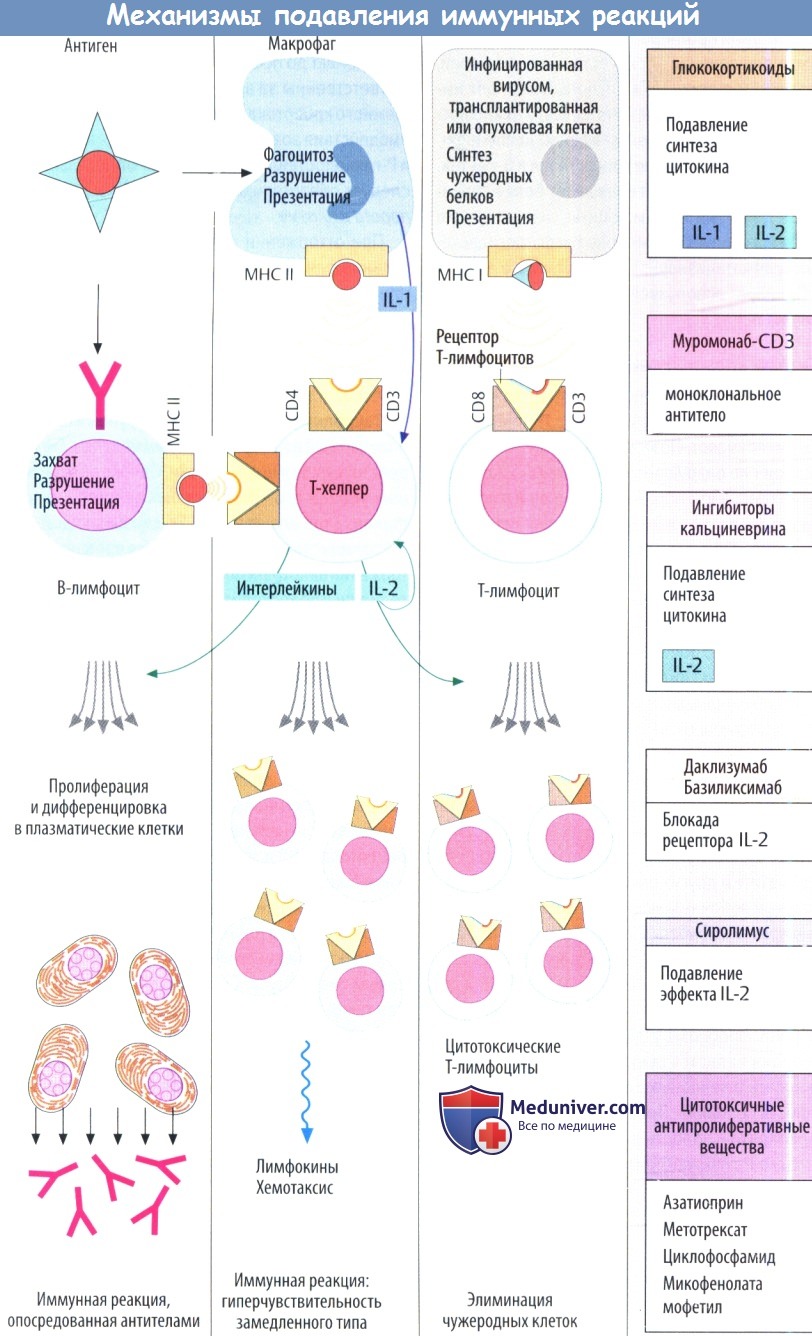
Специфический иммунный ответ начинается со связывания антигена лимфоцитами, несущими рецепторы с соответствующим антигенсвязываю-щим участком. В-лимфоциты распознают структуры поверхностного антигена с помощью мембранных рецепторов, которые похожи на образованные впоследствии антитела. Т-лимфоцитам (и интактным В-клеткам) требуется антиген на поверхности макрофагов или других клеток в сочетании с главным комплексом гистосовместимости (МНС); последний обеспечивает распознавание антигенных структур посредством рецепторов Т-клеток. Т-хелперы несут комплексы CD3 и CD4, цитотоксические Т-клетки — комплекс CD8.
Белки CD участвуют в связывании МНС. Активация Т-клеток также увеличивается при контакте с другими мембранными белками: CD80/86 в случае клетки, несущий антиген, и CD28 на лимфоците. Существует собственный физиологический прерывающий механизм при высвобождении активированными лимфоцитами С028-подобных инертных молекул во внеклеточное пространство; они «покрывают» комплекс CD80/86 и предупреждают контакт с ним и активацию лимфоцитов. Кроме того, распознавание антигена и стимуляция цитокинами играют важную роль в активации лимфоцитов.
Интерлейкин-1 образуется макрофагами, а другие интерлейкины (IL), в т. ч. IL-2, образуются Т-хелперами. При пролиферации антигенспецифических лимфоцитов запускается иммунная защита. I.
I. Воздействие на распознавание антигена. Муромонаб CD3 — моноклональное антитело, направленное против CD3 мышей, которое блокирует распознавание антигена Т-лимфоцитами (используется при отторжении трансплантата).
Глатирамера ацетат состоит из пептидов различной длины, полимеризованных в случайной последовательности из аминокислот глутамина, лизина, аланина и тирозина. Его используют при лечении рассеянного склероза наряду с IFN-β. Данное заболевание является результатом аутоагрессии Т-лимфоцитов направленной против олигодендроцитов, которые образуют миелиновые оболочки аксонов ЦНС.
Причинный антиген, очевидно, является основным миелиновым белком. Глатирамер имеет сходство с последним. Блокируя рецепторы антигена, он нарушает распознавание антигена лимфоцитами.
Абатацепт — слитный белок, состоящий из инертной молекулы лимфоцита CD28 и Fc-фрагмента антитела. Он имитирует физиологическое торможение в результате антигенной стимуляции Т-клеток и применяется при ревматоидном артрите.
II. Подавление продукции цитокина и его действия. Глюкокортикоиды модулируют экспрессию множества генов. В частности, за счет этого эффект; ингибируется продукция IL-1 и IL-2, что объясняет супрессию зависимых от Т-клеток иммунных ответов. Кроме того, глюкокортикоиды нарушают образование воспалительных цитокинов и сигнальных молекул в других мишенях. Глюкокортикоиды используются при пересадке органов, аутоиммунных и аллергических заболеваниях. Системное применение несет в себе риск ятрогенного синдрома Кушинга.
Циклоспорин и родственные соединения ингибируют продукцию цитокинов, в частности IL-2. В отличие от глюкокортикоидов его применение не сопровождается множеством сопутствующих метаболических эффектов.
Анакинра — рекомбинантная форма эндогенного антагониста рецепторов IL-1, применяется при ревматоидном артрите.
Даклизумаб и базиликсимаб являются моноклональными антителами против рецепторов IL-2. Они состоят из Fab-фрагмента мышей и Fc-фрагмента человека. Их используют для подавления реакций отторжения трансплантата.
III. Нарушение метаболизма клетки в результате подавления пролиферации. В дозах ниже, чем требуюгся для лечения злокачественных опухолей, некоторые цитостатики также используются для иммуносупрессии (азатиоприн, метотрексат и циклофосфамид). Антипролиферативный эффект неспецифичен для лимфоцитов и касается как Т-, так и В-клеток.
Микофенолата мофетил оказывает более специфическое действие на лимфоциты, чем на другие клетки. Он ингибирует инозинмонофосфатдегидроге-назу, которая катализирует синтез пуринов в лимфоцитах. Препарат используется при острых реакциях отторжения ткани.
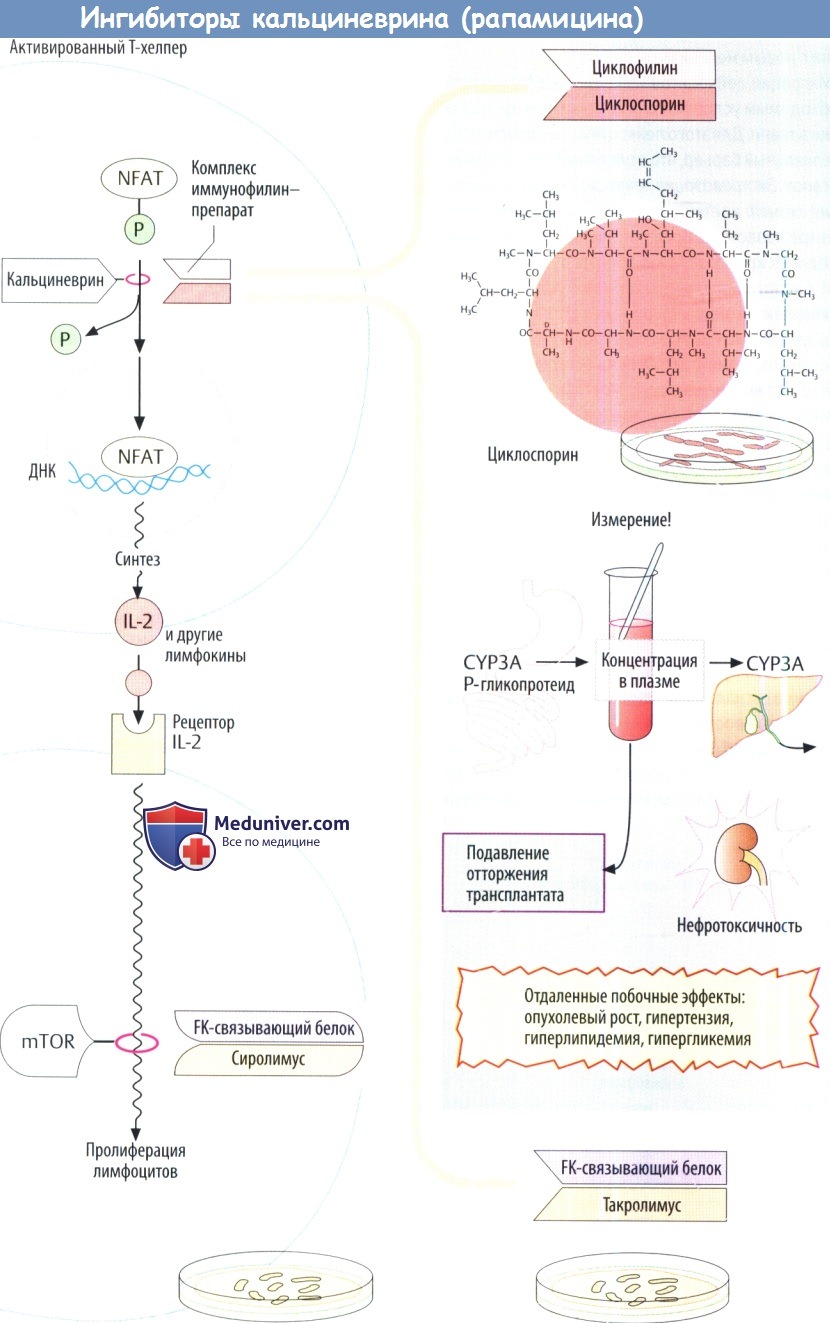
IV. Ингибиторы кальциневрина (сиролимус). Циклоспорин имеет грибковое происхождение. Он является пептидом, состоящим из 11 отчасти атипичных аминокислот. Поэтому при введении внутрь циклоспорин не разрушается желудочно-кишечными протеазами. В клетках Т-хелперов он ингибирует продукцию IL-2 за счет изменения уровня регуляции транскрипции. Обычно ядерный фактор активированных Т-клеток (NFAT) стимулирует экспрессию IL-2. Это требует дефосфорилирования предшественника, фосфорилированного NFAT, с помощью фосфатазы кальциневрина, что обеспечивает поступление NFAT в клеточные ядра из цитозоля.
Циклоспорин связывается с белком циклофилином внутренней среды клетки, а образующийся комплекс ингибирует кальциневрин и, следовательно, продукцию IL-2.
Достижения в современной трансплантологии связаны в основном с введением в практику циклоспорина. В настоящее время он также используется при некоторых аутоиммунных заболеваниях, атопическом дерматите и других расстройствах.
Основным побочным эффектом циклоспорина является нефротоксичность. Поэтому его дозу необходимо титровать таким образом, чтобы уровень препарата в крови не был слишком высоким (риск повреждения почек) и не слишком низким (реакция отторжения). Проблема усложняется еще и тем, что циклоспорин является веществом, которое трудно использовать в лечебных целях. Пероральная био-доступность неполная. Происходит обратный транспорт препарата в полость кишечника посредством выносящего Р-гликопротеидного насоса в дополнение к метаболизму цигохромоксидазами подгрупп 3А.
Печеночные изоферменты CYP3A4 способствует выведению до поступления в системный кровоток и ответственны за выведение циклоспорина из системного кровотока. Различные лекарственные взаимодействия возникают в результате влияния CYP3, и Р-гликопротеида. При подборе оптимальной дозы следует обязательно контролировать уровень препарата в плазме.
При отторжении трансплантата требуется длительное лечение препаратами, вызывающими супрессию. Длительная иммуносупрессия несет в себе повышенный риск развития злокачественных опухолей. Факторами риска сердечно-сосудистых заболеваний могут быть нежелательные реакции — критический и важный момент в отдаленном прогнозе
Такролимус — антибиотик из группы макролидов получаемый из Streptomyces tsukubaensis. По сути oн действует, как и циклоспорин. Однако на молекулярном уровне его «рецептором» является не циклофилин, а так называемый FK-связывающий белок. Такролимус тоже используется для профилактики отторжения аллотрансплантата. По проницаемости эпителия он превосходит циклоспорин, что позволяет применять его местно при атопическом дерматите
Сиролимус (рапамицин) — еще один макролид, продуцируемый Streptomyces hydroscopicus. Иммуносупрессивное действие не связано с ингибированием кальциневрина. Он образует комплекс с FK белком, вызывая особые конформационные изменения, а комплекс далее ингибирует фосфатазу mTOP (мишени рапамицина млекопитающих). Последний управляет сигнальным путем, который начинается рецептором IL-2 и заканчивается активацией митоза в лимфоцитах. Следовательно, сиролимус ингибирует пролиферацию лимфоцитов. Препарат одобрен для профилактики отторжения трансплантата.
Структура и действие эверолимуса аналогичны таковым сиролимуса. Сиролимус также используется для покрытия стентов, которые установлены в атеросклеротических коронарных артериях для сохранения просвета сосудов после баллонной дилатации. Сиролимус предназначен для остановки процессов пролиферации в сосудистой стенке, которая может привести к сужению просвета. Темсиролимус используется при лечении почечноклеточного рака.
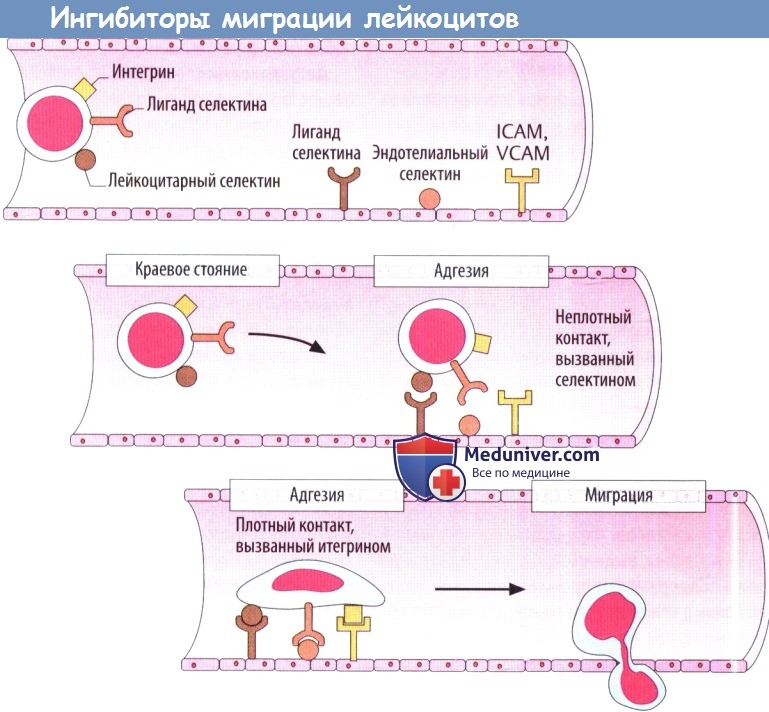
V. Ингибиторы миграции лейкоцитов. Натализумаб и эфализумаб — блокаторы интегрина с новым механизмом действия.
Миграция лейкоцитов из кровотока является необходимым условием для переноса иммунной реакции в ткани. Для этого лейкоциты преодолевают эндотелиальный барьер, что осуществляется в несколько этапов. Экстравазация лейкоцитов в месте повреждения тканей: клетки крови обычно располагаются в центре кровотока. Воспалительная вазодилатация замедляет кровоток, а лейкоциты лучше контактируют с эндотелиальными клетками. Адгезия: между лейкоцитами и эндотелиальными клетками образуются адгезивные мостики.
В первую очередь селектины с некоторыми углеводными остатками контактируют со смежными клетками. Мостики нестабильные, но открываются повторно, что замедляет движение лейкоцитов к эндотелию. Стабильная адгезия с остановкой лейкоцитов обусловлена интегринами в лейкоцитах и белками адгезии в эндотелии (ICAM — внутриклеточная молекула адгезии; VCAM — сосудистая клеточная молекула адгезии). Эндотелиальные клетки в воспаленной области связывают большее количество белков адгезии на мембране. Лейкоциты движутся между контактами эндотелиальных клеток, затем проходятсквозьокружающиебазальные мембраны и мигрируют в ткань, притягиваемые хемотаксическими сигнальными веществами, которые продуцируются при воспалений.
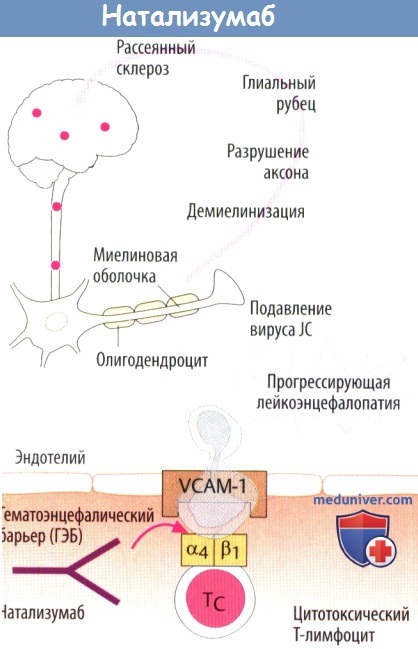
Натализумаб — человеческие антитела против α4-субъединицы интегринов. Интегрины являются гетеродимерными белками, состоящими из субъединиц α и β. Существуют разные изоформы. Связывание натализумаба блокирует миграцию Т-лимфоцитов в ЦНС. Это можно использовать при лечении рассеянного склероза. При данном аутоиммунном заболевании цитотоксические Т-лимфоциты атакуют олигодендроциты, которые продуцируют миелин в ЦНС. Редкой, но очень опасной нежелательной реакцией является прогрессирующая мультифокальная лейкоэнцефалопатия.
Она возникает в результате растормаживания вируса JC (от инициалов пациента у которого впервые выделен вирус). Данный вирус широко распространен, но обычно контролируется иммунной системой. Натализумаб является резервным препаратом, и его нельзя вводить вместе с другими иммуносупрессивными средствами против рассеянного склероза (IFN-β, глатирамера ацетат).
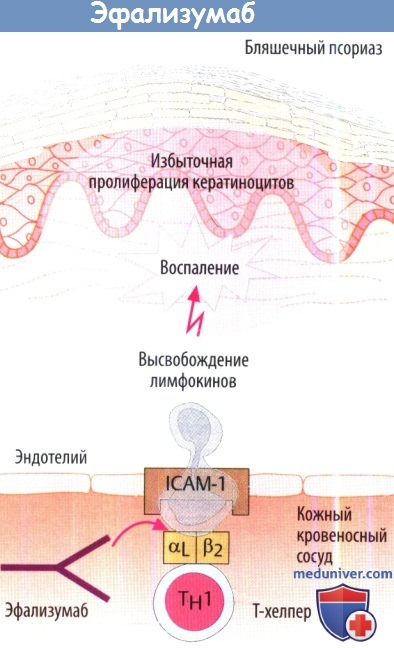
Эфализумаб используют при умеренной и тяжелой формах бляшечного псориаза. Известно, что данное заболевание аутоиммунное. Эфализума действует против а-субъединицы (αL, также известной как CD11) интегрина (LFA-1) Т-хелперов. Это останавливает миграцию лимфоцитов из сосудистого русла. Кроме того, блокируется контакт с клетками пораженной области кожи (клетки, несущие антиген кератиноциты). Побочные эффекты: выраженные гриппоподобные симптомы, повышение числа лимфоцитов. Из-за случаев прогрессирующей мультифокальной лейкоэнцефалопатии, о которых сообщалось у некоторых пациентов после лечения эфализумабом, данный препарат в настоящее время не используется в США и ЕС.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Что такое супрессия иммунитета
Как уже известно к настоящему времени, COVID-19-ассоциированные заболеваемость и смертность объясняются патологическими изменениями иммунного ответа пациента. Выдвигаются две противоречивые гипотезы: поражение, опосредованное гипервоспалительным «цитокиновым штормом», и нарушение иммунологического защитного механизма хозяина, приводящее к неконтролируемому распространению вируса и поражению органов. Ключевой причиной неспособности объяснить такое противоречие является отсутствие диагностических инструментов для оценки иммунной функции при заражении COVID-19.
Один из наиболее примечательных фактов о текущей эпидемии SARS-CoV-2 (COVID-19) заключается в том, что, несмотря на активно проводимые по всему миру исследования, патофизиологические процессы, играющие решающую роль в заболеваемости и смертности среди пациентов, по-прежнему остаются неизвестными. Господствующая в настоящее время парадигма патологического процесса подразумевает, что слишком сильный иммунный ответ, медиаторами которого выступают чрезмерно продуцируемые провоспалительные цитокины, вызывает обширное поражение легких и состояние склонности к тромбозам. Соответственно, предполагается, что летальный исход наступает в первую очередь по причине воспалительного заболевания легких, нарушения микро- и макроциркуляции и наступающих в конечном итоге дыхательной недостаточности или васкулярной коагулопатии. Это понятие опосредованного «цитокиновым штормом» летального исхода среди пациентов с COVID-19 популяризовано как в неспециализированных печатных изданиях, так и во многих ведущих научных публикациях.
На основании вышеизложенной теории проводятся испытания ряда антицитокиновых и противовоспалительных терапий для лечения COVID-19, включая антитела к интерлейкину-6, антагонисты рецептора интерлейкина-1 и ингибиторы сигнального пути JAK-STAT, но в ходе более ранних клинических исследований существенную эффективность таких подходов доказать не удалось.
В то же время, как это ни парадоксально, вторая, диаметрально противоположная теория COVID-19-индуцированной заболеваемости и смертности заключается в коллапсе системы иммунитета пациента. Такой коллапс иммунитета проявляется в неспособности его сдерживать неконтролируемые репликацию и распространение вируса наряду с прямой цитотоксичностью продуктов иммунного ответа пациента. В качестве обоснования этой прямо противоположной теории приводится наблюдаемая у пациентов прогрессивная и глубокая лимфопения, уровни которой порой достигают таких же значений, как при СПИДе. Результаты многих недавно выполненных исследований свидетельствуют о том, что, в отличие от «цитокинового шторма», который часто считается эпизодическим, лимфопения сохраняется у критически больных пациентов с COVID-19 и коррелирует с повышенной тяжестью вторичных заболеваний и летальным исходом.

Персонализированный подход к оказанию медицинской помощи требует более полного понимания, какой из этих типов реакции системы иммунитета преобладает, поскольку подходящие вмешательства будут различаться кардинальным образом в зависимости от постановки диагноза — наличия у пациента гиперреактивности или же глубокой иммуносупрессии. Например, в настоящее время выполняется клиническое исследование антител против интерлейкина-6, антагонистов рецептора IL-1 и ингибиторов JAK-STAT в качестве терапевтических средств для лечения пациентов с COVID-19 и существует вероятность, что они могут еще больше нарушить способность организма пациента побороть вирус. С другой стороны, методы терапии с использованием иммуностимуляторов, например, ингибиторов иммунных контрольных точек интерлейкина-7, интерферона-γ или GM-CSF, могут усугубить нарушенный и устойчивый воспалительный ответ и привести к усилению степени поражения органов.
Суммируя вышесказанное, становится ясным, что при ведении критически больных пациентов с COVID-19 необходимо ответить на два конкретных и являющихся ключевыми вопроса:
1) каков их первичный иммунный эндотип, т.е. является ли он гиперреактивным или иммуносупрессивным;
2) каким образом это состояние изменяется с течением времени в связи с прогрессированием заболевания или нормализацией состояния.
Более полное понимание иммунного статуса пациента с COVID-19 поможет провести правильную иммунотерапию. Задачей последующих исследований в этой области будет определение, развивается ли при COVID-19 усиленный провоспалительный «цитокиновый шторм» или же состояние, развивающееся при указанной патологии, представляет собой иммуносупрессивный тип иммунного ответа, а также изучение, как изменяется функция иммунной системы по мере прогрессирования заболевания.
Влияние ковида на иммунитет
Больше года пандемия коронавируса заставляет людей еще более пристально следить за своим здоровьем. Ведь победа организма над вирусом SARS-CoV-2 еще не означает полное выздоровление.
Статья проверена врачами Euromed Clinic✅
По мере накопления статистических данных о влиянии COVID-19 на организм человека ученые рассматривают новую коронавирусную инфекцию как системное заболевание, затрагивающее не только дыхательную, но и сердечно-сосудистую, желудочно-кишечную, кроветворную и иммунную системы.
Исследования в области влияния новой коронавирусной инфекции на организм человека показывают, что ковид значительно снижает иммунитет.
Иммунная система играет жизненно важную роль в функционировании организма, так как призвана защищать человека от вторжения вирусов, бактерий, грибков, аллергенов и других вредоносных агентов окружающей среды. Также иммунитет защищает организм от внутренних факторов — уничтожает клетки, мутировавшие вследствие заболеваний и других патологических процессов. Таким образом, иммунитет поддерживает здоровье человека.
Как коронавирус влияет на возникновение иммуносупрессии у человека?
Главными иммунными защитниками являются В- и Т-лимфоциты. B-лимфоциты синтезируют иммуноглобулины (антитела) — особые белки, которые призваны ликвидировать чужеродные микроорганизмы и ослаблять опасность токсических веществ. Кроме того, B-лимфоциты способны сохранять информацию о перенесенных заболеваниях, создавая тем самым постоянный иммунитет. T-лимфоциты уничтожают зараженные клетки организма, блокируют дальнейшее распространение инфекции и стимулируют иммунный ответ, передают информацию другим иммунным клеткам. Для определения уровня лимфоцитов используют общий анализ крови.
В организме взрослого человека нормальное число лимфоцитов варьируется в пределах от 1000 до 4800 на 1 микролитр крови. При снижении уровня лимфоцитов в крови меньше нижней границы такое состояние называют лимфопенией. Низкий уровень лимфоцитов в крови приводит к сбою иммунитета.
Согласно статистике, лимфопения при короновирусе выявляется примерно у 83 % пациентов. При этом стойкое снижение лимфоцитов после коронавируса в крови отмечается даже через 4-11 недель после выздоровления. По мнению ученых, вирус SARS-CoV-2 имеет сильное влияние на лимфоциты и приводит к длительным потенциальным дисфункциям. Таким образом, ковид ослабляет иммунитет на длительный срок, и даже после полного выздоровления от COVID-19 организм человека будет более восприимчив к различного рода инфекциям. Но, как отмечают специалисты, вирус SARS-CoV-2 не способен размножаться в лимфоцитах, поэтому снижение иммунитета после ковида носит хоть и длительный, но обратимый характер.
Есть пациенты, у которых выявляется повышение уровня лимфоцитов в крови после коронавируса. Такое состояние называется лимфоцитозом. Незначительный лимфоцитоз, как правило, проходит самостоятельно, но требует обследования для установления точной причины его появления.
Также в клиническом анализе крови примерно у 30 % больных коронавирусной инфекцией выявляется снижение уровня лейкоцитов (ниже 4000 в 1 мкл).
Состояние, которое характеризуется снижением уровня лейкоцитов в крови называется лейкопенией. Основной функцией лейкоцитов является защита организма от инфекций и инородных тел, которые способны нанести ему вред и нарушить баланс биохимических реакций. Лейкоциты ответственны за иммунитет и сопротивление различным неблагоприятным для организма факторам. Поэтому лейкопения при коронавирусе также снижает функционирование иммунной системы человека. На основании этого можно говорить о значительном подавлении иммунитета при ковиде.
Так, ослабление иммунитета после ковида может привести к уязвимости человека перед другими инфекциями. Вирусам, бактериям, грибкам легче проникнуть через ослабленные защитные барьеры нашего организма. Самыми распространенными инфекционными заболеваниями при ослабленном иммунитете после ковида являются: пневмония, бронхит, кожные инфекции.
У людей с пониженным уровнем лимфоцитов при коронавирусе хуже заживают любые повреждения на коже, даже простые царапины. Они чаще страдают от попадания в них инфекции.
Важно! Информация из статьи не может быть использована для самодиагностики и самолечения! Назначить необходимые обследования, установить диагноз и составить план лечения может только врач на консультации!
Подавление иммунитета после ковида может сопровождаться такими симптомами и признаками:
- упадок сил и постоянное ощущение слабости;
- частые головные боли без явных причин;
- повышенная раздражительность и депрессивность;
- сонливость даже при достаточном количестве сна;
- ломкие волосы и ногти, тусклая кожа;
- частые гнойничковые поражения кожи;
- грибковые поражения кожи, ногтей и слизистых;
- рецидивы болезней мочевыделительной системы, дыхательных путей и носовых пазух;
- бледность кожных покровов.
Таким образом, при снижении иммунитета после коронавируса пациенту требуется обратиться к врачу для предотвращения осложнений, связанных с ослаблением иммунной системы организма. Выраженная лимфопения при коронавирусе также требует наблюдения у врача. Лейкопения при ковиде легкой степени не требует медикаментозного лечения, но меры профилактики инфекции при этом должны быть соблюдены.
Записаться на удобное время к врачу-терапевту в Euromed Clinic можно по телефону + 7 812 327 03 01 или онлайн.
Как поднять иммунитет после коронавируса
В большинстве ситуаций лимфоциты в крови после коронавируса нормализуются без медикаментозной терапии. Но к иммуносупрессии после коронавируса требуется отнестись с особым вниманием, ведь пока идет восстановление иммунитета, очень важно не пропустить обострение хронических заболеваний. При подавлении иммунитета после ковида врач-терапевт, как правило, назначает комплексное обследование, препараты для профилактики уже имеющихся заболеваний вне стадии обострения. При необходимости пациенту может быть рекомендован курс рефлексотерапии, массажа и другие немедикаментозные методы. Также пациент получит ряд дополнительных рекомендаций, направленных на поднятие иммунитета после ковида. Ни в коем случае нельзя заниматься самолечением, особенно препаратами с иммуноглобулинами.
👉🏻 Любое вмешательство в работу иммунной системы без контроля врача может иметь серьезные последствия.
Как правило, пациенту совместно с индивидуальным назначением будут рекомендовано:
- здоровый сон;
- употребление полезной пищи;
- отказ от алкоголя;
- избегание переохлаждений;
- разумная физическая и двигательная активность;
- соблюдение правил личной и общественной гигиены;
- минимизация стрессовых ситуаций;
- получение положительных эмоции – научиться радоваться мелочам.
На сегодняшний день наиболее эффективной профилактикой коронавируса является вакцинация от COVID-19. Это доступная возможность защитить себя и своих близких от тяжелых последствий новой коронавирусной инфекции.
👉🏻 Запись на вакцинацию от COVID-19 по телефону + 7 812 327 03 01
Научная электронная библиотека
На протяжении последних десятилетий появилось большое число публикаций о тесной связи между стрессом и супрессией иммунинитета, играющей большую роль в патогенезе не только так называемых психосоматических заболеваний, но и аллергических, аутоиммунных, онкологических заболеваний.
Доказательства о наличии супрессии иммунитета, как одного из ведущих физиологических механизмов, реализующих патогенное воздействие стресса, были получены при проведении эпидемиологических исследований популяций, находящихся в неблагоприятных условиях существования, испытывающих ускоренные социологические, профессиональные и другие сдвиги.
Особого внимания заслуживают данные о состоянии иммунной системы после воздействия на организм различных видов лучевой энергии. Широко известны тяжелые последствия атомных взрывов в городах Нагасаки и Хиросима в 1945 году, взрыв атомного реактора в Чернобыле в 1986 году и испытаний на Семипалатинском ядерном полигоне Восточно-Казахстанской области (ВКО).
Известно, что любые лучевые воздействия вызывают повреждения органов иммунной системы, гибель лимфоцитов, плазматических клеток и других структур, выполняющих защитные функции, что приводит к развитию иммунодефицитных состояний и, как следствие – опухолевые и другие тяжелейшие заболевания.
Так согласно экспериментальным данным Григоренко Д.Е., Ерофеевой Л.М. и соавторов (1997) уже через сутки после однократного воздействия гамма-лучами в дозе 4,0 Гр у мышей-самцов линии BALB/с 3,5–4-месячного возраста в тимусе и селезенке резко уменьшается плотность распределения клеток. Общее количество клеточных элементов в тимусе уменьшается на 30 %, а в селезенке – более чем в 2 раза, по сравнению с контролем. В тимусе полностью исчезают клетки с картинами митоза, а в селезенке резко возрастает количество деструктивно измененных и разрушенных клеток, а также макрофагов.
Аналогичная картина наблюдалась в исследовании Ерофеевой Л.М. и соавторов (2000) у мышей после воздействия ускоренными ионами углерода с энергией 300 МэВ/нуклон в дозе 4,0 Гр. В наибольшей степени повреждаются молодые формы лимфоцитов, резко снижается митотическая активность, увеличивается количество бластов.
В наших исследованиях было изучено функциональное состояние иммунной системы у детского и взрослого населения ВКО при радиационном стрессе и в контрольной группе. Исследования показали, что у девочек при радиационном стрессе (табл.  снижается уровень Т-лимфоцитов и IgA. У мальчиков снижается уровень ТФЧ-РОК, IgA, IgМ, IgG и фагоцитарное число.
снижается уровень Т-лимфоцитов и IgA. У мальчиков снижается уровень ТФЧ-РОК, IgA, IgМ, IgG и фагоцитарное число.
Показатели иммунного статуса у детей при радиационном стрессе
Примечание. * различия статистически значимы в сравнении с контролем, р < 0,05.
У взрослых (женщины и мужчина) при радиационном стрессе (табл. 9) увеличивается относительное число лимфоцитов. Снижается уровень Т-лимфоцитов, количество иммуноглобулинов IgA, IgМ, IgG и увеличивается число ТФУ-РОК (Т-хелперы) и ТФЧ-РОК (Т-супрессоры).
Таким образом, при исследовании состояния иммунного статуса при радиационном стрессе обнаружена недостаточность общего количества иммунных клеток, особенно Т-супрессоров, и снижение продукции иммуноглобулинов. Изменения функциональной активности Т-звеньев иммунитета более выражены у взрослых, чем у детей.
Экспериментальный нейрогенный, эмоциональный или иммобилизационный стресс приводит к супрессии как гуморального, так и клеточного звена иммунитета. При чем, выраженность иммуносупрессии находится в прямой зависимости от силы и длительности существования стресса (Keller S., et al., 1981, 1984, Меерсон Ф.З. и др., 1985). Так, если после острого физического стресса иммунные сдвиги наблюдались в течение нескольких дней (3-дневная супрессия функций клеточного иммунитета у спортсменов, студентов во время сессии, астронавтов), то при длительном стрессорном воздействии (стресс утраты) иммунодепресия сохранялась около двух лет. При этом существенно снижается активность натуральных киллеров и нарушается синтез интерферона.
Показатели иммунного статуса взрослых при радиационном стрессе
Примечание. * различия статистически значимы в сравнении с контролем, р < 0,05.
Угнетение функции иммунной системы при стрессе связывают с подавлением активности Т-системы, изменением удельного количества рециркулирующих Т-клеток по отношении к В-клеткам и макрофагам.
При длительном и выраженном психоэмоциональном, болевом, травматическом, операционном и других видах стресса подавляется пролиферативная активность Т-клеток, снижается уровень Т-хелперов (Д.А. Ордабаева, 1989), при возможном повышении уровня Т-супрессоров (Аскалонова А.А. и др., 1985). В адаптационной фазе стресса происходит повышение активности Т-хелперов (Kronfol Z., 1984).
Исследованиями Ш.Б. Садыкова (1990) было обнаружено, что реакция Т-системы иммунитета при стресс воздействии характеризуется транзиторным угнетением клеточного звена иммунитета и стойким подавлением продукции АТОК и ЦИК в течение 120 часов после стрессирования животных.
Вместе с тем, при стрессе снижается функциональная активность и В-системы иммуннитета. Снижается уровень В-клеток (Gisler R., 1971), продукция и количество иммунноглобулинов (Wagner V., et al., 1975, Dorian B. et al., 1982).
Иммуносупрессивное действие стресса опосредуется и сопровождается сложным комплексом физиологических феноменов. До недавнего времени считалось, что стресс влияет на иммунитет опосредовано, через ось гипоталямус-гипофиз-надпочечники посредством увеличения синтеза кортикостероидов, а также адреналина (Selye H., 1976).
Установлено, что повышение уровня кортикостероидов нарушает функции клеточного и гуморального звеньев иммунитета, меняет количественные соотношения Т- и В-лимфоцитов, влияет на процессы миграции и циркуляции лимфоидных клеток, снижает продукцию лимфокинов, подавляет фагоцитоз.
Однако, в 1984 году Munck A. и др. высказали предположение, что вызываемая кортикостероидами иммуносупрессия служит превентивной мерой против иммунной гиперреактивности и аутоиммунных процессов, способных существенно осложнить течение реакции на стресс.
S. Keller с соавторами (1983) обнаружили, что лимфопения при стрессе зависит от уровня кортикостероидов, но супрессия реакции бласттрансформации лимфоцитов после стресса наблюдается у экспериментальных животных и с удаленными надпочечниками.
Исключительная роль кортикостероидов в регуляции иммунного ответа опровергается исследованиями, показавшими влияние ряда других гормонов на иммунитет, среди которых СТГ, тироксин, пролактин, оказывающие посредством цАМФ воздействие на лимфоциты и приводящие к выработке лимфокинов и к синтезу антител (Rey A. et al., 1981).
Противоречивость данных о роли кортикостероидов и других гормонов в структуре иммуномоделирующих механизмов стресса свидетельствует о комплексном характере, предполагающем участие других регуляторных систем организма.
Помимо эндокринной системы, в регуляции иммунного ответа принимает нервная система. Регулирующее влияние на иммунную систему оказывают такие структуры мозга как передний гипоталамус, гиппокамп и ретикулярная формация участие которых в развитии нейрогенного, эмоционального стресса не вызывает сомнений (Ведяев Ф.П., 1975, Ведяев Ф.П., Воробьева Т.М., 1980).
Показано, что разрушение области переднего гипоталамуса снижает функциональную активность клеточного иммунитета, влияние на синтез антител, повреждает систему комплемента, нарушает фагоцитоз, нарушается архитектоника селезенки и лимфатических узлов. Разрушение ретикулярной формации или верхнего холмика крыши среднего мозга ведет к инволюции тимуса.
Не исключено, что осуществление связи между передним гипоталамусом и иммунными структурами включает в себя как промежуточное звено, гипофиз с его контролем синтеза стероидов и некоторых других гормонов.
Нейромедиаторы вегетативного отдела нервной системы оказывают существенное влияние на иммунные процессы. На лимфоцитах обнаружены рецепторы к катехоламинам (Bourne H. et al., 1974), через которые они влияют на процессы пролиферации и трансформации лимфоцитов, розеткобразования, синтез антител, цитотоксичность и межклеточный уровень цАМФ. В тоже время показано, что катехоламины приводят к снижению хемитаксиса и фагоцитарной активности моноцитов и нейтрофилов.
Введение адреналина пациентам, страдающим аллергическими заболеваниями, приводило к повышению в крови уровня плазмина, активирующего систему комплемента. Аналогичные сдвиги имеют место и при стрессе (Teshima H. et al., 1974).
Установлено, что нейроэндокринные структуры не только влияют на иммунную систему, но и по принципу обратной связи получают информацию об осуществлении иммунного ответа. Учитывая, что в ходе иммунной реакции снижается уровень норадреналина не только в гипоталамусе, но и в лимфоидных органах, в частности в селезенке, можно предположить, что это обусловлено одними и теми же медиаторами и является единым «симпатическим рефлексом» на иммунный ответ (Ордабаева Д.А., 1989).
Другой возможный физиологический механизм иммуносупрессивного действия стресса связан с эндогенными опиатами, система которых четко реагирует на воздействие стрессоров повышением уровна бета-эндорфина в плазме. Повышение уровня эндорфина прямо связано с интенсивностью стресса (Mueller G., 1981).
На различных моделях показано, что опиатная аналгезия, вызываемая стрессом, ведет к иммуннодепрессии, тогда как иные виды аналгезии иммуннодепрессию не вызывают. К тому же были обнаружены опиатные рецепторы на лимфоцитах и нейтрофилах (McCain H. et al., 1982).
Y. Shavit c соавторами (1984) наблюдали супрессию цитотоксической активности натуральных киллеров при аналгезии опиатами и пришли к выводу, что опиаты опосредуют иммунодепрессию при дефиците адаптивных процессов.
Вместе с тем, возможные механизмы, способствующие и сопутствующие иммуносупрессивному действию стресса, не исчерпываются вышеприведенными данными, так как многие другие гормоны и нейромодуляторы влияют на состояние иммунитета и в то же время реагируют на стресс, или обеспечивают его механизмы.
Для оценки функционального состояния иммунной системы и диагностики нарушений ее функции необходимы специальные методы, учитывающие особенности ферментативных процессов в иммунокомпетентных клетках.
Известно, что в зависимости от отношения Т-лимфоцитов к теофиллину различают два типа клеток: теофиллин-чувствительные Т-лимфоциты (Т-супрессоры), активность их зависит от цАМФ и теофиллин-резистентные лимфоциты (Т-хелперы), на активность которых цАМФ не влияет.
Уровень цАМФ в клетке определяется скоростью его синтеза и распада: синтез осуществляется из АТФ под воздействием аденилатциклазы, а разрушение цАМФ обеспечивается фосфодиэстеразой. На активность аденилатциклазы кроме известных гормонов, влияет аденозин, инозин, АМФ, АТФ. Активность фосфодиэстеразы блокируется теофиллином и другими подобными соединениями. Следовательно, функциональная активность лимфоцитов, а также в целом состояние иммунных реакций связана с функцией ферментов, контролирующих уровень аденозина, инозина, АМФ и цАМФ.
Ферменты цикла пуриновых нуклеотидов аденозиндезаминаза (АДА), 5`-нуклеотидаза (5`-НТ) и АМФ-дезаминаза (АМФ-ДА), обеспечивают метаболические превращения пуриновых нуклеотидов и контролируют уровень специфических внутриклеточных модуляторов, таких как АМФ, аденозин и инозин.
В свою очередь аденозин, инозин, АМФ, ИМФ принимают непосредственное участие в метаболизме лимфоцитов, их созревании и имеют прямое отношение к иммунорегуляторным процессам в организме. Так инозин активирует ферменты лизиса некротических масс, ускоряет созревание соединительной ткани, увеличивает активность противоопухолевых и антиоксидантных ферментов (Sеmerjyn G.H., Sеmerjyn G.AH., Trchounian A.H., 2018).
Изменения активности ферментов цикла пуриновых нуклеотидов способны вызвать нарушения функциональных свойств лимфоцитов, например, обусловить декоординацию иммунных процессов. Так дефицит аденозиндеаминазы, в первую очередь, поражает Т-клетки и сопровождается не только накоплением аденозина, но и 2´-дезокси аденозина и 2´-O-метиладенозина, вызывающих апоптоз лимфоцитов.
Известно, что дефекты ферментов участвующие на разных этапах метаболизма пуриновых нуклеотидов приводят к развитию разного рода заболеваний. Степень глубины развития патологического процесса напрямую связаны с изменениями активности ферментов метаболизма пуриновых нуклеотидов.
Примером таких заболевания является подагра, синдром Леша-Нихана, иммунодефициты, различного рода болезни соединительной ткани, воспалительные заболевания суставов. Синдром Леша-Нихана является генетическим заболеванием, при котором нарушен метаболизма пуринов и проявляется неврологическими нарушениями, задержкой психомоторного развития, церебральным параличом, уратной нефропатией.
Зарегистрирована высокая активность АДА в синовиальной жидкости таких артритов, как реактивный артрит, анкилозирующий спондилоартрит, подагра и ювенильный идиопатический артрит. Установлено, что определение активности АДА, АМФДА и АД в лизатах лимфоцитов, эритроцитов и плазме крови больных РА способствуют выявлению и уточнению степени активности ревматоидного процесса, фазы клинической ремиссии (Ушакова И.С., 2012).
В литературе описаны два иммунодефицита, связанные с нарушением активности ферментов контролирующих уровень аденозина в лимфоцитах. Описана тяжелая форма иммунодефицита, вызванная недостаточностью аденозиндезаминазы. При этом иммунодефиците снижается количество и нарушается функция как тимусзависимых лимфоцитов (Т-лимфоциты), так и лимфоцитов костного мозга (marrow-derived) – В-лимфоцитов. Это может быть вызвано увеличением количество в лимфоцитах аденозина, который подавляет активность аденилатциклазы. Однако, имеются данные о том, что аденозин в низких концентрациях снижает, а в высоких – повышает уровень цАМФ.
Аденозин и его аналоги являются селективными стимуляторами Т-лимфоцитов, в частности, Т-супрессоров. Стимуляция Т-супрессоров аденозином может вызвать ограничение функции В- и Т-лимфоцитов. Следует принять во внимание то, что эффект аденозина зависит не только от его количества, но и вероятно, от соотношения уровня аденозина с другими модуляторами, такими как инозин, ИМФ и АМФ.
Подтверждением вышесказанного служат данные о иммуностимулирующем действии С-замещенных аналогов аденозина. В период восстановления иммунного ответа у иммунокомпрометированных животных аналог аденозина стимаден стимулирует гуморальное звено иммунитета по числу АТОК. У этих же животных С-замещенный аналог аденозина вызывает выраженную стимуляцию клеточного иммунитета, вплоть до полного восстановления, а также усиливает кооперацию Т- и В-лимфоцитов.
Очевидно, что с явлением сочетанного действия аденозина, ИМФ, инозина и АМФ, связана вторая форма иммунодефицита, вызванная недостаточностью 5`-нуклеотидазы. При этой, более легкой форме иммунодефицита, функции В-лимфоцитов остаются нормальными, но нарушаются функции Т-лимфоцитов. Недостаток 5`-нуклеотидазы приводит к увеличению уровня АМФ и снижению уровня аденозина в Т-лимфоцитах, но не изменяет активность аденилатциклазы.
Таким образом, анализ литературных данных свидетельствует о том, что процессы, обеспечивающие функции иммунной системы при стрессе, зависят от активности 5`-нуклеотидазы, аденозиндезаминазы и АМФ-дезаминазы.
В связи с вышесказанным, для оценки функциональной полноценности иммунной системы и характеристики нарушений ее функции нами предложен способ, учитывающий изменения активности 5`-нуклеотидазы, аденозиндезаминазы и АМФ-дезаминазы в лимфоцитах крови (Табергенов С.О., Тапбергенов Т.С., 2004). Как показали наши исследования, более значимую информацию о функциональном состоянии иммунной системы дают показатели соотношения активности аденозиндезаминазы, 5`-нуклеотидазы и АМФ-дезаминаза в виде коэффициентов А и В (Тапбергенов С.О., Тапбергенов Т.С., 2005; Тапбергенов С.О. Тапбергенов Т.С., патент № 25985, изобретение № 9176 от 19.03 1998, Казахстан).
Коэффициент А – это соотношение активности 5`-нуклеотидазы/АМФ-дезаминазы. Коэффициент А указывает на соотношение уровня аденозина и ИМФ в лимфоцитах. Чем выше коэффициент А, тем больше образуется аденозин. Чем ниже коэффициент А, тем больше – ИМФ и меньше аденозина, что указывает на нарушение функции Т-лимфоцитов.
Коэффициент В – это соотношение активности аденозиндезаминазы/АМФ-дезаминазы. Коэффициент В указывает на уровень инозина. Чем выше коэффициент В, тем больше инозина и меньше аденозина и ИМФ. Чем ниже коэффициент В, тем на фоне увеличения уровня аденозина, больше меняется соотношение аденозина и ИМФ в сторону увеличения ИМФ, что приводит к изменению функций, как Т-лимфоцитов, так и В-лимфоцитов.
В эксперименте на белых крысах, нами был проведен сравнительный анализ реакций клеточного и гуморального звеньев иммунитета и активности ферментов пуринового метаболизма в лимфоцитах при иммобилизационном (табл. 10) и радиационном стрессе (табл. 11).
Показатели иммунитета и активность ферментов пуринового метаболизма лимфоцитов белых крыс в разные сроки нейрогенного стресса
Нарушения иммунитета: причины, симптомы, лечение
Без иммунной системы жизнь организма невозможна. С ослабленной иммунной системой — полна опасностей. Почему? Потому что иммунитет — главный страж нашего здоровья и жизни. Иммунная система:
- распознает и пресекает ежесекундные вторжения извне;
- следит за «благонадежностью» многочисленного клеточного населения внутри;
- контролирует процессы роста, развития и постоянного возобновления органов и тканей;
- помогает организму оставаться прочным и стабильным в условиях постоянных перемен;
- тесно сотрудничает с другими системами организма, также отвечающими за сохранение его целостности; особенно — с нервной и эндокринной;
- вносит свой вклад в развитие и поддержание таких, казалось бы, сугубо «мозговых» функций, как память, внимание, стрессоустойчивость и др.
Этимологически слово иммунитет происходит от латинского «immunitas», означающего «освобождение, избавление». Благодаря освободительной мощи нашей «армии» и «службы внутренней безопасности» мы продолжаем сохранять свою целостность и, постоянно возобновляясь внешне и внутренне, оставаться самими собой.
Все, от кого нас защищает иммунная система — бактерии, вирусы, грибы, простейшие, гельминты, чуждые нам вещества; собственные измененные вторжением вирусов и/или мутациями клетки — реально ей (целостности) угрожают. Ведь и у внешних захватчиков, и у внутренних «асоциальных элементов» есть свои, отличные от наших, цели. Они, питаясь и размножаясь внутри нас, отчаянно стремятся их осуществить ценой нашего здоровья и жизни.
Эта «война» за жизнь внутри нас идет постоянно, результат каждой отдельной битвы и ее исход в целом зависит от состояния иммунитета.
Причины нарушения иммунитета
Иммунная система может быть неполноценной вследствие нарушений на генном уровне. В этом случае принято говорить о т.н. первичном иммунодефиците. А может стать таковой, при условии ослабляющего действия на ее исходно боеспособный потенциал ряда внешних и внутренних факторов. Такие нарушения работы главной защитной системы организма называются вторичным иммунодефицитом.
Подобное временное или постоянное состояние переводит его носителя в группу высокого риска по ряду опасных заболеваний:
- острых и хронических инфекций бактериального, вирусного, грибкового генеза;
- воспалительных патологий аутоиммунного характера;
- онкологических недугов и др.
На состояние иммунитета влияют:
- условия жизни (экологическая обстановка, род деятельности);
- качество и режим питания (и образ жизни в целом);
- лечебное воздействие (медикаментозная и лучевая терапия, хирургические вмешательства);
- перенесенные острые и хронические недуги, в том числе, онкология;
- физические и психические нагрузки (их длительность и характер);
- перенесенные физические и психические травмы;
- физическая и психическая «закаленность» организма (стрессоустойчивость) и др.
Симптомы нарушения иммунитета
Нарушения иммунитета затрагивают оба его типа — неспецифический (врожденный) и специфический (приобретенный, адаптивный) и выражаются в:
- снижении численности «служебного состава»— тканевых макрофагов, нейтрофилов, моноцитов, базофилов, эозинофилов, лимфоцитов (Т, В-класса, естественных киллеров) и др. и угнетением их функции;
- сбое в межклеточной коммуникации и дисбалансе различных иммунных реакций;
- нарушении выработки «рабочих инструментов» — сигнальных молекул (цито- и хемокинов) и средств «дальнего поражения» — антител и др.
В некоторых случаях опасные изменения в работе иммунной системы могут, напротив, выражаться в избыточной активности некоторых ее звеньев. Например, в увеличении активности клеток-супрессоров (в здоровом организме они играют роль «миротворцев», не позволяющих защитным реакциям нанести вред собственному организму).
Очень часто угнетение иммунитета становится следствием как наличия тяжелых недугов (прежде всего, онкологических и аутоиммунных), так и их лечения с помощью лучевой и химиотерапии, гормональных препаратов и лекарств, подавляющих иммунитет (последние применяются также для предотвращения отторжения пересаженного органа).
Другими факторами, отрицательно сказывающимися на состоянии иммунной системы, являются:
- хирургические вмешательства (особенно под общим наркозом);
- серьезные травмы и обширные ожоги;
- удаление органов иммунной системы (тимуса и селезенки);
- инфекционные заболевания (прежде всего, вирусные);
- паразитарные отягощения;
- количественные и качественные нарушения микрофлоры;
- профессиональные и экологические «вредности» (физические и химические);
- недостаточное поступление в организм витаминов, микро и макроэлементов, белков и др.
Сбой в работе иммунной системы может произойти в любое время. Но все-таки, пожилой возраст (особенно, если он сопровождается «букетом» хронических недугов и длительным лечением) служит дополнительным фактором риска.
Лечение нарушений иммунитета
Огромное влияние на состояние нашей иммунной системы оказывают психоэмоциональные стрессы. Многочисленные научные исследования доказывают, что стресс подавляет иммунитет. Например, избыток широко известного «попутчика» хронического стресса — кортизола (гормона коры надпочечников) ведет как к снижению функции клеток-защитниц, так и к их преждевременной гибели.
Но. Важен не столько сам факт наличия в жизни стрессовых ситуаций (мы далеко не всегда можем их избежать), сколько реакция на них. Вот почему тренировка стрессоустойчивости является действенным средством профилактики и лечения иммунных расстройств. Как сказал Марк Аврелий почти две тысячи лет назад: «Не событие это является несчастьем, а способность достойно перенести его — счастьем».
Физическую стрессоустойчивость тоже можно и нужно тренировать. Гимнастика, закаливание, индивидуально правильное питание и режим жизни — проверенные временем способы укрепления иммунитета.
Лекарственное лечение сбоев в работе иммунной системы имеет свои «за» и «против». В некоторых случаях оно может дать быстрый эффект. Но, иметь далеко не всегда предсказуемые отдаленные последствия.
Традиционная медицина имеет огромный опыт восстановления нашей физической, энергетической и психической защиты. Главные ключи — индивидуальный подход к лечению человека (а не устранение симптомов его болезни) и усилия его самого, направленные на возвращение здоровья (качество и режим питания, физическая активность, изменение психоэмоциональных привычек и др.).
Такие традиционные методы лечения, как: иглотерапия, цигун-тарапия, остеопатия, фитотерапия, гомеопатия могут помочь обнаружить и устранить главные причины сбоев в работе иммунной системы, справиться с их последствиями и восстановить утраченную целостность —здоровье. Также эти методы являются действенными средствами профилактики нарушений иммунитета.
Имунная система человека Является ли заболевание фурункулезом следствием сбоя в работе имунной системы
Ответ: Нельзя во всем винить иммунную систему, проблема носит комплексный характер начиная от питания и заканчивая образом мыслей человека.
Иммунодепрессанты: лекарства для борьбы с иммунитетом

Иммунная система – одна из наиболее сложно устроенных в организме человека. Чем дольше люди занимаются изучением иммунитета, тем больше возникает вопросов и сложностей. Иммунодефицит или снижение защитных сил организма приводит к развитию различных инфекционных заболеваний (вирусных, бактериальных, грибковых), а также к появлению опухолей. Поэтому многие люди озадачены тем, как повысить свой иммунитет. Неправильное функционирование иммунной системы также может стать причиной проблем со здоровьем. В этом случае приходится применять иммунодепрессанты, или иммуносупрессоры. Что же это за лекарства и в каких ситуациях они нужны? Подробности выясняет MedAboutMe.
Когда иммунитета слишком много

Казалось бы, сильный иммунитет — это отлично. Активное сопротивление инфекциям делает человека неуязвимым перед большим количеством заболеваний. Ни грипп, ни другие респираторные болезни ему не страшны. Что же происходит в действительности?
Для защиты организма от инфекций иммунная система применяет различные механизмы. Специальные клетки (лимфоциты) атакуют чужеродные организмы (вирусы, бактерии, грибы, опухолевые клетки) и стремятся разрушить их. Однако иногда в результате определенных сбоев, они начинают атаковать клетки собственного организма. Причин для этой патологической активности иммунной системы много, но самая главная — это генетическая предрасположенность. Помимо этого, среди других возможных факторов риска — длительно текущие инфекционные заболевания, ионизирующее излучение, чрезмерная инсоляция (нахождение на солнце), воздействие химических веществ, постоянная стимуляция иммунитета лекарствами (иммуностимуляторами), перенесенный инфаркт или инсульт, тяжелая травма или стресс и др.
Также чрезмерную активность иммунитет проявляет при появлении в организме человека инородных тел. Типичный пример — беременность. Ребенок имеет половину генов отца, которые являются чужеродными для матери, поэтому ее организм воспринимает плод как инородное тело и стремиться от него избавиться. Токсикоз начала беременности является одним из проявлений этого процесса. Однако природа и тут все предусмотрела: активность иммунной системы в период беременности значительно снижается, и это помогает женщине выносить и родить здорового ребенка.
Однако, есть ситуации, которые эволюционно никак не предусмотрены: это процесс хирургической пересадки донорских органов (почка, печень, сердце и др.). В результате этого в организме человека появляется чужеродная ткань, и иммунная система начинает активно с ней бороться. Без назначения специальных лекарств рано или поздно произойдет отторжение донорского органа.
Иммунодепрессанты: что это за лекарства

Иммунодепрессанты были изобретены для угнетения патологической активности иммунной системы, при которой она начинает бороться с клетками и тканями собственного организма или с тканями чужого после пересадки донорских органов. Таким образом, аутоиммунные болезни и состояние после трансплантации органов и тканей — два основных показания для лечения этими лекарственными средствами.
Иммунодепрессанты ни в коем случае не являются препаратами для самолечения. Во-первых, человек не сможет самостоятельно определить наличие показаний для их приема, а во-вторых, они требуют тщательно подбора конкретного лекарства, дозы и режима приема, который для каждого больного индивидуален. Они имеют очень большой список побочных эффектов, поэтому постоянное лечение ими требует постоянного диспансерного наблюдения доктора.
Наиболее старые иммунодепрессанты

Иммунодепрессанты не одинаковы по своему воздействию на иммунную систему. Наиболее древние представители этой группы лекарств действуют негативно на весь иммунитет без разбору. С ним относятся циклофосфамид, азатиоприн, метотрексат и др. Они угнетают как аутоиммунную активность, так и противоопухолевую, противоинфекционную и посттрансплантационную.
В результате эти лекарства имеют огромный список побочных эффектов, связанных с отсутствием избирательности действия. Среди них — инфекционные болезни, действие на систему крови, костный мозг, серьезные аллергические реакции, повышение риска злокачественных новообразований. Однако, есть ситуации, когда без них не обойтись. Регулярное прохождение полного обследования, анализы и инструментальные методы позволяют вовремя распознавать осложнения лечения этими препаратами.
Аутоиммунные болезни и прием иммунодепрессантов

Аутоиммунные болезни — это типичный пример того, как собственный организм становится сам себе врагом. Они могут проявляться поражением различных органов и тканей в организме. К таким заболеваниям относятся:
- ревматоидный артрит,
- системная красная волчанка,
- системная склеродермия,
- системный васкулит и др.
В некоторых случаях иммунная система поражает отдельные органы или ткани:
- аутоиммунный гепатит — поражение клеток печени,
- аутоиммунный тиреоидит — поражение клеток щитовидной железы,
- рассеянный склероз — поражение оболочки нейронов различных отделов нервной системы,
- сахарный диабет — разрушение особых клеток поджелудочной железы, вырабатывающих инсулин и др.
В большинстве случаев эти заболевания носят наследственный характер, то есть, у больного имеется определенная генетическая предрасположенность. Однако, даже при наличии неблагоприятной наследственности, есть вероятность прожить долгую жизнь и не заболеть. И подтверждением этому служит то, что в одной семье могут быть больной и здоровый ребенок, имеющие одинаковые гены. Пусковым звеном для аутоиммунной болезни в большинстве случаев служит инфекционный процесс. Например, хронический тонзиллит, вызванный стрептококками, может осложниться развитием ревматоидного артрита, ведь клетки тканей суставов очень схожи с этими бактериями и иммунная система просто их путает. Дебют сахарного диабета 1 типа у детей нередко возникает после тяжелого респираторного заболевания, стресса или травмы.
Для подавления активности иммунной системы применяют как старые иммунодепрессанты, которые обладают неселективным действием и угнетают весь иммунитет (метотрексат, циклофосфан, азатиоприн, препараты золота), так и более современные, влияющие преимущественно на аутоиммунные процессы. К последним относятся новые лекарства, такие как инфликсимаб, лефлуномид и др. Они значительно облегчают состояние больных и продлевают ремиссию на длительное время.
Иммунодепрессанты после трансплантации органов и тканей
Некоторые препараты действуют избирательно и используются только после трансплантации. До их внедрения практически все попытки пересадить чужеродные органы заканчивались неудачей. Даже самая блестяще проведенная операция не обеспечивает их приживания в теле нового хозяина, ведь иммунная система начинает активно бороться с клетками чужеродных органов.
После внедрения в практику таких иммунодепрессантов, как циклоспорин А, тимодепрессин и такролимус, число отторжений трансплантатов резко сократилось. Это дало возможность людям с терминальной почечной недостаточностью, которые были вынуждены несколько раз в неделю проводить в отделении гемодиализа, после пересадки донорской почки перестать зависеть от больницы, работать и активно путешествовать. На сегодняшний день наиболее эффективный препарат, который применяется после пересадки донорского органа, это флударабин. Его используют как для постоянного лечения, так и при появлении первых признаков отторжения трансплантата.
Плюсом этих препаратов является избирательность их действия. Они подавляют активность иммунной системы против пересаженного органа, но не влияют на противоопухолевый и противоинфекционный иммунитет.
Однако и тут есть ряд проблем. Препараты эти относятся к категории дорогостоящих, но государство должно обеспечивать всех людей, которые в них нуждаются, бесплатно по программе «7 редких нозологий». Теоретически, это так. Но иногда существуют определенные трудности, связанные с различными бюрократическими процедурами, в результате чего поступление этих лекарств к больным задерживается. А прием данных препаратов должен быть непрерывным. Поэтому бывают случаи, когда пациенты вынуждены покупать их самостоятельно. Также эти лекарства обладают большим списком побочных эффектов, поэтому больные должны регулярно сдавать анализы крови, мочи, проходить ультразвуковое исследование, чтобы вовремя их выявить. И тем не менее, учитывая, что это их единственный шанс на продление жизни, оно того стоит.
Таким образом, иммунодепрессанты может назначать только врач. Для лечения ими должны быть строгие показания. Доза, кратность приема и длительность лечения выбираются индивидуально. Учитывая большое количество возможных осложнений от лечения, такие пациенты должны регулярно проходить полное медицинское обследование, чтобы как можно раньше их выявить.






