Эта удивительная «супрамолекулярная химия»
Одним из приоритетных направлений современной фармакологии является исследование возможностей использования различных «контейнеров» для доставки молекул лекарственного вещества к органу-мишени. Все более мощным инструментом получения молекулярных конструкций, которые могут служить «транспортным средством», становится так называемая супрамолекулярная химия, обладающая перспективами самого широкого применения не только в медицине, но и в других областях
«Секрет» валиномицина
Еще в 1955 г. австрийский исследователь Г. Брокман из экстракта штамма бактерий Streptomyces fulvissimus впервые выделил антибиотик валиномицин, а в 1963 г. была определена его химическая структура. Стало известно, что валиномицин представляет собой депсипептид, свернутый в кольцо, которое содержит 12 остатков.
Прошло всего несколько лет, и слово «валиномицин», ранее известное лишь узкому кругу специалистов, изучающих пептиды, внезапно заполонило страницы биологических журналов. Началось это с открытия способности валиномицина стимулировать перенос ионов калия через биологические мембраны. Вскоре американцы П. Мюллер и Д. Рудин предположили, что валиномицин играет роль контейнера для переноса ионов. Согласно их гипотезе, ион калия переправляется через мембрану, «спрятавшись» внутри гораздо большей по размеру молекулы этого антибиотика.
Термин «супрамолекулярная химия» был введен Ж.-М. Леном и определен им как «…химия за пределами молекулы, описывающая сложные образования, которые являются результатом ассоциации двух (или более) химических частиц, связанных вместе межмолекулярными силами»
Изучением закономерностей связи между структурой и функцией валиномицина, а также родственных ему веществ занялась группа российских ученых под руководством Ю.А. Овчинникова. Вскоре вслед за валиномицином удалось обнаружить и другие, подобные ему вещества природного происхождения, которые получили в науке название «ионофоры». Благодаря их открытию и изучению был сделан решающий шаг в познании механизмов переноса ионов сквозь биологические мембраны, поскольку создаваемая ионными насосами разность концентраций ионов Nа+ и К+ по обе стороны мембран играет ключевую роль в проведении нервного импульса, регуляции осмотического давления и водно-солевого обмена.
«Короны» бывают разными
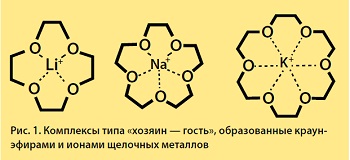
Толчком к дальнейшему развитию идеи макроциклического комплексообразования послужило открытие краун-эфиров — первых синтетических аналогов природных веществ, осуществляющих перенос ионов щелочных металлов через клеточную мембрану. Автором этого открытия стал Чарльз Педерсен, который еще в 1962 г. синтезировал соединение, представляющее собой полое внутри подвижное кольцо из углеродных атомов, связанное через мостики атомами кислорода. Форма таких молекул напоминает корону, что и определило их название (англ. crown — корона). Варьируя размер цикла, ученый установил, что краун-эфиры способны избирательно связывать некоторые катионы, помещая их в центр своей «короны», однако целых пять лет не спешил публиковать полученные результаты, а синтезировал все новые и новые соединения. В общей сложности Ч. Педерсен к 1967 г., к моменту первой публикации в журнале Американского химического общества, синтезировал более 60 полиэфиров с числом кислородных атомов от 4 до 20 и размером цикла от 12- до 60-членного.
Ныне краун-соединения становятся действенным инструментом регулирования процессов переноса металлов через биологические мембраны. В частности, это создает основу и для разработки лекарств, направленных на борьбу с заболеваниями, вызванными избытком тяжелых металлов в организме, или для выведения из организма опасных радиоактивных ионов, таких как цезий-137.
«Чаши» для ионов
Открытие Чарльза Педерсена получило развитие в работах американца Дональда Крама и француза Жан-Мари Лена, что завершилось присуждением в 1987 г. всем троим Нобелевской премии.
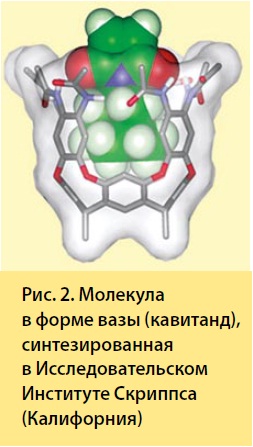
Краун-эфиры обладают двухмерной структурой, но Д. Краму удалось получить аналогичного рода трехмерные структуры, способные захватывать ионы. В результате сложных многостадийных органических синтезов в начале 80-х годов прошлого столетия он создал так называемые молекулы-«контейнеры» с заранее организованной структурой — сферанды (буквально пустые внутри сферические структуры) и молекулы, обладающие внутренней полостью, — кавитанды (англ. cavity — полость), своего рода молекулярные чаши с углублениями. В этих чашах, так же как и в молекулах краун-эфиров, могли «вольготно» размещаться ионы.
Д. Крам установил, что в отличие от относительно гибких молекул краун-эфиров в растворе жесткие молекулы сферанда или кавитанда, в силу особенностей своей трехмерной структуры, проявляют более сильное связывание с ионами и превосходную катионную селективность.
Теперь заключенный в сферанду или кавитанду катион металла оказывается в «крепких объятиях», однако с той особенностью, что они открыты лишь для данного рода катионов. Селективность связи сферанда с катионом натрия (Na+) на 10 (!) порядков величины выше его сродства к катиону калия (K+).
Огромная заслуга Д. Крама состоит в том, что он ввел в науку новую концепцию «хозяин — гость». Свою Нобелевскую лекцию в Стокгольме он так и озаглавил: «Получение молекулярных комплексов типа «хозяин — гость». В ней речь шла о способности большой молекулы («хозяина») специфически «захватывать» и прятать в своем молекулярном «чреве», если можно так выразиться, «гостя» — ион того или иного знака или даже целую небольшую молекулу.
Что могут «скрывать» криптанды?
Ж.-М. Лен также осуществлял попытки создать искусственные химические соединения, обладающие свойствами природных ионофоров. Поиск таких соединений он начал в 1968 г. В результате были синтезированы особые молекулярные структуры — криптанды.
Как и Д. Крам, Ж.-М. Лен хотел сконструировать трехмерный аналог краун-эфиров. Он предвидел, что с помощью таких структур ионы металлов могут быть полностью капсулированы внутри краун-подобного «хозяина», что должно было привести к повышению катионной селективности молекулы-«хозяина» и усилению его ионофороподобных транспортных свойств.
Криптанды получили свое название благодаря способности сферически окружать, как бы «погребать в склепе», ионы металлов (греч. kruptos — «скрытый»). Ассоциация со склепом обусловлена наличием у этих соединений внутренней полости, защищенной с трех сторон атомами кислорода.
Было также доказано, что криптанды можно приспособить и для «захватывания» уже не катионов, а анионов.
И природные и синтетические
Таким образом, в конце прошлого века на стыке органической, физической, координационной химии, биологии, физики, материаловедения и микроэлектроники родилась наука под названием «супрамолекулярная химия».
Интересно отметить, что супрамолекулярные структуры очень широко распространены в живой природе. Все реакции в живых организмах протекают с участием ферментов — катализаторов белковой природы. Ферменты — идеальные молекулы-хозяева. Активный центр каждого фермента устроен таким образом, что в него может попасть только то вещество (субстрат), которое соответствует ему по размерам и энергии; с другими субстратами фермент реагировать не будет. Так, например, с помощью особых ферментов морские птицы могут опреснять для себя соленую воду.
Еще одним примером супрамолекулярных биохимических структур могут служить молекулы ДНК, в которых две полинуклеотидные цепи комплементарно связаны друг с другом посредством множества водородных связей. Каждая цепь является одновременно и гостем, и хозяином для другой цепи.
На сегодня насчитывается несколько классов синтетических супрамолекулярных соединений, среди которых основными являются кавитанды, криптанды, каликсарены, комплексы «гость — хозяин», ротаксаны, катенаны и клатраты.
Появляются все более и более сложные структуры, которые в соответствии с «ассоциациями», вызываемыми у открывших их ученых, подчас получают замысловатые названия типа «корзины», «щетки», «осьминоги» и др.
Супрамолекулярные структуры являются основой многих современных технологий, таких как экстракция биологически активных веществ, создание фото- и хемосенсоров, разработка нанокатализаторов, моделирование сложных биологических процессов и др. Что же касается фармакологических аспектов, то здесь новейшие технологии за счет взаимодействия «гость — хозяин» позволяют помещать в полости молекулярных контейнеров различные лекарственные вещества (пептиды, олигонуклеотиды, аминокислоты, антигены, антибиотики, цитостатики и др.) и избирательно доставлять их в клетки, ткани и органы человека. Такой подход не только повышает терапевтический эффект, но и уменьшает выраженность побочных эффектов доставляемых лекарств.
Таким образом, вышеизложенное является еще одним из ярких примеров того, как сотрудничество химии и медицины дает блестящие результаты в разработке и внедрении новейших технологий лечения различных заболеваний.
Супрамолекулярная химия
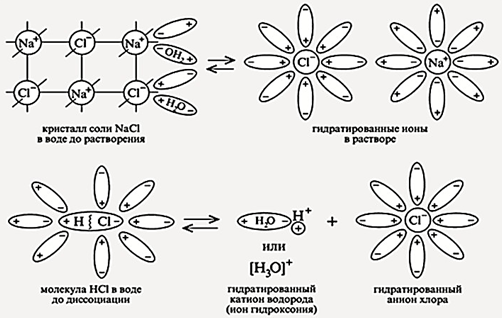
Супрамолекулярная (надмолекулярная) химия (Supramolecular chemistry) — междисциплинарная область науки, включающая химические, физические и биологические аспекты рассмотрения более сложных, чем молекулы, химических систем, связанных в единое целое посредством межмолекулярных (нековалентных) взаимодействий. Объекты супрамолекулярной химии — супрамолекулярные ансамбли, строящиеся самопроизвольно из комплементарных, т. е. имеющих геометрическое и химическое соответствие фрагментов, подобно самопроизвольной сборке сложнейших пространственных структур в живой клетке. Одной из фундаментальных проблем современной химии является направленное конструирование таких систем, создание из молекулярных «строительных блоков» высокоупорядоченных супрамолекулярных соединений с заданной структурой и свойствами. Супрамолекулярные образования характеризуются пространственным расположением своих компонентов, их архитектурой, «супраструктурой», а также типами межмолекулярных взаимодействий, удерживающих компоненты вместе. В целом межмолекулярные взаимодействия слабее, чем ковалентные связи, так что супрамолекулярные ассоциаты менее стабильны термодинамически, более лабильны кинетически и более гибки динамически, чем молекулы.
Согласно терминологии супрамолекулярной химии, компоненты супрамолекулярных ассоциатов принято называть рецептор (ρ) и субстрат (σ), где субстрат — меньший по размеру компонент, вступающий в связь. Термины соединение включения, клатрат и соединение (комплекс) типа гость—хозяин характеризуют соединения, существующие в твёрдом состоянии и относящиеся к твёрдым супрамолекулярным ансамблям.
Селективное связывание определённого субстрата σ и его рецептора ρ с образованием супермолекулы σρ происходит в результате процесса молекулярного распознавания. Если помимо центров связывания рецептор содержит реакционноспособные функциональные группы, он может влиять на химические превращения на связанном с ним субстрате, выступая в качестве супрамолекулярного катализатора. Липофильный, растворимый в мембранах рецептор может выступать в роли носителя, осуществляя транспорт, перенос связанного субстрата. Таким образом, молекулярное распознавание, превращение, перенос — это основные функции супрамолекулярных объектов.
Супрамолекулярную химию можно разделить на две широкие, частично перекрывающиеся области, в которых рассматриваются соответственно: 1) супермолекулы — хорошо определённые, дискретные олигомолекулярные образования, возникающие за счёт межмолекулярной ассоциации нескольких компонентов (рецептора и субстрата(ов)) в соответствии с некоторой «программой», работающей на основе принципов молекулярного распознавания; 2) супрамолекулярные ансамбли — полимолекулярные ассоциаты, возникающие в результате спонтанной ассоциации неопределённо большого числа компонентов в специфическую фазу, характеризуемую более или менее определённой организацией на микроскопическом уровне и макроскопическими свойствами, зависящими от природы фазы (плёнка, слой, мембрана, везикула, мезоморфная фаза, кристалл и т. д.).
Для описания расположения субстрата(ов) относительно рецептора используется специальный формализм. Внешние комплексы-аддукты могут быть обозначены как [A,B], или [A//B]. Для обозначения комплексов включения σ в ρ и частичного пересечения σ и ρ используются математические символы включения ⊂ и пересечения ∩ — [A⊂B] и [A∩B], соответственно. В современной химической литературе наряду с символом ∩ так же часто используется альтернативный символ @.
Впервые термин «супрамолекулярная химия» был введен в 1978 г. лауреатом Нобелевской премии Жаном-Мари Леном и определен как «химия, описывающая сложные образования, которые являются результатом ассоциации двух (или более) химических частиц, связанных вместе межмолекулярными силами». Последующие годы были отмечены взрывообразным развитием этой молодой междисциплинарной науки.
Супрамолекулярные клатраты
в промышленности и быту
Партитуру химии надо не просто исполнить,
ее надо сочинить!
Жан-Мари Лен
Сколько вы обычно носите в сумке или в кармане ключей? Наверняка, у вас есть ключ от внешней и внутренней дверей квартиры; скорее всего – от почтового ящика; ну а у тех, кто водит машину, еще, как минимум, найдется пара ключей. Но сколько бы их ни было, каждый ключ подходит только к строго определенному замку – в этом-то и заключается смысл существования ключа (и замка тоже). Оказывается, на аналогичном принципе «ключ – замок» основана способность биологических молекул к самоорганизации и селективному взаимодействию с другими частицами, называемая молекулярным распознаванием. Только благодаря этой способности возможно, например, образование двойных спиралей ДНК или возникновение – в ответ на попадание чужеродного тела в организм – иммунных реакций, заключающихся в синтезе специальных белков для нейтрализации «непрошенных гостей». Стремление исследователей реализовать такие процессы в искусственно созданных системах было настолько велико, что привело к формированию на рубеже 80. 90-х годов отдельной области химии, названной французским ученым, лауреатом нобелевской премии, Ж.-М. Леном супрамолекулярной химией.
Супрамолекулярная химия
Супрамолекулярная химия – раздел химии, описывающий сложные образования, которые являются результатом ассоциации двух и более химических частиц, связанных вместе межмолекулярными силами. Супрамолекулярная химия – химия молекулярных ансамблей и межмолекулярных связей.
Современная супрамолекулярная химия изучает процессы молекулярного распознавания и селективного связывания молекул в так называемые супрамолекулы и супрамолекулярные ансамбли. Супрамолекулы представляют собой отдельные крупные образования, состоящие из большого, но обязательно конечного числа молекулярных олигомеров. В то же время супрамолекулярные ансамбли, к которым относятся мембраны, везикулы, мицеллы, дендримеры, блоксополимеры, клатраты, являются полимолекулярными системами, возникающими в результате спонтанной ассоциации компонентов и обладающие определенной пространственной организацией, с которой часто связаны уникальные физико-химическими свойства.
Образование супрамолекул подразумевает комплементарность (геометрическую и химическую взаимодополняемость) составляющих ее элементов, называемых молекулярными рецептором и субстратом. Во всех супрамолекулярных системах рецептор (хозяин) содержит молекулярные центры (точно так же как замок – замочную скважину), нацеленные на селективное связывание определенного субстрата – «ключа» (или «гостя»).
Как и в обычной химии, для связывания молекул должны возникнуть определенные взаимодействия, за счет которых произойдет упорядочение в пространстве молекулярных блоков и сформируется супрамолекулярная «архитектура». Однако, в отличие от привычных нам молекул, в которых атомы объединены ковалентными или ионными связями, в супрамолекулах удерживание отдельных фрагментов происходит за счет невалентных межмолекулярных взаимодействий, к которым относятся водородные связи, электростатические силы, лиофильные и лиофобные взаимодействия.
Почему же супрамолекулярные системы не распадаются на составные части, спросите вы – ведь энергия таких взаимодействий на 1. 2 порядка ниже энергии валентных связей? Конечно, если подвесить тяжелый предмет на тонкой ниточке, то она обязательно порвется, однако если таких нитей будет много, нагрузка распределится между ними равномерно – получится прочный канат. Вот и в случае слабых связей в ансамблях, когда их становится много, это приводит к образованию устойчивых и вместе с тем гибко изменяющих свою структуру ассоциатов. Такое сочетание прочности и способности быстро и обратимо реагировать на внешние воздействия является характерной чертой всех биологических молекулярных систем – нуклеиновых кислот, ферментов, белков.
Однако супрамолекулярная химия далеко не ограничивается биологическими системами – аналогичные принципы действуют и при образовании неорганических комплексных соединений типа «гость – хозяин». К примеру, в случае краун-эфиров наличие кислородных центров дает возможность образования устойчивых комплексов с ионами металлов, селективность к которым строго определяется соответствием размера металла объему внутренней полости цикла.
Рис. 1. Супрамолекулярные соединения как «молекулярные сита»
Для супрамолекулярных систем важнейшим является принцип комплементарности: геометрическое, топологическое и зарядовое соответствие гостя и хозяина. Размер полости хозяина определяет размер «желанного гостя»; чем точнее соответствие «гость – хозяин», тем выше устойчивость ансамбля.
Область применения супрамолекулярных соединений
В настоящее время новая область неорганической химии – химия клатратов и соединений внедрения – активно развивается, внося огромный вклад, как в фундаментальные знания, так и в практические разработки новых материалов. Это обусловлено тем, что уже сегодня супрамолекулярные системы находят широкое применение в сорбции и селективном катализе, рассматриваются в качестве наиболее перспективных кандидатов для захоронения радиоактивных отходов и разработки лекарственных препаратов нового поколения. Так, если помимо центров распознавания и связывания рецептор содержит другие функциональные группы, то после образования супрамолекулярной системы он может выступать в роли носителя, осуществляя направленный транспорт связанного с ним субстрата в определенные области организма.
Рис. 2. Супрамолекулярные соединения как потенциальные кандидаты для водородных аккумуляторов
Одна из более «прагматичных» и приземленных областей применения супрамолекулярных соединений – термоэлектрические материалы, которые уже сейчас можно подержать в руках. Такие экзотические материалы, создаваемые отечественными учеными, могут произвести научную революцию и стать серьезной статьей дохода. К последнему вплотную подошла группа профессора Андрея Владимировича Шевелькова и его коллег из лаборатории направленного неорганического синтеза химического факультета МГУ, синтезирующих и исследующих супрамолекулярные клатраты, которые могут стать основой для термоэлектрических материалов нового поколения.
Фононное стекло, электронный кристалл
Над материалами, которые максимально могли бы охлаждать активный элемент, ученые работают столько, сколько существует полупроводниковая электроника – основа всех умных приборов. При этом от них пытаются добиться противоречащих друг другу требований – хорошей электропроводности и аномально низкой теплопроводности, чтобы тепло, похищенное у активного элемента электрическим током, отводилось в сторону и не возвращалось обратно.
О появлении по-настоящему мощных охлаждающих термоэлектрических материалов в науке заговорили после того, как в начале 90-х годов прошлого века появилась гипотеза американского ученого Слэка. Он не просто заявил о вероятности создания веществ с парадоксальными свойствами, но даже прописал механизм, по которому они могли бы работать.
Термоэлектрики такого уровня могли бы быть созданы на основе сложных химических соединений – супрамолекулярных ансамблей из атомов двух типов – «хозяев» и «гостей». Молекулы хозяина представляют собой решетку, построенную из прочных ковалентных связей. В ее пустотах располагаются подвижные атомы или молекулы гостя, способные колебаться внутри предназначенного для них объема. Их быстрое движение рассеивает фононы, которые служат проводниками тепла, тем самым, снижая теплопроводность. При этом поведение гостя никак не сказывается на электропроводности хозяина – ее обеспечивают электроны, перемещающиеся по ковалентным связям каркаса. Благодаря тому, что объединенные в один молекулярный ансамбль элементы действуют обособленно, появляется возможность оптимизировать свойства каждого из них. Тип таких веществ Слэк назвал фононным стеклом – электронным кристаллом. Однако, закинув удочку, он не дал главного ответа – какие вещества могли бы отвечать таким требованиям – и оставил химиков ломать голову над осуществлением этой замысловатой гипотезы.
Термоэлектрические клатраты. Настоящее и будущее
Как ни странно, ответ на загадку, брошенную американским физиком, был практически готов. Свойствам загадочного фононного стекла отвечали так называемые клатраты – соединения, существующие в природе, над изучением которых химики работали не один десяток лет. Правда, занимались они ими скорее из любопытства. Пытались понять, можно ли повторить их структуру, совмещая различные элементы. Самая первая попытка показала, что такие вещества получить вполне реально: первым подопытным стал щелочной металл натрий, заключенный в решетку из атомов кремния, за ним последовал йод, помещенный в клетку, которая состоит из олова и фосфора. Когда серия экспериментов удалась, ученые задумались над тем, какую выгоду можно извлечь из соединений нового типа.
Концепция нового класса материалов «фононное стекло, электронный кристалл» – вещества, которые могут проводить электричество так же хорошо, как кристаллический проводник, а тепло – так же плохо, как стекло (Слэк, 1995). Типичные свойства существующих полупроводниковых термоэлектрических клатратов:
- малая ширина запрещенной зоны – 0,05. 0,2 эВ;
- высокая электропроводность – до 700 (мОм·см) –1 при комнатной температуре;
- увеличение электропроводности с ростом температуры;
- высокая подвижность и концентрация носителей – до 2000 см 2 /В·с и 10 18 1/см 3 при комнатной температуре;
- высокие значения коэффициента Зеебека до 300 мкВ/К при комнатной температуре.
«О существовании клатратов мы знали, по поводу их свойств написано немало книг, – рассказывает профессор МГУ, доктор химических наук Андрей Шевельков. – Они повторяют по своему строению некоторые формы существования воды, льда, когда в нем находятся жесткозаключенные примеси. Скажем, те соединения, которые мы изучаем, часто похожи на залежи метана во льду на дне Мирового океана. В замороженном виде вода создает кристаллическую решетку, в которой и заключены молекулы метана».
Рис. 3. Локальное упорядочение структурных элементов в разупорядоченном клатрате по данным просвечивающей электронной микроскопии
(фото группы проф. А.В.Шевелькова)
Если в гидратах основу трехмерной кристаллической решетки составляют молекулы воды, то в полупроводниковых клатратах в ход идут атомы кремния, олова, германия, причем частично они могут быть заменены на непереходные элементы, например, алюминий или теллур.
«На самом деле, перспективными термоэлектриками являются полупроводниковые клатраты, а вовсе не привычные газовые гидраты. Особенностью полупроводниковых клатратов является то, что каркас всегда несет на себе электрический заряд. В большинстве соединений этот заряд отрицателен, то есть каркас служит полимерным анионом».
Естественно, для компенсации заряда необходимо присутствие катионов. Поэтому в качестве атомов-гостей в кристаллическую решетку «приглашают» щелочные металлы, за исключением лития, а также стронций, барий и европий. В том случае, если каркас заряжен положительно, то гостями-анионами служат галогены за исключением фтора, или теллур. В результате атомы гостя в клатратах размещены в пустотах каркаса хозяина таким образом, что имеют очень много соседей на больших расстояниях. Следовательно, их позиции в центре клатратного полиэдра не слишком хорошо фиксированы, и эти атомы получают возможность двигаться внутри ограниченного объема. Колебательное движение происходит с определенной частотой, которая совпадает с частотой распространения фононов – носителей тепла. При этом происходит резонансное рассеяние фононов, и тепло перестает распространяться по кристаллическому твердому телу, как если бы это было стекло.
Чтобы синтезировать столь сложное по структуре и свойствам вещество, одних химических реакций недостаточно – требуется учитывать много факторов, воспроизводить уникальную среду для взаимодействия элементов. Наши специалисты держат свои методы в секрете.
«В мире насчитывается порядка семи научных групп, которые занимаются этим классом веществ, три из них работают в США. У каждой группы свои методы работы, каждая работает с определенными веществами. Однако нам есть, чем гордиться – на сегодняшний день мы достигли лучших показателей по уменьшению теплопроводности полупроводников, а это важный шаг на пути к созданию эффективного материала».
Рис. 4. Теплопроводность некоторых искусственно полученных клатратных соединений (слева). Термоэлектрическая добротность катионных клатратов (справа)
Мерой эффективности термоэлектрических материалов является безразмерный показатель добротности, который в частности зависит от соотношения электропроводности и теплопроводности. Из большого набора соединений, доступных на сегодняшний день отечественным специалистам, по крайней мере, три имеют значения теплопроводности, в три с половиной раза меньшие (лучшие), нежели любой из коммерчески используемых материалов. Если же эти вещества, которые внешне представляет собой мало чем интересный серый порошок, удастся довести до ума и превратить в материал, то вполне можно ожидать революции на рынке полупроводников.
Сегодня полупроводники – востребованный и многоликий «товар». По данным Ассоциации полупроводниковой промышленности, мировые продажи полупроводников только за два первых месяца этого года превысили 40 миллиардов долларов. Что, впрочем, неудивительно. Термоэлектрические материалы применяют для охлаждения процессоров в современных ноутбуках и компьютерах, а потому даже небольшой прогресс в этой области сулит серьезную выгоду.
Что говорить о супрамолекулярных клатратах, которые при их превращении в полноценный материал могут произвести революцию. Для начала может появиться новая область техники – супрамолекулярная электроника. То есть полупроводники нового поколения смогут охлаждать активный элемент настолько, чтобы в ход шли сверхпроводники – а значит, скорости, с которыми работают современные машины, возрастут в разы.
Супрамолекулярным клатратам найдется применение и в быту. Дело в том, что термоэлектрические материалы уже применяют в портативных холодильниках. Однако они не способны охлаждать крупные камеры, так что по старинке в бытовых и промышленных холодильниках используют хладагенты. Они же, по словам экологов, наносят существенный вред окружающей среде, разрушают озоновый слой со всеми вытекающими отсюда глобальными потеплениями. Заменив хладагенты полупроводниковыми охлаждающими элементами, мы получим надежные, экологически безопасные, да к тому же тихие холодильники, поскольку компрессор в этом случае тоже не понадобится.
Супрамолекулярная (надмолекулярная) химия
Супрамолекулярная (надмолекулярная) химия — междисциплинарная область науки, включающая химические, физические и биологические аспекты рассмотрения супрамолекулярные ансамблей — более сложных, чем молекулы, химических систем, строящихся самопроизвольно и связанных в единое целое посредством межмолекулярных (нековалентных) взаимодействий.
Думается, в надмолекулярную химию (ее также можно назвать нековалентной химией), можно объединить дисциплины, которые изучают химические и физические свойства многоатомных (или малоатомных в особых условиях) частиц с нековалентными связями, а именно:
- структуры из нескольких или многих молекул и характер связей между ними;
- в какие структуры объединяются молекулы и как они взаимодействуют;
- виды структур и свойства вещества с различными видами структур.
Разделы страницы о нековалентной (надмолекулярной) химии:
- Надмолекулярные соединения (основные классы)
- Химия кристаллов (кристаллохимия)
- Феноменальные превращения веществ в особых условиях
- Химия и топология водных структур (взаимодействие микроструктур воды)
- Нанохимия (какие превращения происходят в наночастицах)
Также смотрите тематически похожие страницы о биохимии и производстве нефтепродуктов.
Надмолекулярные соединения
Основные классы надмолекулярных соединений:
- Рецепторы:
- Кавитанды
- Криптанды
- Каликсарены
- Комплексы типа гость-хозяин
- Ротаксаны
- Катенаны
- Ансамбли:
- Мицеллы
- Везикулы
- Мембраны
- Жидкие кристаллы
- Клатраты
- Интеркалаты
Химия кристаллов (кристаллохимия)
Кристаллохимия — это наука о кристаллических структурах и их связи с природой вещества. Она тесно связана с кристаллографией и изучает пространственное расположение и химическую связь атомов в кристаллах, а также зависимость физических и химических свойств кристаллических веществ от их строения.
С помощью рентгеноструктурного анализа, структурной электронографии и нейтронографии кристаллохимия определяют абсолютные величины межатомных расстояний и углы между линиями химических связей (валентные углы). Кристаллохимия располагает обширным материалом о кристаллических структурах более 425 тысяч соединений, более половины из которых составляют неорганические соединения.
В задачи кристаллохимии входит:
- систематика кристаллических структур и описание наблюдающихся в них типов химической связи;
- интерпретация кристаллических структур (выяснение причин, определяющих строение того или иного кристаллического вещества) и их предсказание;
Феноменальные превращения веществ в особых условиях
Скачкообразное изменение структуры, физических и химических свойств простых веществ в экстремальных физических условиях (критических давлениях и температурах), приводящее к новым видам взаимодействий и связей, в т.ч. со звуковыми квазичастицами — фононами, которые образуются при ангармонических колебаниях атомов в условиях высокого давления.
Примеры феноменальных превращений веществ:
- Металлический водород
- Сверхпроводимый сероводород
- .
Химия и топология водных структур (взаимодействие микроструктур воды)
[Это направление исследований необычных свойств воды можно было бы назвать по-разному, например: водная феноменология, микроструктурная гидрология, аквахимия, аквистика, гидроморфология, гидрохимия. ]
- Опровергнута самая популярная теория строения воды. [16.04.2019]
Статьи Смирнова А.Н. об эмулонной структуре и необычных свойствах воды
Александр Николаевич Смирнов — профессор Московского государственного института радиотехники, электроникии и автоматики (технический университет — МИРЭА). Область научных интересов: композиционные материалы, источники энергии, физика воды. Можете взять zip-архив с некоторыми статьями Алесандра Николаевича об исследованиях водных микроструктур — эмулонов.
Для воды характерна ярко выраженная способность к самоорганизации вследствие образования водородных связей. Структура жидкой воды была предметом обширных исследований. Предложенные теории удовлетворительно объясняют только часть наблюдаемых явлений и противоречат друг другу. Оптическими методами обнаружены водные надмолекулярные комплексы в тщательно очищенной воде с размерами от 1 до 100 мкм, которые распределенны в «континуальной» жидкой среде. Учитывая храктерные свойства надмолекулярных образований, для них наиболее подходит название «эмулоны».
- Структура воды: новые экспериментальные данные. Кандидат химических наук Александр Смирнов, профессор МИРЭА. «Наука и жизнь», № 10 2011.
- Эмулоны и образование солитонов в дистиллированной воде. А.Н. Смирнов, А. В. Савин, академик А.С. Сигов (МГТУ МИРЭА). [MS Word 210K]
- Структура воды — эмулоны. А.Н. Смирнов. [MS Word 2M]
- Генерация электрических и акустических колебаний в воде магнитными и электрическими полями. А.Н. Смирнов, 2014. [PDF 470K]
- Причина гомохиральности биомолекул. А.Н. Смирнов. [PDF 675K]
Нанохимия (какие превращения происходят в наночастицах)
Нанохимия исследует свойства, строение и особенности химических превращений наночастиц. Отличительной особенностью нанохимии является наличие размерного эффекта — качественного изменения физико-химических свойств и реакционной способности при изменении числа атомов или молекул в частице. Обычно данный эффект наблюдается для частиц размером меньше 10 нм, хотя данная величина имеет условное значение.
На основе нанохимии разиваются нанотехнологии, которые рассматриваются в разделе материаловедения.
На правах рекламы (см. условия): ◀ ◀ ◀ Место для размещения коммерческих ссылок (см. , пожалуйста, условия) ▶ ▶ ▶ —>
Что такое супрамолекулярная химия
Супрамолекулярная химия. Такое название получила наука, родившаяся в последней четверти XX в. на стыке многих областей знания: органической, физической, координационной химии, биологии, физики, материаловедения, микроэлектроники. У нее уникальный спектр возможностей для создания новых материалов различного назначения.
Сам термин введен французским химиком, лауреатом Нобелевской премии 1987 г. Жаном Мари Леном и определен им как «. химия за пределами молекулы, описывающая сложные образования, которые являются результатом ассоциации двух (или более) химических частиц, связанных вместе межмолекулярными силами».
Если в классической химии изучают молекулы, то всупрамолекулярной — супермолекулы и их ансамбли. Они имеют определенную архитектонику и строятся самопроизвольно из комплементарных (т. е. обладающих геометрическим и химическим соответствием) фрагментов, подобно спонтанной сборке сложнейших пространственных структур в живой клетке. Подбор условий для такой сборки за счет перегруппировок молекул в бесконечно разнообразные комбинации и структуры приводит к материалам с новыми интересными свойствами. Работы в этом направлении активно ведутся в Институте неорганической химии им. А.В. Николаева (ИНХ) СО РАН.
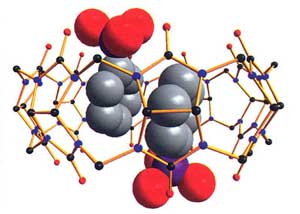
В числе важнейших объектов нашего интереса — два класса соединений: пористые металл-органические координационные полимеры (Координационные полимеры — химические соединения сложной структуры, построенные из чередующихся в пространстве атомов металла, связанных через органические фрагменты (прим. авт.). и молекулярные контейнеры, обладающие сходными особенностями. В структуре тех и других присутствуют поры или свободное (координационное) пространство, которое может быть «незаселенным» или, наоборот, занятым «гостями» (небольшими органическими молекулами или ионами), — в этом случае происходит образование соединений включения (Соединения включения (клатраты) — вещества, в которых молекулы соединения-«хозяина» образуют пространственный каркас, а молекулы соединения-«гостя» располагаются в полостях каркаса (прим. ред.). Известно, что последние играют важнейшую роль в самых разнообразных процессах: дыхании и регенерации кислорода растениями, ферментативном катализе, анестезии, формировании колоссальных залежей природного газа на дне Мирового океана (газовые гидраты). В отличие от кристаллических координационных полимеров, в составе которых множество высокоупорядоченных свободных пространств, в молекулярных контейнерах содержится только одна внутренняя полость. Каковы же свойства этих необычных структур?Меняя химический состав этих соединений (т. е. одни металлы и органические фрагменты на другие), химики научились направленно получать одномерные цепочки, двухмерные сетки, а также трехмерные, напоминающие по внешнему виду строительные леса, каркасы. Используя органические лиганды (Лиганды — в комплексных соединениях молекулы или ионы, связанные с центральным атомом (прим. ред.) различной длины (от долей одного до нескольких нанометров), можно выстраивать ажурные структуры с регулярно расположенными пустыми полостями заданного наноразмера и формы, иначе говоря, их можно проектировать в зависимости от конкретного предназначения пористого металл-органического каркаса. Недавно профессор Жерар Фере из Университета Версаль (Франция) получил такое соединение — терефталат хрома — с рекордной удельной поверхностью (Удельная поверхность — усредненная характеристика размеров внутренних полостей (каналов, пор) пористого тела. Выражается отношением его обшей поверхности к объему или массе (прим. ред.). 5900 м2/г, что выше, чем у наноуглеродных материалов, а также на порядок превышает удельную поверхность широко используемых в различных областях природных сорбентов-цеолитов. Полости в данных конструкциях составляют всего несколько нанометров, однако столь малые размеры не мешают им сохранять пористость неограниченно долго.
В этих удивительных полимерах вполне достаточно места для размещения «гостей» — атомов металла, по команде химиков входящих в поры и покидающих их. Самая перспективная область применения рассматриваемых материалов — сорбция молекул разного размера: от маленьких (характерных для газов) до больших (например, лекарственных препаратов).
Проблема хранения и транспортировки значительных объемов газов важна для метана и, особенно, водорода. Основанная на нем энергетика вместе с аккумулирующими его топливными элементами призвана решать проблемы не только безопасности и надежности поставок горючего, но и снижения выбросов парниковых газов. Так, согласно докладу Еврокомиссии, уже в 2020 г. в странах ЕЭС запланировано довести долю альтернативных видов топлива в автомобильном транспорте до 20%, ведь ныне именно он является одним из основных источников выбросов С02 в атмосферу. Однако в отличие от жидких бензина или керосина водород в обычных условиях — легколетучий газ с очень маленькими удельными значениями энергии на единицу объема. Отсюда следует необходимость создания его эффективного носителя (аккумулятора). В настоящее время рассматриваются несколько перспективных подходов, в том числе использование баллонов высокого давления, сжижения, металлических гидридов, пористых наноуглеродных сорбентов. Но, к сожалению, из имеющихся на сегодня носителей Н2 пока ни один в полной мере не удовлетворяет всем предъявляемым требованиям.
Совсем недавно в качестве высокопористого сорбента для хранения водорода предложены металл-органические координационные полимеры. Их высокие показатели обусловливаются рекордными значениями внутренней удельной поверхности: площадь целого футбольного поля может уместиться всего в 1 г такого материала! Другое их преимущество — возможность функциональной модификации внутренней структуры для создания оптимальных условий размещения Н2. С момента первых сообщений об экспериментах такого рода, проведенных в 2003 г. профессором Омаром Яги из Мичиганского университета (США), активность исследователей в этой перспективной области выросла многократно. В настоящее время в научной литературе сообщено о достижении 7,5 масс. % содержания водорода в пористых металл-органических решетках, что не только превышает аналогичные показатели для большинства альтернативных носителей, но и приближается к 12 масс. %; именно такой уровень, согласно оценкам компании General Motors (США), — одно из условий экономической и технологической целесообразности применения водорода в качестве автомобильного топлива.
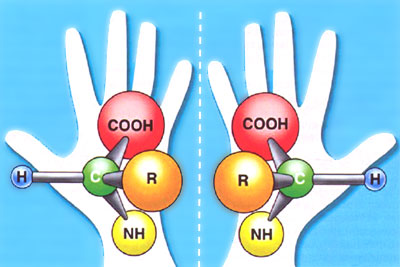
Другая важнейшая область использования пористых металл-органических полимеров — синтез и тонкая очистка сложных биологически активных молекул, в том числе хиральных оптических изомеров. Напомним: хиральность — свойство объекта быть несовместимым со своим изображением в зеркале. Два таких отражения называются оптическими изомерами. И тенденции развития современной мировой химической, фармацевтической, парфюмерной промышленности определяют растущую потребность в получении оптически чистых хиральных соединений. Так, значительная часть лидирующих по реализации современных лечебных препаратов соответствует этим критериям. К примеру, объем мировых продаж S-омепразола, применяемого для лечения язвенной болезни, в 2006 г. превысил 4,2 млрд дол. США. Кроме того, немаловажно, что, как правило, биологической активностью обладает лишь один оптический изомер, в то время как второй может оказаться ядом, канцерогеном или мутагеном. Вот почему требования к оптической чистоте препаратов постоянно растут, и производители лекарств вынуждены разрабатывать новые эффективные приемы разделения сложных органических молекул.
В нашем Институте совместно с Институтом катализа им. Г.К. Борескова СО РАН предложены методы синтеза пористых координационных полимеров на основе легкодоступных оптически чистых природных веществ. Образующиеся при этом продукты сами хиральны и в последующем применимы для тонкого селективного разделения других аналогичных соединений. Пористые координационные полимеры могут служить и нанореакторами, в которых протекают уникальные каталитические превращения.
Кстати, до наших работ были известны лишь несколько таких хиральных полимеров. Причем для их синтеза нужны сложные лиганды, сочетающие оптическую чистоту и конформационную (пространственную) жесткость. Но число последних ограничено, их получение — трудная задача. Мы же предложили использовать в этих целях комбинацию двух органических лигандов. Один из них имеет в своей структуре хиральные центры, другой придает ей жесткость и пористость. При этом, меняя длину лиганда жесткости, регулируем размер и форму пор внутри каркаса, не вмешиваясь в его топологию (геометрическую форму). Используя же различные лиганды, можно менять строение хиральных центров в каркасе и добиваться улучшения характеристик материалов для решения конкретных задач.
Еще одно преимущество нашего подхода — применение достаточно простых природных и потому легкодоступных соединений в качестве необходимых строительных блоков. Например, синтезированные нами хиральные пористые координационные полимеры являются новыми материалами для практического использования в разделении на оптические изомеры производных сульфоксидов — предшественников оптических изомеров лекарственных форм. В числе последних противоопухолевый препарат оксисуран, противовоспалительный —сулиндак и др. Более того, нами впервые продемонстрирована возможность количественного разделения изомеров методом так называемой колоночной хроматографии, при котором разделение смеси на отдельные компоненты происходит по мере ее движения вдоль колонки с сорбентом (за счет различной скорости движения компонентов).
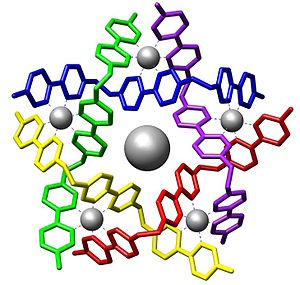
Среди молекулярных контейнеров, изучаемых в нашем Институте, — кукурбитурилы. Свое название они получили в связи с внешним сходством их формы с тыквой (род Cucurbitaceae). Действительно, строение этой интересной молекулы — C6nH6nN4n02n (n = 5 — 10) — напоминает тыкву или бочку, по верхнему и нижнему ободу которой (т. е. в областях дна и крышки) располагаются атомы кислорода сильно поляризованных карбонильных групп (порталы). Соединение впервые получил немецкий химик Роберт Беренд в 1905 г. Детальное же определение состава и структуры с помощью рентгеноструктурного анализа в 1981 г. американскими химиками Вэйдом Фриманом и Вильямом Мокком спровоцировало бурное развитие химии молекулярных контейнеров.
Что же делает кукурбитурилы привлекательными для исследователей, какие свойства позволяют считать их способными составить в ближайшее время конкуренцию, допустим, используемым в промышленности циклодекстринам (Циклодекстрины — макроциклические соединения углеводной природы. Применяются для улучшения качества и длительности хранения пищевых продуктов, очистки воздуха, почв и воды от загрязняющих ядовитых веществ и др. (прим. ред.) ?
Размеры внутренней полости «бочки» достаточны для включения небольших молекул или ионов, а порталы имеют некоторый отрицательный заряд и способны образовывать ассоциаты с положительно заряженными частицами. Остановимся подробнее на этих двух факторах, сочетание которых обеспечивает уникальные свойства молекулярных контейнеров и вызывает постоянно растущий интерес к ним не только химиков, но и специалистов из многих других отраслей науки.
Обладая довольно большой внутримолекулярной полостью, кукурбитурилы выступают в роли «хозяев», образуя соединения включения с подходящими по размеру «гостями». Супермолекулы формируются за счет нековалентных взаимодействий «гостя» с гидрофобной полостью «хозяина». Ныне известен достаточно широкий набор молекул и ионов, прекрасно подходящих по размерам и заполняющих практически все пространство полости, что способствует образованию устойчивых соединений с представителями всего ряда кукурбитурилов.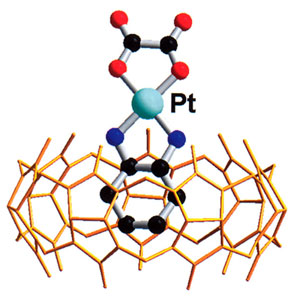
Большие по размеру «контейнеры» (n > 7) способны впускать в полость даже две объемные органические молекулы. Такие «гости» находятся на близком расстоянии и в определенном пространственном положении. Это обстоятельство позволяет использовать подобные системы в качестве молекулярного синтетического «сосуда» (нанореактора), в котором осуществляется химическое взаимодействие между специально подобранными «гостями».
Включение небольшого по размерам (n=5) контейнера во внутреннюю полость большого (n=10) приводит к уникальному соединению — молекулярному аналогу гироскопа. По данным ядерно-магнитно-резонансной спектроскопии, в растворе происходит свободное вращение макроциклов относительно друг друга. Пример еще одного устройства — молекулярный переключатель: в нем по команде химиков, допустим, при изменении кислотности раствора, контейнер направленно перемещается. В молекулярном масштабе это соответствует механическим процессам макроскопического уровня, и представляется возможным создать молекулярные «машины», приводимые в действие путем изменения химических условий. Существует огромный интерес к созданию таких «машин» как основы для развития молекулярных компьютеров и других устройств, по своим функциям приближающихся к биологическим системам.
Изучение включения «гостей» в полость молекулы «хозяина» представляет интерес не только с научной точки зрения. Оно вносит вклад и в решение проблемы транспорта веществ, в том числе лекарств. Известно, что при лечении раковых заболеваний эффективны комплексы платины. Включение их в кукурбитурилы перспективно при создании нового поколения фармацевтических препаратов пролонгированного действия (постепенное высвобождение активного компонента лекарства из полости макроцикл ического «хозяина», выполняющего функцию транспорта и хранения). На сегодня уже доказана противораковая активность соединений включения в кукурбитурилы (n =7 и n =8) ряда платиновых комплексов.
Еще одно интересное направление — получение супрамолекулярных комплексов «гость-хозяин» с участием спиновых зондов, роль которых играют стабильные нитроксильные радикалы, обладающие парамагнитными свойствами. Их широко используют в биофизических и биомедицинских исследованиях с применением электронного парамагнитного резонанса. К сожалению, под воздействием биогенных антиоксидантов или ферментов эти зонды восстанавливаются до диамагнитных (не определяемых с помощью электронного парамагнитного резонанса) соединений. Недавние наши эксперименты показали: включение нитроксильных радикалов во внутреннюю полость кукурбитурилов позволяет избежать химического взаимодействия спиновых зондов с восстанавливающим микроокружением, тем самым обеспечив сохранение их работоспособности.
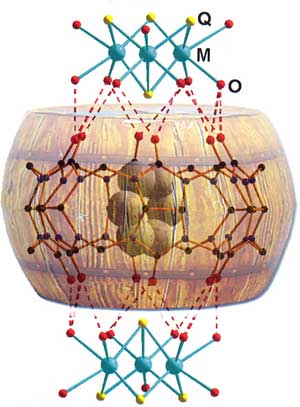
Обратимся теперь к упомянутой выше способности этих макроциклов формировать ассоциаты с положительно заряженными частицами благодаря отрицательному заряду на атомах кислорода порталов. Образующиеся структуры представляют собой «бочку», закрытую одной или двумя «крышками» — аквакомплексами металлов. Наиболее яркий пример подобных ансамблей — соединения кукурбитурила с кластерами молибдена или вольфрама [M3Q4(H20)9]4+ (M=Mo, W; Q=S, Se). Шесть молекул воды образуют водородные связи с тем же числом атомов кислорода. Эта система служит прекрасным «контейнером» для надежного удержания «гостей», которые вправе покидать его только при открытых «крышках». Изменяя экспериментальные условия, мы можем контролировать формирование и разрыв водородных связей, удерживающих «крышки» в закрытом положении. Увеличивая, например, концентрацию соляной кислоты, заменяем атомами хлора молекулы воды аквакомплекса, ответственные за образование водородных связей. Когда последние рушатся, «крышки» открываются, и «гость» покидает полость. Если условия реакции изменить так, чтобы молекулы воды заняли места атомов хлора, то опять получатся супрамолекулярные соединения, в которых «крышки» закрывают «бочку».
Развитие исследований обратимого включения «гостей» в полость молекулы «хозяина», а также возможностей использования различных «контейнеров» для доставки целевых молекул — одно из приоритетных направлений современной фармакологии. За счет взаимодействия «гость — хозяин» можно помещать в полости молекулярных контейнеров биологические и синтетические лекарственные препараты (пептиды, олигонуклеотиды, аминокислоты, антигены, антибиотики, цитостатики и др.), избирательно доставлять их в клетки, ткани и органы человека, и в определенный момент открывать «крышки», чтобы лекарство в заданном месте и в нужное время оказывало терапевтический эффект.
Подводя итог сказанному, еще раз подчеркнем: супрамолекулярная химия становится все более мощным инструментом направленного получения функциональных материалов, имеющих перспективы самого широкого применения.
Доктор химических наук Владимир ФЕДИН, директор Института неорганической химии им. А.В.Николаева СО РАН,
кандидат химических наук Ольга ГЕРАСЬКО, старший научный сотрудник того же Института,
кандидат химических наук Данил ДЫБЦЕВ, научный сотрудник того же ИнститутаМолекулы без химических связей
В школе мы учили на уроках химии, что атомы в молекулах удерживаются химической связью: ковалентной полярной, ковалентной неполярной. Бывает ионная связь — в кристаллах, бывают связи двухцентровые и многоцентровые. А можно ли построить классическую молекулу, например органического вещества, без химической связи? Как ни странно, правильный ответ на этот вопрос «отчасти — да». Бывают молекулы, разные части которых удерживаются исключительно механически. Но обо всём по порядку.
Супрамолекулярная химия
Можно сказать, что такие молекулы, где одна часть удерживается в другой чисто механически, случайно синтезировал в 1967 году сотрудник компании DuPont Чарльз Педерсен. Он получил ставшие знаменитыми краун-эфиры, которые как корона «надеваются» на большой ион щелочного металла и образуют устойчивые комплексы. Однако, конечно, несмотря на Нобелевскую премию по химии 1987 года, которую получил Педерсен, назвать совсем механической такую связь нельзя — взаимодействие в комплексе происходит между атомами кислорода или азота и щелочными металлами.

Чуть более жесткими эти комплексы сделал второй лауреат того же года — Жан-Мари Лен, создавший криптанды. Его вещества были уже не короной, а целой чашкой — ровно на один или два иона. Тем не менее взаимодействие между гостем и хозяином в комплексе было все еще не только механическим. Однако именно Лен дал название науке, которая занимается подобными веществами, супрамолекулярная химия — «химия, вышедшая за пределы молекулы».
Сделать то, о чем мы говорим, смог третий лауреат 1987 года, Дональд Джеймс Крам, который, развивая идею комплексов «гость–хозяин», создал новый тип молекул — карцеранды. Эта органическая молекула представляет собой «клетку», «карцер», внутри которого заключена другая молекула, будь то большой атом инертного газа или, скажем, маленькая молекула органического вещества.


Однако хочется чего-то большего: в карцеранде части молекулы неравноправны, одна «спрятана» внутри другой. Можно представить себе еще более восхитительные варианты. Существует целых четыре типа молекул с настоящей механической связью, и все они были синтезированы в лабораториях. Для них даже была придумана общая аббревиатура MIMA. В переводе на русский — «механически запертые молекулярные архитектуры» (mechanically interlocked molecular architectures).
Вот эти четыре типа: катенаны, ротаксаны, молекулярные узлы и молекулярные кольца Борромео. Все эти молекулы отличает то, что их части удерживает вместе исключительно механическое взаимодействие — физическое соприкосновение частей не дает им распасться или изменить взаимоположение. Давайте посмотрим, что это за молекулы.
Катенаны

Первыми из этой великолепной четверки были синтезированы катенаны. Латинское слово «catena» означает «цепь»
Действительно, катенаны — это два или более замкнутых цикла, продетых друг в друга.
Первые синтезы катенанов представляли собой реакции циклизации длинных цепочек в присутствии других кольцевых молекул. Надеялись лишь на случай: вдруг какая-то часть молекул во время замыкания циклов окажется продетой в уже существующий цикл. Однако выходы таких реакций всегда оказываются микроскопическими.
Поэтому Готфридом Шиллом, первопроходцем этой темы, был разработан направленный метод синтеза, когда сперва будущие кольца соединены перемычками, а после того как два или три звена цепочки колец собраны, перемычки разрушались. Первый [2]-катенан (два продетых друг в друга кольца) получилось «построить» еще до синтеза первых краун-эфиров, в 1964 году. В 1969 году появился и [3]-катенан. Опять же трудами Шилла.
За последующие годы прогресс в синтезе катенанов оказался огромным. К примеру, сэр Джеймс Фрезер Стоддарт (получивший рыцарское звание за свои успехи в органическом синтезе) в 1994 году сумел соединить, подобно известной эмблеме, пять колец. Разумеется, этот [5]-катенан назвали «олимпиаданом». А рекордное количество звеньев в таких цепочках пока что равно семи.
Кроме того, появились новые типы катенанов: претцеланы, в которых кольца продеты друг в друга, но еще и соединены молекулярным мостиком. Также синтезированы «катенаны в форме наручников» (вполне официальное название — handcuff-shaped catenanes). Почему они так названы, можно понять, посмотрев на их топологию.
Кстати, существуют катенаны и в природе — молекулярным биологам давно известны катенановые ДНК.
Ротаксаны

Ротаксан. Это название образовано из двух слов: rotor — «вращение» и axis — «ось»
Такие молекулы представляют собой длинную молекулярную цепочку, продетую сквозь цикл. Однако соскользнуть с оси циклу мешают массивные группы атомов на концах цепи. Пионером здесь тоже оказался Готфрид Шилл — первый направленный синтез ротаксана он провел еще в 1968 году.
Сейчас именно ротаксаны стали объектом пристального внимания и биологов, и нанотехнологов. Современные ученые рассматривают такие структуры как элементы молекулярных машин — уже построены ротаксановые молекулярные переключатели, «молекулярные мышцы», которые позволяют осуществлять механическое движение частей молекул и на их основе строить самые маленькие нанороботы. Кроме того, молекулярные биологи уже обнаружили аналоги ротаксанов в природе — на ротаксановом принципе построено действие так называемых лассо-пептидов, которые обхватывают свою цель, стягивая цикл. Среди таких пептидов обнаружены и новые антибиотики.
Молекулярные кольца Борромео
Простые кольца Борромео видели все, хотя и не знали, что они так называются. Это просто три кольца, попарно продетые друг в друга. Термин происходит от названия браслета, принадлежавшего итальянскому аристократическому семейству Борромео.

Сравнительно недавно химики научились синтезировать и такие молекулы. Вот, посмотрите на структуру. В 2004 году Джеймс Фрезер Стоддарт сумел путем красивой сборки из 18 компонентов получить эту сложную молекулу. Годом позже знаменитая медиакомпания Thomson Reuters даже предрекала Стоддарту Нобелевскую премию по химии по совокупности умопомрачительных синтезов, но пока что это предсказание не сбылось.
Молекулярные узлы
Здесь все просто: молекула представляет собой неразрывную замкнутую структуру, к тому же завязанную в узел. Химики называют такие молекулы кнотанами — от английского слова knot — «узел».

Органики научились синтезировать и такое, и даже несколько узлов одновременно. Первый узел в форме трилистника был синтезирован французским химиком Жаном-Полем Саважем в 1989 году.
Существуют и биологические «узлы». Среди них — достаточно важный человеческий гликопротеин лактоферрин, который встречается в молоке, слезах и других выделениях человека.
Супрамолекулярная химия
Супрамолекулярной химией называют раздел, описывающий сложные образования, которые являются результатом ассоциации двух и более химических частиц, связанных вместе межмолекулярными силами. Иными словами, супрамолекулярная химия – это химия молекулярных ансамблей и межмолекулярных связей. Основоположник этой науки лауреат Нобелевской премии французский ученый Жан-Мари Лен в 1978 г ввел термин «супрамолекулярная химия», определяя его как «химия за пределами молекулы». В 1987 году Ж.-М. Лен был удостоен Нобелевской премии по химии(совместно с Ч.Дж. Педерсоном и Д.Дж. Крамом) «за разработку и применение молекул со структурно-специфическими взаимодействиями с высокой селективностью». Примерами супрамолекулярных ансамблей служат соединения включения, клатраты, биядерные и полиядерные криптаты. Компоненты супрамолекулярных систем принято называть рецепторами и субстратами, где субстраты (гости) – меньшие по размеру компоненты, вступающие в связь. Внутри рецептора (хозяина) и субстрата (гостя) существуют ковалентные связи, а между ними – слабые межмодекулярные взаимодействия. Важную роль в таких системах играет принцип комплементарности, предполагающий геометрическое, топологическое и зарядовое соответствие гостя и хозяина.
Супрамолекулярная химия изучает:
1) Особенности нековалентных взаимодействий и структур возникших на их основе
2) Принципы образования супрамолекулярных ансамблей и их устойчивость
3) Свойства и возможности применения супрамолекулярных ансамблей
Селективное связывание субстрата и рецептора с образованием макромолекулы происходит в результате молекулярного распознавания. Оно осуществляется путем межмолекулярного взаимодействия субстрата и рецептора. Возникающий в результате этого супрамолекулярный ансамбль обладает функциями распознавания, трансформации и переноса. Рецептор может выступать и в роли носителя, осуществляющего транспорт связанного субстрата. Принцип самосборки супрамолекулярных структур из отдельных компонентов, приводящий к супрамолекулярным устройствам, образно уподобляют сборке бытовых приборов из различных составных частей.
Объектами изучения супрамолекулярной химии служат комплексы металлов с краун-эфирами, криптандами, каликсаренами, а также катенаны и ротаксаны. Примером молекулы, изменяющей свою конформацию под действием света, служит азобензол, содержащий циклические полиэфирные группы. Известно, что краун-эфиры эффективно координируют ионы щелочных металлов, а азосоединения под действием света изомеризуются из транс-формы в цис. Согласованное действие света и введения катиона щелочного металла приводит к существенному изменению конформации молекулы, которая изгибается ,захватывая ион металла, аналогично пинцету. Супрамолекулярные устройства, разработанные на этом принципе, предложены для контроля скорости транспорта различных ионов через мембраны.
Катенаны – циклические молекулы, составленные из двух колец, одетых одно на другое. Примером служит цикл, содержащий три пиридильных фрагмента, фрагмент фенантролина и группировку, под действием света легко переходящую в возбужденное состояние, то есть выполняющую роль антенны. В исходной частице ион меди(I) координирован двумя молекулами фенантролина двух колец, образующими тетраэдр. При фотохимическом окислении меди до Cu(II) происходит вращение одного кольца таким образом, что атом меди оказывается координирован тремя атомами азота пиридиновых фрагментов и одной молекулой фенантролина. При восстановлении меди до +1 молекула приобретает исходную конформацию. Такого рода системы, существующие в двух различных состояниях, взаимопревращающихся под действием света или электрического поля, в будущем могут быть использованы для хранения информации в двоичных кодах, в качестве сенсоров, молекулярных «выключателей» и других типов супрамолекулярных устройств.
Ж.-М. Лен, Супрамолекулярная химия, Новосибирск, Наука, 1998
Неорганическая химия (под редакцией Ю.Д. Третьякова), том 3. А.А. Дроздов, В.П. Зломанов, Г.Н. Мазо, Ф.М. Спиридонов, Химия переходных элементов, книга 2, М., Академия, 2008, с. 246.