ЛЕЧЕНИЕ
д.м.н., профессор РАН, онколог, хирург, президент Российского общества специалистов по опухолям головы и шеи, заведующий отделением опухолей головы и шеи клинического госпиталя «Лапино», председатель Проблемной комиссии по опухолям головы и шеи при РАН
Как лечат рак щитовидной железы?
В чем отличие лечения рака щитовидной железы от других раков?
Рак щитовидной железы сильно отличается в тактике лечения от других видов рака, например, от рака слизистой оболочки полости рта. Что важно? Для этого вида рака очень важно выполнить на первом этапе правильное хирургическое вмешательство, выполнить радикальную операцию, потому что этот рак не поддается никакому другому виду локального лечения: это не химиотерапия, не лучевая терапия, к которым он фактически не чувствителен.
Рак щитовидной железы чувствителен к проведению терапии радиоактивным йодом, но при условии, что такому пациенту выполнена тиреоидэктомия, то есть полное удаление тканей щитовидной железы. Это связано с
биологическими особенностями этого вида терапии, которая рассчитана на то, что радиоактивный йод, попадая в организм человека, будет накапливаться опухолевыми клетками избирательно в организме там, где они существуют, например, в легких, если они метастазируют в легкие. Они избирательно накапливают радиоактивный йод, который при избыточном накоплении разрушает опухолевые клетки как бы изнутри.
Для того чтобы этот механизм реализовался, необходимо удалить всю щитовидную железу для того, чтобы она сама по себе не накапливала избирательно радиоактивный йод в организме и тем самым не снижала эффективность в отношении отдаленных очагов.
Насколько протоколы лечения в России соответствуют мировым тенденциям?
На сегодня в России применяются современные международные протоколы лечения рака щитовидной железы, и наши национальные клинические рекомендации практически составлены с учетом двух самых серьезных клинических рекомендаций в мире. Это рекомендации Американской тиреоидологической ассоциации и Европейской тиреоидологической ассоциации.
Наши клинические рекомендации вбирают в себя все достижения современной медицины, поэтому мы абсолютно ничем не отличаемся от всего остального развитого мира в плане лечения и применяем самые высокие технологии в лечении.
Другой вопрос, что бывает так, что пациенты попадают в какую-то затруднительную ситуацию в плане диагностики. Бывают трудные случаи в плане диагностики или в каком-то не специализированном, не онкологическом лечебном учреждении случайно доктор пошел не по тому диагностическому пути и не выставил правильный диагноз.
Такое возможно, и не только в нашей стране. Я встречался с такими пациентами даже из США, где, в принципе, все должно быть хорошо организовано, поэтому от этого никто не застрахован. Все зависит от внимательности врача, который наблюдает такого пациента, но если все делать грамотно в соответствии с современными алгоритмами, рекомендациями, у таких пациентов все бывает хорошо.
Какие врачи лечат рак щитовидной железы?
Сегодня в нашей стране очень много специалистов занимаются лечением опухолевых заболеваний щитовидной железы. Это и эндокринологи, и общие хирурги, и специалисты по опухолям головы и шеи, но мое твердое убеждение, что лечением злокачественных опухолей щитовидной железы должны заниматься онкологи-хирурги и именно специалисты по опухолям головы и шеи.
Почему я так считаю? Потому что мы встречаемся с большим количеством хирургических ошибок, неправильным выбором объема хирургического вмешательства в среде хирургов (не онкологов), с несоблюдением онкологических принципов хирургических вмешательств: либо когда завышены показания для хирургического вмешательства, либо они занижены.
И то, и то нехорошо для пациентов, потому что в одном случае мы не излечиваем пациента, в другом случае мы излишне инвалидизируем пациента. Поэтому мое четкое
убеждение, что только хирурги-онкологи, специалисты по опухолям головы и шеи, могут заниматься лечением злокачественных опухолей.
Другая ситуация складывается у пациентов с доброкачественными узловыми образованиями. Здесь, конечно, любой подготовленный хирург может взять на себя эту миссию, прооперировать такого пациента, но, безусловно, это должен быть подготовленный человек. Я даже сомневаюсь, что такими пациентами должны заниматься общие хирурги.
Как минимум, это должен быть хирург-эндокринолог, который подготовлен к такой операции, который понимает все особенности такого хирургического вмешательства и оценивает все возможные риски.
Доступно ли лечение этого вида рака в регионах России?
Если ситуация несложная, если это ранняя форма рака, то, в принципе, достаточно обратиться в одно из специализированных учреждений, тиреоидологический федеральный онкологический центр. На сегодня алгоритмы принятия решения несложные в таком случае.
Другой вопрос, если это какой-то сложный случай, нестандартная клиническая ситуация или необычный гистологический вариант опухоли, то тогда, конечно, есть смысл обращаться за вторым мнением в какое-то другое учреждение. Здесь вопрос не недоверия к конкретному учреждению, а вопрос выработки правильной тактики в сложной клинической ситуации.
Какая лекарственная терапия применяется при раке щитовидной железы?
Это опухоль, которая не чувствительна к лекарственному воздействию, к обычному цитостатическому лекарственному лечению — это традиционная химиотерапия — и практически не чувствительна к стандартной лучевой терапии. Это не значит, что эти методы лечения не применяются в лечении этого рака.
Они, как правило, применяются в тех случаях, когда уже все возможности лечения исчерпаны у таких пациентов, и как паллиативная мера в определенных случаях эти методы лечения применяются, но это единичные больные. Если мы говорим о стандартах, то, как правило, они не используются, особенно в лечении первичных пациентов.
В настоящее время иммунные препараты также не являются стандартом лечения рака щитовидной железы, но в последнее время появились работы, клинические исследования, которые используют иммунные препараты, например, в лечении радиойод-рефрактерного рака щитовидной железы.
Эти исследования небольшие. Они совсем недавно появились. Пока невозможно однозначно сказать, есть ли преимущества в назначении иммунных препаратов, но я думаю, что в ближайшее время будет получен ответ на этот вопрос. Мы все ждём этого времени.
КАК ЛЕЧИТЬ РАК ЩИТОВИДНОЙ ЖЕЛЕЗЫ У БЕРЕМЕННЫХ?
История лечения Олеси Казеевой. Из нее вы узнаете о том, как современные методы лечения и препараты позволяют сохранить беременность и родить здорового ребенка

к.м.н., врач-онколог, ассистент кафедры онкологии и паллиативной медицины ФГБОУ ДПО РМАНПО Минздрава России, ассистент кафедры общей и клинической стоматологии ФГАОУ ВО РУДН
Какие схемы лечения могут изменяться в зависимости от стадии?
Выбор методов лечения зависит:

от гистологической формы заболевания

от распространенности опухолевого процесса
Лечение разных гистологических форм рака
Если говорить о дифференцированных формах рака щитовидной железы (папиллярный, фолликулярный, гюртле-клеточный рак), на сегодняшний день в арсенале врача-онколога имеется четыре основных варианта лечения: хирургия, супрессивная гормонотерапия левотироксином натрия, радиойодтерапия и таргетная терапия. Лучевая терапия проводится в исключительных случаях для контроля отдельных метастатических очагов, вызывающих значимую симптоматику болезни.
При этом доминирующая роль отводится хирургическому лечению. Хирургическое лечение в объеме тиреоидэктомии обязательно к выполнению при резектабельности первичной опухоли (T1−4a критерии по TNM). При распространенности болезни, соответствующей T1−2N0M0, отсутствии рака щитовидной железы в семейном анамнезе и облучения зоны шеи, возможно также выполнение гемитиреоидэктомии.
Тем не менее, пациент должен быть информирован, что проведение гемитиреоидэктомии затрудняет динамический контроль и далеко не всегда сопровождается возможностью избежать заместительной гормонотерапии.
Супрессивная гормонотерапия (т.е. назначение препарата в дозах, обеспечивающих уровень ТТГ в крови
- с высоким или умеренным риском рецидива,
- наличием рецидива,
- показателями тиреоглобулина, свидетельствующими о возможном рецидиве.
Радиойодтерапия показана при умеренном или высоком риске рецидива (при прорастании опухолью капсулы щитовидной железы, наличии метастазов в лимфатических узлах шеи, наличии мутации BRAF V600E, TERT, сосудистой инвазии и т. д.), а также при наличии отдаленных метастазов.
В случае неэффективности радиойодтерапии и достоверном увеличении размеров опухолевых узлов назначается таргетная терапия. На сегодняшний день в Российской Федерации для лечения дифференцированного рака щитовидной железы доступны два таргетных препарата — ленватиниб и сорафениб.
Принципы гормональной терапии после хирургического лечения новообразований щитовидной железы Текст научной статьи по специальности «Клиническая медицина»
Аннотация научной статьи по клинической медицине, автор научной работы — Ванушко В. Э., Фадеев В. В., Румянцев П. О.
Назначение тиреоидных гормонов после хирургического лечения опухолевой патологии щитовидной железы (ЩЖ) является частью комплексного плана лечения. При папиллярном, фолликулярном и низкодифференцированном раке ЩЖ показан супрессивный режим лечения, целевое значение тиреотропного гормона (ТТГ) 0,1 мЕд/л. Интенсивность и длительность супрессии ТТГ зависит от степени риска рецидива опухоли , а также от наличия выраженной сердечно-сосудистой патологии. При медуллярном и недифференцированном раке ЩЖ, а также после хирургического лечения доброкачественных заболеваний рассматривается заместительный режим терапии препаратами тиреоидных гормонов. Если пациенту произведена частичная резекция ЩЖ по поводу доброкачественного заболевания, вопрос о необходимости назначения левотироксина с заместительной целью должен быть решен на основе мониторинга уровня ТТГ, повышение которого свидетельствует о развитии послеоперационного гипотиреоза. После того, как у пациента на фоне заместительной или супрессивной терапии левотироксином достигнут целевой уровень ТТГ, контроль этого параметра проводится вначале 1 раз в полгода, далее ежегодно.
Похожие темы научных работ по клинической медицине , автор научной работы — Ванушко В. Э., Фадеев В. В., Румянцев П. О.
Влияние супрессивной тиреоидной терапии на сердечно-сосудистую систему у пациентов после оперативного лечения по поводу папиллярного рака щитовидной железы
Современные принципы терапии левотироксином после операции у больных высокодифференцированным раком щитовидной железы
Современные подходы к лечению высокодифференцированного рака шитовидной железы и осложнения супрессивной терапии левотироксином
Маркерный рецидив дифференцированного рака щитовидной железы после комбинированного лечения и результаты его повторной терапии
Thyroid hormone therapy principles after surgery of thyroid tumors
Thyroid hormone administration after thyroid tumors surgery is a part of complex treatment strategy. In case of papillary, follicular and poor-differentiated carcinomas suppressive treatment regime is indicated with target TSH level 0.1 IU/l. Intensity and duration of TSH suppressive treatment regime depends on tumor recurrence risk group and presence of severe cardio-vascular disease. In case of medullary and anaplastic thyroid cancer require substitutive treatment regime as well as after benign tumor surgery. If patient has been undergone partial thyroid resection by reason of benign tumor the suppressive treatment necessity would be settled in terms of postsurgical TSH level. Thereafter on substitutive or suppressive L-thyroxine treatment patient has achieved target TSH level the further control of it is conducting half in year and annually later.
Текст научной работы на тему «Принципы гормональной терапии после хирургического лечения новообразований щитовидной железы»
Принципы гормональной терапии после хирургического лечения новообразований щитовидной железы
В.Э. Ванушко, В.В. Фадеев, П.О. Румянцев
ФГБУ«Эндокринологический научный центр» Минздрава России, Москва
Контакты: Павел Олегович Румянцев rumyantsev.pavel@endocrincentr.ru
Ключевые слова: щитовидная железа, опухоли, гормональная терапия
Thyroid hormone therapy principles after surgery of thyroid tumors
V.E. Vanushko, V.V. Fadeev, P.O. Rumyantsev
FSBI “Endocrinology Research Center”, Ministry of Health of Russia, Moscow
Key words: thyroid, tumors, hormone therapy
Назначение препаратов тиреоидных гормонов после хирургического лечения опухолей щитовидной железы (ЩЖ) является важным компонентом комплексного плана лечения. В случаях злокачественных новообразований назначение тиреоидных гормонов после операции обязательно во всех случаях. После хирургического лечения доброкачественных заболеваний терапия препаратами тиреоидных гормонов также чаще всего назначается, при этом необходимость ее использования зависит от объема операции, развития послеоперационного гипотиреоза, который диагностируется при повышении послеоперационного уровня тиреотропного гормона (ТТГ) в крови. Назначением и дальнейшим контролем эффективности терапии тиреоидными гормонами чаще занимаются эндокринологи, реже онкологи и эндокринные хирурги. Чтобы представить масштабность проблемы послеоперационного ведения пациентов, прооперированных по поводу заболеваний ЩЖ, можно привести всего одну
цифру: при общей распространенности гипотиреоза в популяции до 3,7 %, на послеоперационный гипотиреоз по зарубежным данным приходится не менее 1/3 всех случаев.
Заместительный и супрессивный режимы лечения
После хирургического лечения доброкачественных заболеваний ЩЖ, а также в случае медуллярного или недифференцированного рака ЩЖ препараты тиреоидных гормонов назначаются с заместительной целью. Целевым значением ТТГ при заместительной терапии является диапазон референсных значений (0,4-4,0 мЕд/л) (см. рисунок).
Супрессивная терапия препаратами тиреоидных гормонов назначается только больным высокодифференцированным раком ЩЖ (ВДРЩЖ), к которому относят папиллярный и фолликулярный рак, а также низкодифференцированный рак ЩЖ, который встречается крайне редко. Она направлена на компенсацию послеоперационного гипотиреоза и предотвращение
стимуляции опухолевых клеток ТТГ гипофиза. Препаратом выбора как заместительной, так и супрессивной терапии является левотироксин ^-Т4). Уровень ТТГ считается супрессированным, если содержание последнего в крови не превышает < 0,1 мЕд/л. Уровень ТТГ ниже 0,4 мЕд/л, но выше 0,1 мЕд/л считается сниженным, но не супрессированным.
L-Т4 обладает высокой биодоступностью. Биодоступность, или, проще говоря, всасывание L-Т4, существенно снижается, если он принимается с пищей или после еды. Препарат принимается утром, примерно за 30 мин до завтрака, когда желудок пуст, запивается водой, после чего делается получасовая пауза до приема пищи, чтобы L-Т4 оказался у места своего всасывания (тонкая кишка) без мешающих этому всасыванию веществ. Препарат должен запиваться именно водой, но не молоком или кофе (это нужно обязательно сказать пациенту). И то и другое снижает абсорбцию L-Т4. Если пациент забывает принять L-Т4, на следующий день нет необходимости приема удвоенной дозы. В целом, как указывалось, единичные (1-2 раза в месяц) пропуски приема L-тироксина не отразятся на компенсации гипотиреоза.
В таблице приведены базовые принципы заместительной терапии гипотиреоза любой этиологии.
Интенсивность и длительность послеоперационной супрессивной терапии L-Т4 больных ВДРЩЖ определяется группой клинического риска (по развитию рецидива опухоли), возрастом пациента и наличием/тяжестью сопутствующих заболеваний, прежде всего сердечно-сосудистых. Супрессивный режим гормонотерапии может быть заменен на заместительный с низко-нормальным уровнем ТТГ (целевое значение ТТГ — 0,5-1,0 мЕд/л) в следующих клинических ситуациях:
— группа низкого и среднего риска при подтвержденной стойкой ремиссии (клинической и биохимической);
— пожилые пациенты, пациенты с сопутствующей выраженной сердечно-сосудистой патологией, даже при наличии признаков персистенции заболевания;
— больные группы высокого риска рецидива опухоли при подтвержденной стойкой ремиссии после 5 лет супрессивной терапии тиреоидными гормонами.
Оценка группы риска рецидива ВДРЩЖ осуществляется индивидуально и основывается на следующих клинико-морфологических критериях.
1. Группа низкого риска — солитарная опухоль Т1 (менее 2 см) N0M0 без признаков экстратиреоидного распространения.
2. Группа среднего риска — T2N0M0 или первичномножественный T1N0M0.
3. Группа высокого риска — любой Т3 и Т4 или любой Т при наличии N1 или М1, пациенты с персис-тенцией РЩЖ, пациенты после паллиативных операций.
При полном клиническом выздоровлении через 20 лет можно переходить на обычную заместительную терапию L-T4 с поддержанием низко-нормального уровня ТТГ (0,5-1,0 мЕд/л). Однако не стоит прекращать диспансерное наблюдение за пациентами в связи с тем, что рецидивы ВДРЩЖ описаны спустя 30 лет и более после первичного лечения.
Расчет дозировки и контроль
Как правило, у пациентов с опухолевой патологией ЩЖ до операции нет гипотиреоза и в этой ситуации очевидно назначение заместительной или супрессивной терапии, начиная со следующего дня после оперативного вмешательства, если спустя короткий срок после опера-
Тактика лечения при опухолях щитовидной железы
Базовые принципы заместительной терапии гипотиреоза
Гипотиреоз легко диагностируется Определение уровня ТТГ и свободного Т4 доступно в широкой клинической практике и относительно дешево
Продукция Т4 и Т3 — единственная жизненно важная функция ЩЖ Дефицит кальцитонина компенсируется за счет его внетиреоидной продукции
Синтетический L-тироксин — точная химическая копия эндогенного Молекула Т4 достаточно проста для химического синтеза и точно дозируется в таблетке в микрограммах; суточная продукция Т4 у здорового человека составляет около 80 мкг, при этом большая честь циркулирующего в крови Т3 образуется за счет периферического дейодирования Т4
Высокая биодоступность L-Т4 при пероральном приеме Большая часть L-тироксина всасывается в верхнем и среднем отделе тонкой кишки; его биодоступность составляет около 75 %*
Потребность в тироксине меняется редко Основными факторами, которые могут изменить потребность в L-тироксине, являются изменение массы тела, наступление беременности и действие факторов, изменяющих его биодоступность*. Кроме того, если пациент получает неполную заместительную дозу L-тироксина, потребность в нем может увеличиться вследствие постепенного снижения эндогенной продукции тиреоидных гормонов тиреоидным остатком
Длительный период полужизни L-Т4 в плазме (около 7 дней) Это позволяет легко моделировать эндогенную продукцию Т4 однократным приемом препарата. В отличие от секреции ТТГ и Т3, продукция Т4 практически лишена циркадианного ритма. Отсюда же — редкие однократные пропуски приема препарата, которые неизбежны при пожизненной терапии и существенно не сказываются на компенсации заболевания
ТТГ — точный критерий адекватности дозы L-тироксина Продукция ТТГ и Т4 подчиняется принципу отрицательной обратной связи. Двукратное изменение в ту или иную сторону уровня свободного Т4 в крови приводит к 50-кратному изменению продукции ТТГ в противоположную сторону. В связи с этим изменения уровня ТТГ «улавливаются», даже когда уровень свободного Т4 еще находится в пределах референ-сного интервала (субклинические нарушения функции ЩЖ)
Относительная дешевизна препаратов L-Т4 По ценам на осень 2010 г. стоимость 1 месяца заместительной терапии гипотиреоза составляет 40—60 руб.
* Многие факторы, в частности другие лекарственные препараты (карбонат кальция, сульфат железа, соевые белки и пр.), нарушение приема L-тироксина (прием с пищей, запивание кофе) и желудочно-кишечные заболевания (спру, ахлоргидрия, хеликобактериоз) могут существенно изменить (чаще снизить) его биодоступность.
Важнейшим условием адекватной заместительной терапии гипотиреоза является точность выбранной дозировки препарата. L-Т4 является препаратом с очень узким терапевтическим диапазоном. То есть интервал между недостаточной (когда ТТГ повышен) и избыточной
(ТТГснижен) дозой L-Т4 очень небольшой. Иногда он составляет всего 12,5-25 мкг. В этой связи, на компенсации гипотиреоза может отразиться дробление таблетки. Традиционно в СССР, а затем в РФ были наиболее распространены дозы L-Т4 в 50 и 100 мкг в одной таблетке. В такой ситуации, для того чтобы обеспечить индивидуальную и точную дозировку, приходится дробить препарат, порой выламывая по 1/4 и даже по 1/8 части таблетки. В последние годы ситуация существенно облегчилась тем, что на российском фармацевтическом рынке появилось большее число дозировок L-Т4. Препарат стал выпускаться в дозе 50, 75, 100, 125 и 150 мкг в одной таблетке. Для более точной гормональной коррекции стали появляться дозировки 88, 112, 137 мкг В такой ситуации стал возможен точный индивидуальной подбор дозы препарата для заместительной, и, что особенно актуально, супрессивной терапии. В свою очередь это позволило существенно повысить качество терапии препаратами тиреоидных гормонов за счет 2 факторов: во-первых, за счет повышения точности дозирования вследствие отсутствия неточностей дробления таблетки, во-вторых, за счет повышения приверженности пациента к лечению (комплаентности), подразумевающему каждодневный прием 1 или 2 целых таблеток.
Если пациенту произведена частичная резекция ЩЖ, вопрос о необходимости назначения L-Т4 с заместительной целью может быть решен на основе мониторинга уровня ТТГ в течение нескольких месяцев после операции. Так или иначе, если пациент находился под контролем, у него не может развиться и существовать длительное время некомпенсированный гипотиреоз, при котором имеет смысл дробное назначение L-Т4 с постепенным увеличением дозы.
После того как у пациента на фоне заместительной терапии L-Т4 достигнут нормальный уровень ТТГ, контроль этого параметра проводится вначале 1 раз в полгода, далее ежегодно. Наблюдение пациентов, получивших комплексное лечение по поводу ВДРЩЖ, подразумевает более сложный комплекс диагностических мероприятий. Если пациенту выполнена органосохраняющая операция на ЩЖ, то, помимо контроля ТТГ на фоне терапии L-Т4, необходим контроль состояния резидуальной тиреоидной ткани, в которой, несмотря на удаление большей части ЩЖ и развитие гипотиреоза, может развиться рецидив заболевания.
Вопрос, который активно обсуждается последние годы, — целевой уровень ТТГ на фоне заместительной терапии L-Т4. Как указывалось, в соответствии с общепринятыми рекомендациями он должен поддерживаться в рамках референсного диапазона (0,4-4,0 мЕд/л). Тем не менее ряд руководств, базируясь на том факте, что среди здоровых людей с отсутствием антител к ЩЖ уровень ТТГ в 95 % случаев не превышает 2,0 мЕд/л, предлагает рассматривать в качестве целевого именно такой низконормальный уровень ТТГ (0,5-1,0 мЕд/л). К сожалению, проспективные исследования, которые бы подтвердили или опровергли эти рекомендации, пока отсутствуют. Особняком в этом плане стоят работы, подтвердившие факт, что терапия L-Т4, направленная на подавление уровня ТТГ (супрессивная терапия), положительно отражается на прогнозе у пациентов с ВДРЩЖ.
К основным объективным факторам, приводящим к необходимости изменения дозы L-Т4, относятся: выраженная динамика массы тела, беременность и прогрессирование гипотиреоза у пациентов после органосохраняющих операций на ЩЖ. При значительном увеличении или уменьшении массы тела может произойти соответствующее изменение в потребности в L-Т4, что отразится на уровне ТТГ. Это закономерно связано с изменением объема распределения препарата. Другой важнейшей ситуацией, требующей увеличения дозы L-Т4 у пациенток с гипотиреозом любого генеза, является наступление беременности. У женщин с исходно компенсированным гипотиреозом дозу L-Т4 необходимо на максимально ранних сроках беременности увеличивать примерно на 50 % от исходной. Обычно она увеличивается на 50 мкг. Еще одним фактором, который может привести к изменению дозы
L-Т4, служит прогрессирование гипотиреоза. В контексте послеоперационного гипотиреоза речь идет о состояниях после органосохраняющих операций. Изначально у пациента выявляется умеренный гипотиреоз, компенсируемый небольшой дозой L-тироксина, которая постепенно увеличивается и достигает полной заместительной по мере прогрессирования деструктивного процесса в остатке тиреоидной ткани. Такая ситуация типична для состояния, когда в тире-оидном остатке со временем развивается тиреоидит.
Еще одной группой пациентов, которая в аспекте заместительной терапии гипотиреоза традиционно рассматривается отдельно, являются лица с сопутствующей сердечно-сосудистой патологией. Вопреки расхожему мнению, веских аргументов (данных проспективных контролируемых исследований) о том, что таким пациентам необходимо назначать меньшие дозы L-Т4 и, соответственно, поддерживать более высокий уровень ТТГ, нет. Как указывалось выше, в этой ситуации (за исключением послеоперационного гипотиреоза) необходимо начинать терапию гипотиреоза с небольшой дозы L-Т4, с ее постепенным повышением до необходимой. Для того, чтобы избежать передозировки и развития медикаментозного тиреотоксикоза у данной категории больных, необходим более частый контроль уровня ТТГ. Более того, если речь идет о больных ВДРЩЖ с сопутствующими тяжелыми сердечнососудистыми заболеваниями, супрессивная терапия L-Т4 в этой ситуации несет потенциально больший риск, чем риск персистенции опухоли. В подобных ситуациях пациентам даже при подтвержденной персис-тенции заболевания проводится заместительная терапия с удержанием уровня в низко-нормальном диапазоне (целевые значения ТТГ 0,5-1,0 мЕд/л).
Для проведения по клиническим показаниям уточняющей диагностики («стимулированного» уровня ТГ, радиойоддиагностики) или терапии радиоактивным йодом у больных ВДРЩЖ нередко производится отмена тиреоидных гормонов, целью которой является достижение высокого уровня ТТГ в крови. В зарубежной практике для этого успешно применяется человеческий рекомбинантный ТТГ, введение которого позволяет избежать некомфортного для пациентов состояния гипотиреоза. Препарат называется Тироген, но в РФ он пока не зарегистрирован. Отмена левоти-роксина осуществляется за месяц до диагностики/лечения. Для того чтобы минимизировать период гипотиреоза, иногда применяется следующая схема подготовки: пациент на месяц переводится на прием изоэквивалентной дозы трийодтирона, который отменяется за 2 нед до диагностики/лечения. Если планируется диагностика или лечение радиоактивным йодом, то в целях повышения их эффективности весь период после отмены тиреоидных гормонов необходимо придерживаться не содержащей йод диеты.
Адъювантная (послеоперационная) гормонотерапия
Развитие рака молочной железы может зависеть от действия гормонов — эстрогена и прогестерона. До менопаузы, то есть в период регулярных менструаций, эстроген и прогестерон образуются в яичниках. Этот период называется пременопаузой (в среднем он наступает в 40–45 лет). После менопаузы (постменопауза) функция яичников в норме угасает, менструации прекращаются. В постменопаузе эстрогены образуются в основном в жировой ткани, но в гораздо меньших количествах.
Свое действие на клетку гормоны осуществляют при помощи рецепторов. Рецепторы — это молекулы на поверхности клеток или внутри них, которые связываются с другими молекулам, например, с гормонами. Гормональные рецепторы могут присутствовать и на опухолевых клетках. В этом случае гормоны стимулируют рост опухоли. Если гистологическое исследование покажет, что в опухолевых клетках содержатся рецепторы эстрогена (РЭ+ или ER+) и прогестерона (РП+ или PR+), то такая опухоль называется гормонозависимой. Гормональная (эндокринная) терапия показана только для гормонозависимых опухолей.
Цель гормональной терапии — уменьшить стимулирующее влияние эстрогена на опухоль. В адъювантной терапии, то есть лечении, проводимом после операции, это осуществляется при помощи двух классов препаратов: антиэстрогенов (тамоксифен) и ингибиторов ароматазы (анастрозол, летрозол, экземестан). Помимо этого, женщинам в пременопаузе при использовании ингибиторов ароматазы или тамоксифена (при высоком риске рецидива) нужно искусственно снизить выработку собственных половых гормонов.
Как работает тамоксифен?
Тамоксифен блокирует рецепторы эстрогена в клетках молочной железы, в результате чего связь между эстрогеном и его рецептором прерывается. Так гормон перестает стимулировать рост опухоли.
Рецепторы эстрогена находятся не только на молочной железе, но и в других органах, например, в матке, печени и костях. В некоторых органах (матке, печени) тамоксифен, связываясь с рецептором эстрогена, оказывает не блокирующее, а стимулирующее влияние. Поэтому тамоксифен еще называют селективным модулятором рецепторов эстрогена. Со стимулирующим действием на другие органы связаны некоторые его побочные эффекты. Например, вагинальные выделения, гиперплазия эндометрия, образование тромбов.
Не забудьте рассказать лечащему врачу обо всех имеющихся у вас сопутствующих заболеваниях, чтобы он подобрал вам лечение с учетом побочных эффектов. Подробнее о побочных эффектах гормональной терапии вы можете прочитать здесь.
Тамоксифен может являться препаратом выбора в период до наступления менопаузы у пациенток с низким риском рецидива.
Тамоксифен — это таблетированный препарат. Его принимают 1 раз в день ежедневно. Длительность приема может варьироваться от 5 до 10 лет. Длительность зависит от факторов риска рецидива и индивидуальной переносимости препарата, определяется лечащим врачом совместно с пациенткой.
Существует еще один препарат, который воздействует на рецепторы эстрогена, — фулвестрант. Фулвестрант не используется в адъювантной терапии. О том, когда и как он используется, вы сможете прочитать в статье.
Как работают ингибиторы ароматазы?
Ингибиторы ароматазы (анастрозол, летрозол, экземестан) блокируют белок ароматазу. Согласно исследованию, все препараты этой группы равноэффективны, но отличаются по побочным эффектам. Ароматаза участвует в выработке эстрогена в жировой ткани после менопаузы, поэтому при приеме препаратов этого класса уменьшается образование эстрогена. Так что ингибиторы ароматазы — основной класс гормональной терапии для женщин в постменопаузе. В пременопаузе предпочтительно их назначение у женщин с высоким риском рецидива. Ингибиторы ароматазы назначаются только совместно с подавлением работы яичников. Решение о выборе между ингибиторами ароматазы и тамоксифеном принимается лечащим врачом совместно с пациенткой в каждом конкретном случае.
Основные побочные эффекты ингибиторов ароматазы — это суставные и мышечные боли, скованность в суставах, снижение плотности костей. Снижение плотности костей в некоторых случаях может привести к остеопорозу и переломам. Для их предотвращения рекомендуется оценивать минеральную плотность костей при помощи диагностического исследования — денситометрии. Для профилактики осложнений также обязательно используются препараты кальция, витамин Д и остеомодицифицирующие агенты: бисфосфонаты (золендроновая кислота), деносумаб. Более подробную информацию про остеомодифицирующие агенты вы можете найти по ссылке.
Ингибиторы ароматазы выпускаются в виде таблеток, принимать их необходимо ежедневно. Длительность приема определяется лечащим врачом и в среднем составляет 5–7 лет.
Что такое овариальная супрессия и зачем она нужна?
В пременопаузе женские половые гормоны образуются в яичниках. Поэтому в лечении гормонозависимого рака молочной железы может понадобиться подавить их работу. Искусственное снижение образования гормонов яичниками называется овариальной супрессией.
Овариальная супрессия может быть достигнута следующими методами:
- Хирургическим. Выполняется удаление обоих яичников. Такая операция называется двусторонней (билатеральной) овариэктомией. Операция — это необратимый метод овариальной супрессии, то есть яичники перестают быть источником образования гормонов.
- Лучевым. Яичники облучаются при помощи радиации. При использовании данного метода функция яичников также утрачивается навсегда. На сегодняшний день облучение используется очень редко.
- Лекарственным. Используются препараты группы аналогов гонадотропин-рилизинг гормона. К этой группе относятся гозерелин, лейпрорелин, трипторелин, бусерелин. Эти препараты подавляют сигнал, который стимулирует яичники вырабатывать эстроген. Яичники перестают работать, и развивается временная менопауза. Однако после отмены препаратов этой группы функция яичников восстанавливается. Лекарственный метод используется чаще, чем хирургический или лучевой.
Аналоги гонадотропин-рилизинг гормона вводятся в форме инъекций. Уколы необходимо делать 1 раз в 28 дней.
При угнетении образования гормонов яичниками любым из этих методов пациентку могут беспокоить симптомы менопаузы: приливы, сухость влагалища, ночная потливость, перемены настроения.
Овариальная супрессия необходима женщинам в пременопаузе, получающим ингибиторы ароматазы. Врач может назначить овариальную супрессию также женщинам в пременопаузе, которые принимают тамоксифен. В этом случае назначение овариальной супрессии определяется характеристиками опухоли и степенью ее распространенности. Эффективность подавления функции яичников была доказана в крупных исследованиях TEXT и SOFT. В этих исследованиях добавление овариальной супрессии к основному лечению (тамоксифену или экземестану) показало улучшение прогноза для женщин в пременопаузе с факторами высокого риска возврата (рецидива) опухоли.
Гормонотерапия при раке молочной железы
Гормонотерапия при раке молочной железы сегодня проводится теми же препаратами, что и 20 лет назад, не изменились и основополагающие принципы её назначения, существенное отличие современного подхода в более точном подборе лекарственного средства с ориентировкой на биологические характеристики опухоли и индивидуальные эндокринные показатели пациентки.
Что такое гормонотерапия?
Гормонотерапия при раке молочной железы предполагает применение в лечебных или профилактических целях похожих на половые гормоны лекарственных средств для «обмана» раковой клетки или полное прекращение воспроизводства эндокринных субстанций яичниками, а также синтеза гормонов в жировой ткани.
Конечная цель гормонотерапии — не допустить поступления половых гормонов в раковую клетку молочной железы, чем нарушается синтез необходимых для её жизни веществ и вынужденно включается программа клеточной гибели — апоптоз.
В качестве гормональных (эндокринных) лекарственных средств при раке молочной железы используют:
- натуральные гормоны и их синтетические аналоги — эстрогены, андрогены и прогестины;
- блокирующие связывание естественного гормона с рецептором опухолевой клетки антигормоны — антиэстрогены;
- нарушающие локальный синтез гормонов в жировой ткани ингибиторы ароматазы;
- гонадотропин-релизинг-гормон — химическое вещество, подменяющее естественный гормон гипоталамуса, который блокирует синтез яичниками собственных половых гормонов.
Аналогично гонадотропин-релизинг-гормону действуют хирургическое удаление придатков или облучение яичников, без них невозможно лечение менструирующих женщин ингибиторами ароматазы.

Показания к назначению
Рак молочной железы возникает на фоне гормонального дисбаланса, но не все опухоли чувствительны к гормональному воздействию, некоторые популяции клеток не используют половые гормоны для своей жизнедеятельности — они гормонально независимы. Как правило, независимой считается опухоль, в которой не больше 1% клеток нуждается в эстрогенах.
О гормональной зависимости злокачественного новообразования молочной железы судят по наличию на ядерных мембранах клеток рака специальных гормональных рецепторов, взаимодействующих с эстрогенами и переносящих их внутрь клеточного ядра, кратко обозначаемых как «ЭР+» или «ER+». Рецепторы определяет специальный анализ.
Дополнительный косвенный признак гормонозависимого рака молочной железы — наличие мембранных рецепторов прогестерона — «ПР+» или «PR+», пороговое значение — более 20% клеток в популяции.
Наиболее благоприятно для назначения гормонотерапии при раке молочной железы сочетание максимально высокого уровня ЭР+ с ПР+. Формально гормонотерапия показана всем пациенткам, в опухоли молочной железы которых имеется более 1% клеток ЭР+ без учёта концентрации ПР+.
Особенности гормонотерапии при РМЖ
Гормональная зависимость рака молочной железы обещает чувствительность к гормонотерапии, но не гарантирует её.
Во-первых, не все ЭР способны взаимодействовать с лекарственным препаратом, нацеленным на него антиэстрогеном. Результат лечения прогнозирую по объёму популяции чувствительных клеток, считается, что чем больше в раке ЭР+, тем эффективнее будет эндокринная терапия.
Во-вторых, некоторые опухоли формируют устойчивость к лекарству, ускоренно разрушая его в своей цитоплазме или выводя из клетки в межклеточную жидкость. Формирование устойчивости легло в основу поэтапной гормонотерапии, когда при утрате опухолью чувствительности к одному препарату переходят на другую группу лекарственных средств. Особенность рака молочной железы — возможность перехода с одной линии гормонотерапии на другую при снижении клинической эффективности воздействия.
В-третьих, ради собственного выживания на фоне гормонотерапии, опухоль постепенно становится нечувствительной к препарату, происходит естественный отбор — реагирующие на гормональные лекарства клетки погибают, выживают и дают потомство нечувствительные. Отчасти на этой особенности рака молочной железы базируется отказ от одновременного использования химиотерапии и гормонотерапии — только последовательно.
При подборе лекарственного препарата обязательно учитывается гормональный период, в котором пребывает женщина. При недавнем прекращении менструации определяется концентрация производимых гипофизом лютеинезирующего (ЛГ) и фолликулостимулирующего (ФСГ) гормонов, стимулирующих работу яичников.
Виды гормональной терапии
В зависимости от цели гормонотерапию подразделяют на неоадъювантную, адъювантную и лечебную.
Неоадъювантная ГТ проводится до радикальной операции для уменьшения объема опухолевого узла и уничтожения микрометастазов, попутно выясняется клиническая чувствительность опухоли к конкретному лекарственному препарату и перспективность профилактической антигормональной терапии после операции. Этот вид ГТ назначается при люминальном молекулярно-биологическом подтипе рака молочной железы с ЭР+ и ПР+. Эффект при гормонотерапии отсроченный, в отличии от химиотерапии, поэтому неоадъювантное лечение проводится не менее 4 месяцев, при хорошем результате — 8 месяцев и дольше, соответственно, на такой же срок откладывается операция на молочной железе. Поскольку наименее токсичными считаются ингибиторы ароматазы, их и используют, но они разрешены только для переживших менопаузу женщин.

Адъювантная гормонотерапия назначается для профилактики рецидива и метастазирования, она проводится всем больным с ЭР+, в том числе при карциноме in situ, только цель при 0 стадии иная — предотвращение развития рака в другой молочной железе. Продолжительность терапии — до прогрессирования или 5-10 лет в зависимости от исходного прогноза, а начинают ГТ строго после завершения адъювантной химиотерапии. Выбор препарата зависит от менструального статуса женщины.
Лечебная ГТ применяется при неоперабельном раке молочной железы или метастазах после радикального лечения. Длительность эндокринного воздействия зависит от эффективности, при прогрессировании переходят на следующий по очереди лекарственный препарат, выбор которого определяется по гормональному статусу женщины.
Препараты
Гормональная терапия рака молочной железы проводится антиэстрогенами и ингибиторами ароматазы, применение эстрогенов, прогестинов и андрогенов ограничено высокой частотой осложнений. Каждый препарат в лечебных целях принимают до прогрессирования заболевания, в профилактически — до появления метастазов или не менее 5 лет.
Антиэстрогены представлены двумя препаратами:
- ежедневно принимаемые при всех видах ГТ и в любом гормональном периоде таблетки тамоксифена;
- фулвестрант (Фазлодекс™) используется при распространенном раке молочной железы, ранее прогрессировавшем на тамоксифене, и только после менопаузы, он вводится в мышцу раз в месяц, главный недостаток — стоимость инъекции около 500$.
Ингибиторы ароматазы в таблетках для ежедневного приема применяются при любом виде ГТ у женщин после менопаузы, все лекарства одинаково эффективны:
Никогда одновременно не используются лекарственные средства разных групп — только по-отдельности. Некоторые схемы адъювантной ГТ предполагают смену лекарства через определенный срок, например, молодая женщина 5 лет пьет тамоксифен, при прекращении менструальной функции ещё 2 года получает ингибиторы ароматазы. При лечении неоперабельного рака или метастазов смена группы происходит при возобновлении опухолевого роста или появлении выраженных побочных осложнений.
Для временного выключения функции яичников у менструирующих женщин применяются аналоги гонадотропин-рилизинг-гормона (ГРГ), при раке молочной железы Стандарты рекомендуют каждые 28 дней инъекцию одного из одинаково эффективных средств:
- гозерелин (Золадекс™);
- трипторелин (Диферелин™);
- бусерелин (Бусерелин-депо™);
- лейпрорелин (Люкрин-депо™)
Группа ГРГ вспомогательная, используется вместе с ингибиторами ароматазы или антиэстрогенами. Прием таблеток начинают после полутора-двух месяцев инъекций антагонистов гонадотропинов. ГРГ конкуренты удаления или облучения яичников, после прекращения инъекций менструация у молодых женщин восстанавливается в ближайшие 3 месяца.
Побочные действия
Антиэстрогены и ингибиторы ароматазы обладают схожими побочными реакциями, самые опасные из которых: образование тромбов и дисгормональный остеопороз. Тамоксифен активнее влияет на свертываемость крови, и при многолетнем использовании у небольшого процента женщин индуцирует рак эндометрия. Ингибиторы ароматазы чаще осложняются остеопорозом. Одинаково часто обе группы вызывают приливы.
Все гормональные препараты подвергаются трансформации в печени. Тамоксифен может вызвать токсическое поражение печени и привести к застою желчи — холестазу, клиника которого отчасти напоминает острый холецистит, все симптомы исчезают после отмены антиэстрогена.
В настоящее время нет однозначного мнения по выбору лекарственного средства — эффективность их одинаковая, поэтому ориентируются на гормональный возраст и сопутствующую патологию, к примеру, при варикозной болезни или патологии эндометрия целесообразно избегать тамоксифена, при остеопорозе — ингибиторов.
В подавляющем большинстве случаев ГТ хорошо переносится, что позволяет при неблагоприятных прогностических факторах пролонгировать её до 7-10 лет.
Возможные последствия
На фоне приёма тамоксифена:
- при метастазах в костях рака молочной железы в первый месяц лечения могут усилиться боли — синдром «вспышки» требует отмены антиэстрогена;
- стимулируется овуляция и возможна беременность, поэтому женщины репродуктивного возраста должны прибегать к контрацепции;
- течение кардиальных заболеваний улучшается вследствии благоприятного действия на обмен липидов, но только после нескольких лет ГТ;
- опосредованное повышение в крови эстрогенов приводит к приливам, но также несколько «омолаживает» кожу и слизистые половых органов;
- осложнения со стороны глаз редки, но возможно обострение давней ретинопатии, кератопатии или усугубление возрастной катаракты.
Использование препарата группы ГРГ часто сопровождается посткастрационным синдромом с приливами, частыми кольпитами, недержанием мочи, болями в мочевом пузыре и т.д. У женщин в пременопаузе при совместном применении ГРГ с ингибитором ароматазы возможно повышение уровня эстрадиола, что исключает эффект от лечения.
Диета при гормонотерапии
Многие женщины считают, что на фоне гормональных препаратов растет вес тела, клинические исследования на счет ГТ относят всего лишь 1,6% — 4% случаев повышения веса. Избыток веса обусловливается не фармакологическим действием, а изменением ритма жизни после выявления рака молочной железы, нормализацией питания после завершения химиотерапии и снижением уровня стресса после проведения радикальной терапии. На профилактической ГТ женщина успокаивается и бережет себя, избегая физических нагрузок, и вес растет даже без лекарств.
Гормонотерапия не нуждается в особой диете, необходима коррекция питания с учетом ежедневных нагрузок и сопутствующих болезней.
Эффективность
Результат терапии зависит от чувствительности опухолевых клеток к лекарствам, поэтому в обязательном порядке до начала лечения определяется молекулярно-биологический подтип рака молочной железы.
Эффект адъювантной терапии оценивается по времени появления метастазов — на фоне ГТ или в течение года после её завершения. В отсутствии клинически определяемой опухоли косвенно об эффективности свидетельствует уровень эстрадиола в крови.
Результат гормонального воздействия более медленный, нежели химиотерапии, поэтому оценка эффективности при распространенном раке молочной железы проводится каждые 3-4 месяца приема. Общий эффект ГТ — от 15% до 36%, и тем выше, чем больше концентрация ЭР и ПР.
Прогноз при применении гормонотерапии
Распространенность рака молочной железы на момент выявления косвенно свидетельствует об агрессивности и гормональной независимости опухоли. ГТ мало полезна при метастатической стадии, сопровождающейся висцеральным кризом — при множественных злокачественных новообразованиях внутренних органов с нарушением их функции.
При распространенном процессе с высоким уровнем ЭР и ПР на фоне ГТ регрессируют множественные метастазы, особенно в костях, коже и лимфоузлах, даря женщине годы качественной жизни. Эндокринное воздействие бесполезно при прогрессировании рака молочной железы на фоне трех линий ГТ.
Лечение рака должно быть своевременным и адекватным, в «Евроонко» можно выполнить геномный анализ опухоли на чувствительность к препаратам, что повысит непосредственные результаты терапии и положительно отразится на продолжительности жизни.
Рак щитовидной железы
Рак щитовидной железы – злокачественное узловое образование, способное образовываться из эпителия, естественно функционирующего в железе.
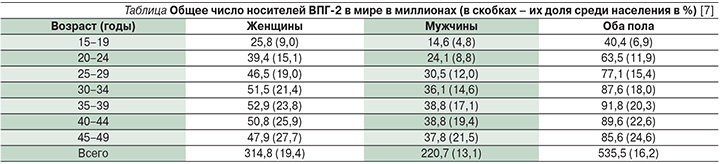
Рак щитовидной железы составляет более четверти всех злокачественных новообразований в области головы и шеи. За последние десятилетия, по данным ВОЗ, заболеваемость РЩЖ в мире выросла в 2 раза. Рак щитовидной железы ежегодно является причиной смерти 1% всех больных, умирающих от злокачественных опухолей. Среди всех злокачественных новообразований, это заболевание составляет 0.5 — 3.5 %. То есть на 100 000 населения РЩЖ заболевают в среднем 0.5-0.6 мужчин и 1.2-1.6 женщин.
В России самые высокие показатели заболеваемости отмечаются в Брянской области: 4.9 на 100 000 мужчин и 26.3 на 100 000 женщин. Также наиболее неблагополучные районы в отношении заболеваемости РЩЖ — Архангельская, Саратовская, Свердловская и Магаданская области.
Факторы риска развития рака щитовидной железы
Основные факторы риска:
- Йодная недостаточность
- Ионизирующее излучение (Радиация)
- Наследственность (Семейный анамнез)
К факторам риска также относится наличие у пациентов узловых образований в щитовидной железе, т.е. узловые зобы, рецидивирующие их формы, узловые формы хронических тироидитов.
Йодная недостаточность
Регионы мира с пониженным содержанием йода в воде и пищевых продуктах, являются эндемичными для узлового зоба, на фоне которого нередко развивается рак щитовидной железы. В Российской Федерации эндемичными районами считаются Алтайский край и республика Адыгея.
Ионизирующая радиация
С момента обнаружения данного физического явления и до настоящего момента роль этого фактора, как причины развития РЩЖ, резко возросла. Действие данного фактора, прежде всего, связано с попаданием в организм радиоактивных изотопов йода ( 131 I, 125 I). Так, было установлено, что жители Хиросимы и Нагасаки, которые попали под облучение после взрыва атомных бомб, болели раком щитовидной железы в 10 раз чаще, чем остальные японцы.
В России был отмечен резкий рост заболеваемости РЩЖ, особенно у детей, в регионах, которые подверглись радиоактивному загрязнению после аварии на Чернобыльской АЭС, это Брянская, Тульская, Рязанская области.
Наследственность
Риск развития РЩЖ выше в семьях, где отмечались случаи этого заболевания. Наследственная форма рака связана с наследственными синдромами множественной эндокринной неоплазии (МЭН).
Типы рака щитовидной железы
По гистологическим формам классифицируются четыре типа рака щитовидной железы: папиллярный, фолликулярный, медуллярный и анапластический.


Папиллярный рак — наиболее благоприятный тип. Встречается у детей и взрослых, чаще заболевают в 30-40 лет. Является преобладающей формой РЩЖ у детей. Опухоль чаще возникает в одной из долей и лишь у 10-15% пациентов отмечается двустороннее поражение.
Папиллярная карцинома отличается достаточно медленным ростом. Метастазирует в лимфоузлы шеи, отдаленные метастазы в другие органы наблюдаются редко.
Фолликулярный рак встречается у взрослых с пиком заболеваемости в 50-55-м возрасте. Этот вид опухоли характеризуется медленным ростом. В поздних стадиях образует метастазы в лимфатических узлах шеи, а также в костях, печени и легких. Метастазы фолликулярного рака сохраняют способность захватывать йод и синтезировать тиреоглобулин.
Медуллярный рак может быть как самостоятельным заболеванием, так и компонентом МЭН синдрома. Чаще определяется в пожилой возрастной группе пациентов с узловым зобом. Характеризуется быстрым ростом с инвазией в близлежащие органы и ранним метастазированием.
Анапластический рак чаще возникает у пожилых пациентов с узловым зобом. Его отличает агрессивная форма и раннее метастазирование. Быстрый рост опухолевого узла может приводить к его некротическому распаду, изъязвлению и может служить источником кровотечений.
Гистогенетическая классификация рщж
| ИСТОЧНИК РАЗВИТИЯ | ГИСТОЛОГИЧЕСКАЯ СТРУКТУРА ОПУХОЛИ | |
| доброкачественные | злокачественные | |
| А-клетки | Папиллярная аденома | |
Симптомы
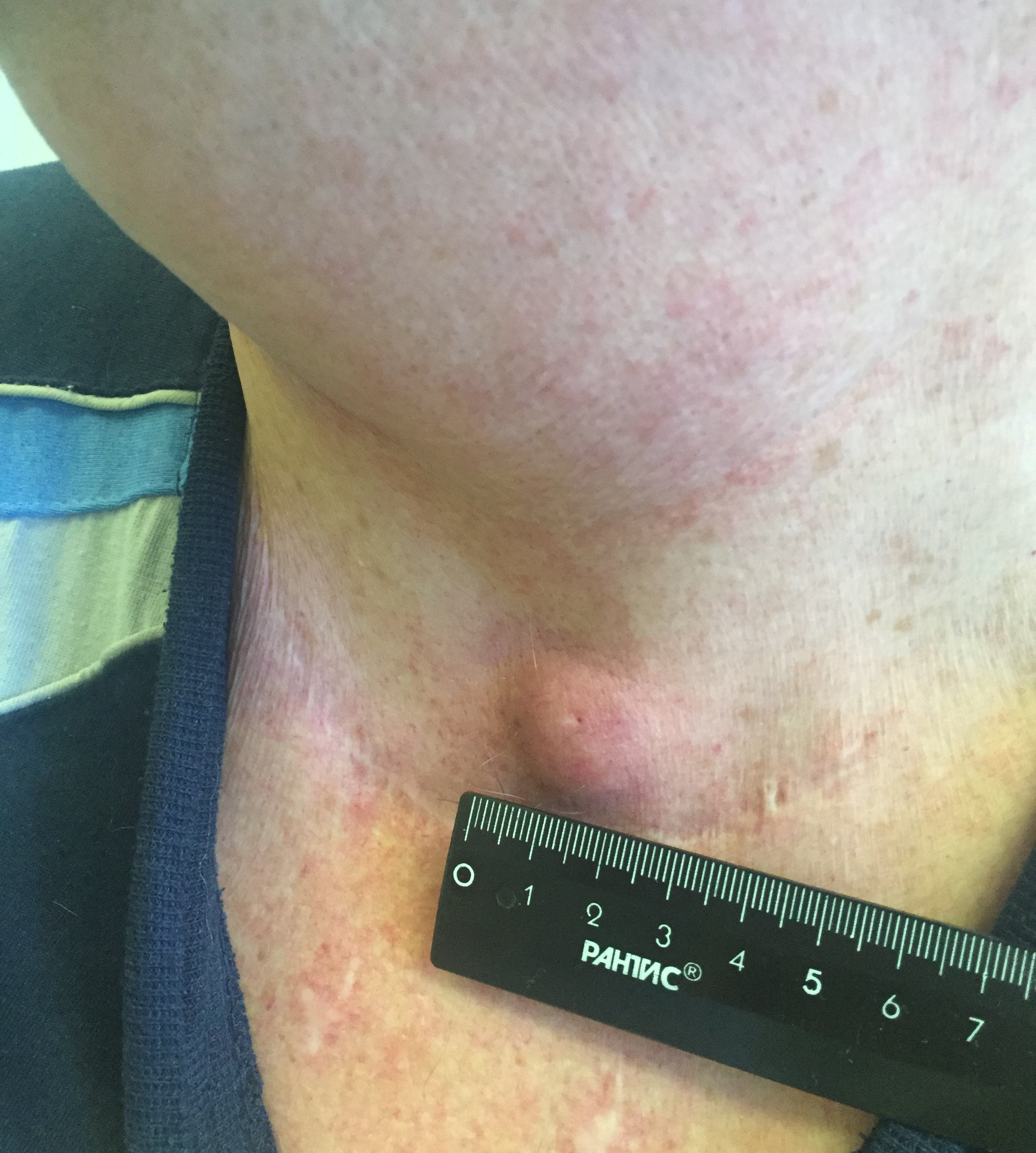
Заболевание может проявляться различными симптомами. Они зависят от стадии, распространенности опухолевого процесса и развившихся осложнений. Небольшие опухоли щитовидной железы обычно не сопровождаются клинической симптоматикой и выявляются случайно при ультразвуковом исследовании. Первой причиной обращения к врачу может послужить увеличение одного шейного лимфатического узла, который при дальнейшем обследовании оказывается метастазом РЩЖ.
Симптомы рака щитовидной железы часто схожи с симптомами простуды, ангины, инфекционных заболеваний:
- Припухлость на шее. Небольшие узлы на шее может выявить только врач, но иногда припухлость можно заметить во время глотания.
- Увеличение шейных лимфоузлов. Однако, этот симптом часто сопровождает простуду или ангину и не связан со злокачественным процессом.
- Изменение тембра голоса. Иногда большой узел щитовидной железы давит на гортань, это может вызвать охриплость.
- Одышка. Причиной может явиться то, что увеличившаяся щитовидная железа вызывает сужение просвета трахеи.
- Затруднение глотания. Также узел щитовидной железы может сдавливать пищевод.
- Боль в шее или горле. Развитие рака щитовидной железы редко вызывает боль, но в сочетании с другими симптомами это сигнал незамедлительно обратиться к врачу.
Большая часть подобных симптомов связана с появлением узла щитовидной железы, который в более чем 95% случаев оказывается доброкачественным. Узлы щитовидной железы довольно частое явление, и в пожилом возрасте риск их появления увеличивается. При обнаружении узелков в области щитовидной железы следует обратиться к врачу.
Диагностика
Ультразвуковая диагностика позволяет обнаружить опухолевые образования от 2-3 мм, определить точное топографическое расположение в железе, визуализировать инвазию капсулы, оценить размеры и состояние лимфатических узлов шеи.

Магнитно-резонансная томография (МРТ) позволяет получить детальную топографо-анатомическую картину опухоли и ее соотношение с органами и структурами шеи. Это необходимо при планировании хирургического лечения в случае инвазии опухоли в соседние структуры.

Компьютерная томография применяется для определения метастатического поражения легких и костей.
Сцинтиграфия щитовидной железы с 125 I, 131 I применяется в основном для выявления остаточной тиреоидной ткани после хирургического лечения, а также для диагностики рецидивов. Она позволяет оценить способность метастазов захватывать йод при планировании радиойодтерапии.

Остеосцинтиргафия позволяет оценить наличие/отсутствие метастатического поражения костей скелета.
Тонкоигольная аспирационная биопсия выполняется преимущественно под контролем УЗИ, позволяет прицельно получить материал для цитологического исследования, что позволяет в большинстве случаев верифицировать диагноз. ТАБ подозрительных лимфатических узлов дает возможность установить метастатический характер поражения.

Позитронно-эмиссионная томография (ПЭТ) выявляет очаги повышенной метаболической активности, выполняется для диагностики метастазов РЩЖ, не накапливающих йод и не выявляемых при сцинтиграфии.
Лабораторные исследования
Кальцитонин: гормон щитовидной железы, вырабатывается С-клетками. (Норма-0-11,5 пг/мл). Значительное повышение уровня гормона наблюдается при медуллярном раке, уровень повышения связан со стадией заболевания и размерами опухоли.
Тиреоглобулин: определение уровня при дифференцированном раке щитовидной железы позволяет контролировать возникновение рецидива опухоли. После тиреоидэктомии уровень тиреоглобулина должен приближаться к нулю.
Стадирование рака щитовидной железы

Лечение
Основной метод лечения больных раком щитовидной железы – хирургическое лечение в сочетании с курсами радиойодтерапии, таргетной терапией и супрессивной гормонотерапией, а также дистанционной гамма-терапией по показаниям.
Хирургическое лечение
Объем оперативного вмешательства зависит в первую очередь от стадии заболевания, от того, насколько распространился злокачественный процесс. Кроме того, лечение определяется морфологическим вариантом опухоли и возрастом пациента.
У больных папиллярным и фолликулярным раком при небольших стадиях может выполняться гемитиреоидэктомия — удаление одной доли с оставлением или резекцией перешейка железы. При распространении опухоли (T1-3N0M0) производят тотальное удаление щитовидной железы. На поздних стадиях злокачественного процесса производят экстрафисциальную тотальную тиреоидэктомию с удалением лимфоузлов.
Если диагностирован медуллярный, недифференцированный и папиллярный рак, во всех случаях показано тотальное удаление железы — тиреоидэктомия.
Если лимфатические узлы шеи поражены метастазами, выполненяют шейную лимфаденэктомии, в некоторых случаях — расширенную шейную лимфаденэктомию с резекцией соседних органов и структур, в зависимости от распространенности процесса.
Радиойодтерапия После хирургического лечения пациентам с РПЖ назначают проведение радиойодтерапия для уничтожения возможных микрометастазов и остатков тиреоидной ткани (используется 131 I).
Дистанционная лучевая терапия: стандартом лечения является проведение неоадъювантной (предоперационной) терапии для больных с недифференцированным и плоскоклеточным РЩЖ.
Супрессивная гормональная терапия (СГТ) назначается пациентам с папиллярным и фолликулярным РЩЖ в качестве компонента комплексного лечения после операции, чтобы подавить секрецию тиреотропного гормона (ТТГ).
Химиотерапия показана при медуллярном и недифференцированном РЩЖ.
Таргетная терапия применяется для лечения медуллярного и радиойодрезистентных форм дифференцированного РЩЖ.
Наблюдение и прогноз
Сроки наблюдения
- 1й год после лечения – 1раз в 3 мес
- 2 – 3й год после лечения – 1 раз в 4 мес
- 4 – 5й год после лечения – 1 раз в 6 мес
- 6й и последующие годы после лечения – 1 раз в год
Прогноз
| 5-летняя выживаемость: | 10-летняя выживаемость: | |
| Папиллярный рак | 95,3% | 94,2% |
| Фолликулярный рак | 90,1% | 85,7% |
| Медуллярный рак | 87,8% | 80% |


Авторская публикация:
НАЖМУДИНОВ РУСТАМ АСУЛЬДИНОВИЧ ,
врач-онколог ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России
Что вам необходимо сделать
Если вы хотите узнать побольше о бесплатных возможностях ФБГУ НМИЦ онкологии им. Н.Н. Петрова Минздрава России, получить очную или заочную консультацию по диагностике и лечению, записаться на приём, ознакомьтесь с информацией на официальном сайте.
Если вы хотите общаться с нами через социальные сети, обратите внимание на аккаунты в ВКонтакте и Одноклассники.
Гормональная терапия рака простаты
Гормональная терапия также называется андрогенной депривационной или андроген-супрессивной терапией. Цель лечения – снижение в крови уровня мужских гормонов (андрогенов), или предотвращение воздействия этих гормонов на раковые клетки простаты.
Основные мужские андрогены – это тестостерон и дигидротестостерон (ДГТ). Андрогены, вырабатываются в яичках, под контролем гипоталамо-гипофизарной системы.

Глядя на изображение выше, можно увидеть, что в гипоталамусе вырабатывается рилизинг гормон лютеинизирующего гормона (ЛГРГ), т.е. вещество, под воздействием которого в гипофизе высвобождается лютеинизирующий гормон (ЛГ). В свою очередь лютеинизирующий гормон стимулирует секрецию тестостерона в яичках. 90% тестостерона вырабатывается в яичках, лишь 10% – в надпочечниках. Тестостерон, достигая клеток предстательной железы, превращается в дигидротестостерон под воздействием фермента 5-альфа-редуктазы. Дигидротестостерон в десятки раз активнее тестостерона. Дигидротестостерон и тестостерон стимулируют рост раковых клеток. Содержащийся в крови фермент ароматаза превращает тестостерон в эстрогены. Циркулирующие в крови эстрогены и андрогены по принципу обратной связи подавляют выработку ЛГ и ЛГРГ гипоталамо-гипофизарной системой.
Снижение в крови уровня андрогенов или предотвращение их воздействия на клетки простаты, приводит к сморщиванию раковых клеток или замедлению их роста. Стоит знать, что одна гормонотерапия не может полностью вылечить рак простаты.
Гормональная терапия используется:
- Когда не может быть выполнена операция или проведена радиационная терапия, или когда рак распространился за пределы предстательной железы.
- Если произошло повторное развитие рака простаты (рецидив) после хирургического или радиационного лечения.
- В комбинации с радиационной терапией, как начальное лечение рака у мужчин с высоким риском рецидива после лечения (Основываясь на высоком индексе Глисона, высоком уровне ПСА и/или распространении опухоли за пределы железы).
- Перед радиационной терапией для повышения эффективности лечения.
- Перед операцией для уменьшения простаты в размере.
Типы гормональной терапии рака простаты:
1. Хирургическая кастрация – орхэктомия
Несмотря на то, что орхэктомия – это операция, ее основной эффект связан с гормональной перестройкой. Во время операции хирург удаляет яички, в которых вырабатывается 90% андрогенов. После удаления источника андрогенов со временем происходит снижение их концентрации в крови и остановка роста опухоли или ее сморщивание.
Орхэктомия – операция, которая может выполняться в амбулаторных условиях. Для достижения удовлетворительного косметического эффекта, удаленные яички могут заменяться искусственными имплантами. Хирургическая кастрация – наиболее легкий и дешевый способ снижения уровня андрогенов в крови.

2. Медикаментозная гормональная терапия рака простаты
В лечении рака простаты могут использоваться следующие группы препаратов:
- Аналоги, или агонисты рилизинг-гормона лютеинизирующего гормона (ЛГРГ)
Благодаря использованию этих препаратов достигается эффект аналогичный эффекту хирургической кастрации, т.е. происходит снижение уровня андрогенов в крови. Это так называемая медикаментозная кастрация. Суть действия аналогов ЛГРГ заключается в том, что в связи со схожестью их химического строения с истинным гормоном, аналоги связываются с рецепторами гипоталамуса, но при этом не стимулируют, а наоборот снижают секрецию ЛГ. Это в конечном итоге приводит к снижению уровня тестостерона в крови. В отличие от хирургической кастрации, эффект медикаментозной кастрации обратим после отмены препаратов. К препаратам группы аналогов ЛГРГ относятся леупролид, гозерелин, трипторелин и др. Препараты могут использоваться в виде подкожных инъекций или имплантов. В зависимости от вида препарата, частота его введения может варьировать от одного месяца до года. Первый прием аналога ЛГРГ сопровождается кратковременным подъемом уровня тестостерона, после чего происходит его снижение до минимальной концентрации в крови. Первая инъекция у пациентов с распространенным раком сопровождается обострением опухолевого процесса и ухудшением симптомов заболевания. Такой феномен носит название вспышки. Он проявляется выраженными костными болями, компрессией спинного мозга, нарушением свертывания крови и др. Для предотвращения феномена вспышки на две недели назначаются антиандрогенные препараты.

Несмотря на то, что яички – основное место выработки тестостерона, небольшая его часть (10%) образуется в надпочечниках. Поэтому не всегда блокировка выработки андрогенов в яичках полностью снижает их концентрацию в крови, это значит, что надо блокировать и андрогены, образовавшиеся в надпочечниках. Иногда некоторые врачи использует антиандрогены как монотерапию рака простаты вместо орхэктомии или лечения агонистами ЛГРГ. Согласно результатам ряда исследований не выявлено разницы в выживаемости между пациентами, у которых гормональная терапия рака простаты проводилась агонистами ЛГРГ и антиандрогенами, хотя несколько работ свидетельствуют о более низкой эффективности антиандрогенов.
Чаще всего антиандрогены используются в комбинации с орхэктомией или агонистами ЛГРГ. Такое лечение называется комбинированной андрогенной блокадой.
К группе антиандрогенов относятся следующие лекарственные средства: ципротерона ацетат, флутамид, бикалутамид.
Во многих странах, применение ципротерона ацетата ограничено в связи с его выраженными побочными эффектами, в особенности тяжелыми поражениями печени после длительного приема препарата. Однако в ряде случаев лечение ципротероном оправдано, несмотря на побочные эффекты. Многие мужчины жалуются на диарею, ассоциированную с приемом флутамида. Флутамид и высокие дозы бикалуамида реже вызывают эректильную дисфункцию и другие побочные эффекты, по сравнению агонистами ЛГРГ. Но эти препараты чаще приводят к набуханию грудных желез и слабости.
Блокаторы рилизинг-гормона лютеинизирующего гормона (ЛГРГ) – они блокируют выработку ЛГ гипофизом, что в свою очередь останавливает синтез тестостерона. Эффект препаратов аналогичен действию агонистов ЛГРГ, но в отличие от агонистов, антагонисты приводят к более быстрому снижению уровня тестостерона в крови и не вызывают феномена вспышки. В настоящее время существует один препарат этой группы – дегареликс. Препарат вводится подкожно раз в месяц. Наиболее частые побочные эффекты: боль, покраснение и припухание в месте инъекции, повышение уровня ферментов печени.
Применение эстрогенов – женских гормонов – является альтернативой орхэктомии у мужчин с распространенным раком простаты. Многонаправленное действие эстрогенов (подавление секреции ЛГРГ, дезактивация андрогенов и др.) приводит к снижению уровня тестостерона в крови. Однако в связи тяжелыми побочными эффектами эстрогенов, а именно формированием тромбов и осложнениями со стороны сердечно-сосудистой системы, они были вытеснены аналогами ЛГРГ и анти-андрогенами. Тем не менее, эстрогены применяются в случае неэффективности андрогенной блокады.
К этой группе препаратов относится лишь одно лекарственное средство – абиратерон. Абиратерон был одобрен в апреле 2011 года для лечения мужчин с метастатическим раком простаты, резистентным к другим типам гормональной терапии или химиотерапии доцитакселом. Путем подавления активности фермента, участвующего в синтезе тестостерона, абиратерон подавляет выработку тестостерона и снижает его концентрацию в крови. При этом препарат подавляет синтез тестостерона и в яичках, и в надпочечниках, и в раковых клетках.
Побочные эффекты гормональной терапии
Увеличение и боль грудных желез, известные также как и гинекомастия, проявляются следующими симптомами: повышенная чувствительность и болезненность сосков, увеличение объема груди. Гинекомастия наблюдается при приеме антиандрогенов и эстрогенов.
Осложнения со стороны сердечно-сосудистой системы наблюдаются при длительном приеме эстрогенных препаратов. Образование тромбов, сердечные приступы – серьезные осложнения эстрогенной терапии. Прием противосвертывающих препаратов значительно снижает риск осложнений.
Изменение уровня холестерина в крови. Использование антиандрогенов повышает уровень холестерина и триглицеридов в крови.
Диарея и/или запор – побочный эффект гормональной терапии рака простаты, ассоциированный с приемом антиандрогенов.
Эректильная дисфункция/снижение либидо. Прием антиандрогенов и агонистов ЛГРГ вызывает эректильную дисфункцию, а агонисты еще и снижают либидо.
Усталость и утомляемость сопутствуют терапии антиандрогенами, агонистами ЛГРГ и эстрогенами.
Изменения скорости роста волос. Мужчины могут заметить, что на голове увеличилось количество волос, в то время как на остальных участках тела наблюдается потеря волос. Эти эффекты характерны для антиандрогенов и агонистов ЛГРГ.
Приливы (ощущения жара) наблюдаются при снижении уровня тестостеронов в крови. Частота и выраженность приливов индивидуальна для каждого мужчины.
Остеопороз. Применение любого из гормональных препаратов снижает уровень тестостеронов в крови и приводит к развитию остеопороза. Выраженность разрушения костей зависит от ряда факторов, таких как общее состояние здоровья до начала лечения, длительность гормонотерапии и др.
Уменьшение в размере пениса и мошонки. Снижение уровня тестостеронов в крови может иметь потенциальный риск уменьшения в размере мошонки и пениса.
Прибавка в весе и отложение жира в области живота. Антиандрогены и агонисты ЛГРГ предрасполагают к развитию ожирения.
Супрессивная гормональная терапия при узловой патологии щитовидной железы
Супрессивная гормональная терапия препаратами левотироксина (СТЛ) является средством первого выбора в курации больных с узловой патологией щитовидной железы, не нуждающихся в хирургическом вмешательстве. Подбор индивидуальной дозы, подавляющей концентрацию тиреотропного гормона в сыворотке крови до субнормальных значений, но обеспечивающей нормальное содержание тироксина и трийодтиронина — практическая задача врача-эндокринолога в случаях, когда имеются показания к СТЛ. В результате назначения левотироксина в супрессивной дозе на 3-6 месяцев и более отмечается стабилизация процесса — узел перестает прогрессировать в росте, не возникают новые перинодулярные фокусы.
Последние десятилетия стала чрезвычайно актуальной проблема узловой патологии щитовидной железы (ЩЖ), что связано с рядом причин. Во-первых, установлена реально высокая распространенность этой группы заболеваний: у детей ее частота составляет около 1%, у лиц старшего возраста (особенно у женщин) увеличивается до 7-10%, а у пожилых достигает 20% и более. Во-вторых, ослабление контроля за проведением профилактики, за состоянием окружающей среды, ряд техногенных аварий (в т.ч. на Чернобыльской АЭС) обусловили существенный рост заболеваемости по всем классам узловой патологии ЩЖ в конце XX – начале XXI века. В-третьих, наибольшая медико-социальная значимость среди этих заболеваний отводится онкологической патологии, нарастающая распространенность которой особенно настораживает. Но именно в отношении терапии последней в настоящее время достигнуты очевидные успехи, определяющие увеличение продолжительности и повышение качества жизни.
Безусловно, сложные аспекты хирургической тактики и лучевой терапии при раке ЩЖ относятся к профессиональной компетенции соответствующих специалистов и служб. Однако потребность в оказании лечебной помощи такого профиля возникает лишь у небольшой части пациентов с узлами в ЩЖ, поскольку доля тиреоидной карциномы в структуре нодулярных заболеваний этого органа не превышает 5%. Значительно больший интерес вызывают современные подходы к ведению больных с неонкологической патологией, среди которой доминируют, главным образом, псевдоопухолевые варианты без гиперфункции, в разной степени пролиферирующий нетоксический узловой коллоидный зоб (солитарные узлы, многоузловой зоб). В то же время арсенал врачебных возможностей и средств, используемый при лечении этих заболеваний, достаточно ограничен. К вариантам терапевтического ведения пациентов с доброкачественными узловыми поражениями ЩЖ на сегодняшний день можно отнести следующие пять способов:
- наблюдение (клинико-гормональное и ультразвуковое) на фоне массовой йодной профилактики или индивидуального назначения йодистых препаратов;
- супрессивная гормональная терапия препаратами левотироксина (СТЛ);
- лучевая терапия радиоактивным йодом-131;
- склерозирующая терапия (подкожные инъекции этанола);
- лазерная фотокоагуляция.
Следует отметить, что последние три способа, по разным причинам, не имеют в настоящее время широкого распространения в отечественной практике (техническое несовершенство, дефицит оборудования и лечебной субстанции, отсутствие достаточного опыта). Поэтому при установлении доброкачественного характера поражения у любого пациента с узлом в ЩЖ (без тиреотоксикоза и признаков сдавления органов шеи и/или средостения, что требует оперативного вмешательства) врачебные возможности сводятся к выбору одного из двух оставшихся способов: «Лечить (гормональная терапия) – или не лечить? (наблюдать)». Иными словами, возможность активного ведения узловой патологии ЩЖ в таких ситуациях может быть реализована только в рамках обсуждения показаний к назначению СТЛ.
В мире гормональная терапия используется уже более четырех десятилетий. Первая попытка придать ей легитимный характер была предпринята в 1960 г. в работе американских медиков Э. Аствуда, С. Кэссиди и Г. Аурбаха. С этого времени методология лечения, показания к СТЛ и противопоказания к ней продолжают широко обсуждаться – в мировой литературе по этому вопросу опубликовано более 200 статей, монографий, глав в учебниках и практических руководствах.
Примечательно, что в начале 90-х гг. прошлого века первая экспертиза реальной эффективности и безопасности СТЛ, представленная в серии работ, не смогла объективно установить явных преимуществ гормональной терапии перед выжидательной тактикой ведения. Но поскольку действительно перспективных способов альтернативного лечения так и не появилось, а проблема массовой патологии требовала решения, то неудачи первых лет стали основой оптимизации и стандартизации СТЛ. Последние 10 лет СТЛ стала предметом особо активного изучения – вплоть до многоцентровых двойных слепых плацебо-контролируемых клинических испытаний.
После проведения нескольких таких исследований, результаты которых были опубликованы после 1997 г., стало ясно, что при условии соблюдения несложной технологии и особой техники лечения СТЛ является средством первого выбора в лечении больных, не нуждающихся в хирургическом вмешательстве. Наиболее достоверным доказательством этого стали данные специального научного опроса, недавно проведенного среди ведущих экспертов по рассматриваемой проблеме, являющихся членами профессиональных организаций эндокринологов, хирургов и радиологов. Так, для лечения солитарного нетоксического узлового зоба СТЛ избрала почти половина (42-47%) представителей Европейской и Северо-Американск.