Рак щитовидной железы
Рак щитовидной железы – злокачественное узловое образование, способное образовываться из эпителия, естественно функционирующего в железе.
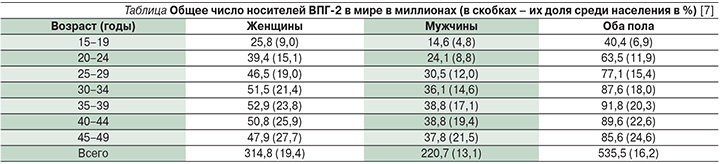
Рак щитовидной железы составляет более четверти всех злокачественных новообразований в области головы и шеи. За последние десятилетия, по данным ВОЗ, заболеваемость РЩЖ в мире выросла в 2 раза. Рак щитовидной железы ежегодно является причиной смерти 1% всех больных, умирающих от злокачественных опухолей. Среди всех злокачественных новообразований, это заболевание составляет 0.5 — 3.5 %. То есть на 100 000 населения РЩЖ заболевают в среднем 0.5-0.6 мужчин и 1.2-1.6 женщин.
В России самые высокие показатели заболеваемости отмечаются в Брянской области: 4.9 на 100 000 мужчин и 26.3 на 100 000 женщин. Также наиболее неблагополучные районы в отношении заболеваемости РЩЖ — Архангельская, Саратовская, Свердловская и Магаданская области.
Факторы риска развития рака щитовидной железы
Основные факторы риска:
- Йодная недостаточность
- Ионизирующее излучение (Радиация)
- Наследственность (Семейный анамнез)
К факторам риска также относится наличие у пациентов узловых образований в щитовидной железе, т.е. узловые зобы, рецидивирующие их формы, узловые формы хронических тироидитов.
Йодная недостаточность
Регионы мира с пониженным содержанием йода в воде и пищевых продуктах, являются эндемичными для узлового зоба, на фоне которого нередко развивается рак щитовидной железы. В Российской Федерации эндемичными районами считаются Алтайский край и республика Адыгея.
Ионизирующая радиация
С момента обнаружения данного физического явления и до настоящего момента роль этого фактора, как причины развития РЩЖ, резко возросла. Действие данного фактора, прежде всего, связано с попаданием в организм радиоактивных изотопов йода ( 131 I, 125 I). Так, было установлено, что жители Хиросимы и Нагасаки, которые попали под облучение после взрыва атомных бомб, болели раком щитовидной железы в 10 раз чаще, чем остальные японцы.
В России был отмечен резкий рост заболеваемости РЩЖ, особенно у детей, в регионах, которые подверглись радиоактивному загрязнению после аварии на Чернобыльской АЭС, это Брянская, Тульская, Рязанская области.
Наследственность
Риск развития РЩЖ выше в семьях, где отмечались случаи этого заболевания. Наследственная форма рака связана с наследственными синдромами множественной эндокринной неоплазии (МЭН).
Типы рака щитовидной железы
По гистологическим формам классифицируются четыре типа рака щитовидной железы: папиллярный, фолликулярный, медуллярный и анапластический.
Папиллярный рак — наиболее благоприятный тип. Встречается у детей и взрослых, чаще заболевают в 30-40 лет. Является преобладающей формой РЩЖ у детей. Опухоль чаще возникает в одной из долей и лишь у 10-15% пациентов отмечается двустороннее поражение.
Папиллярная карцинома отличается достаточно медленным ростом. Метастазирует в лимфоузлы шеи, отдаленные метастазы в другие органы наблюдаются редко.
Фолликулярный рак встречается у взрослых с пиком заболеваемости в 50-55-м возрасте. Этот вид опухоли характеризуется медленным ростом. В поздних стадиях образует метастазы в лимфатических узлах шеи, а также в костях, печени и легких. Метастазы фолликулярного рака сохраняют способность захватывать йод и синтезировать тиреоглобулин.
Медуллярный рак может быть как самостоятельным заболеванием, так и компонентом МЭН синдрома. Чаще определяется в пожилой возрастной группе пациентов с узловым зобом. Характеризуется быстрым ростом с инвазией в близлежащие органы и ранним метастазированием.
Анапластический рак чаще возникает у пожилых пациентов с узловым зобом. Его отличает агрессивная форма и раннее метастазирование. Быстрый рост опухолевого узла может приводить к его некротическому распаду, изъязвлению и может служить источником кровотечений.
Гистогенетическая классификация рщж
| ИСТОЧНИК РАЗВИТИЯ | ГИСТОЛОГИЧЕСКАЯ СТРУКТУРА ОПУХОЛИ | |
| доброкачественные | злокачественные | |
| А-клетки | Папиллярная аденома | |
Симптомы
Заболевание может проявляться различными симптомами. Они зависят от стадии, распространенности опухолевого процесса и развившихся осложнений. Небольшие опухоли щитовидной железы обычно не сопровождаются клинической симптоматикой и выявляются случайно при ультразвуковом исследовании. Первой причиной обращения к врачу может послужить увеличение одного шейного лимфатического узла, который при дальнейшем обследовании оказывается метастазом РЩЖ.
Симптомы рака щитовидной железы часто схожи с симптомами простуды, ангины, инфекционных заболеваний:
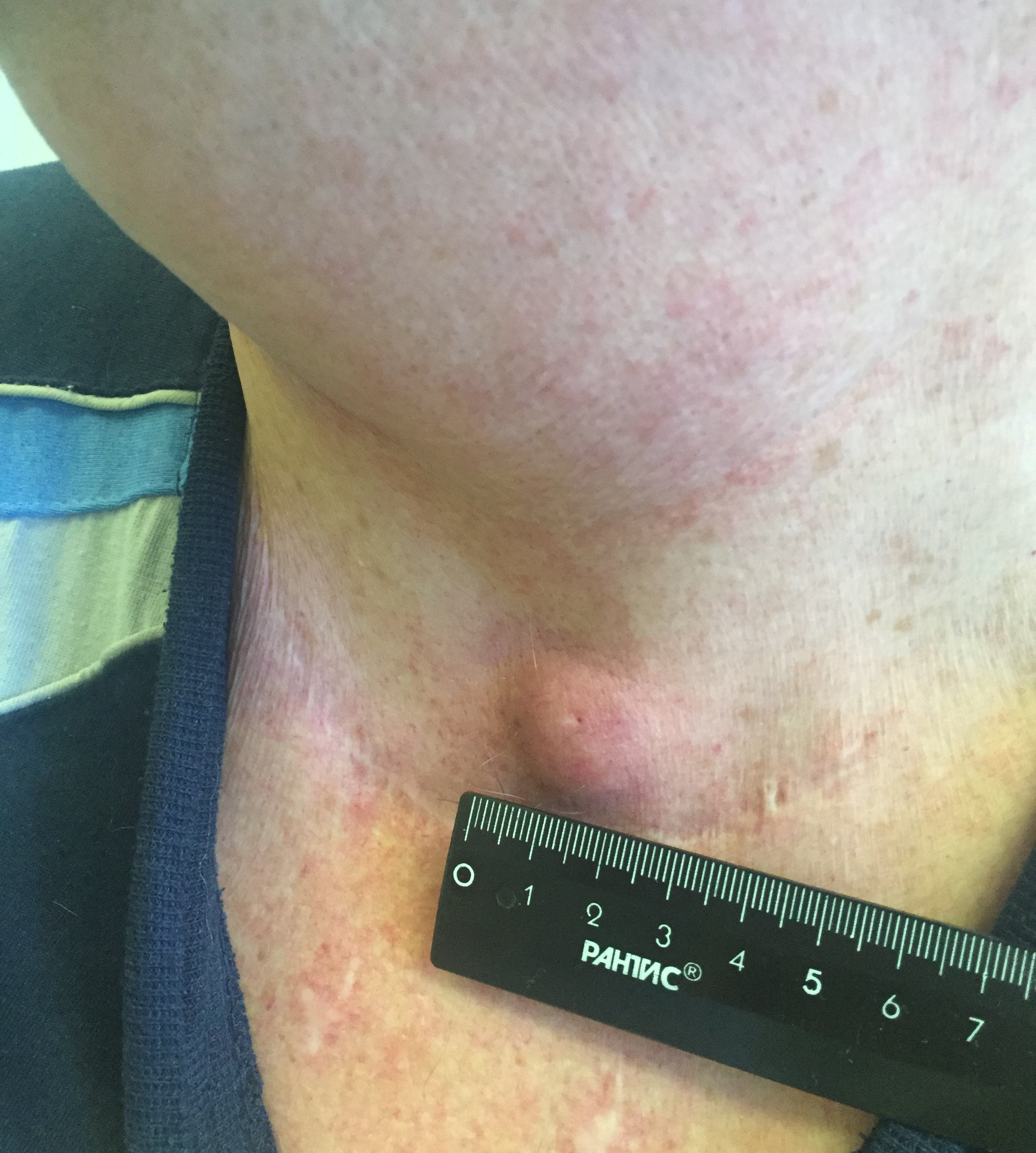
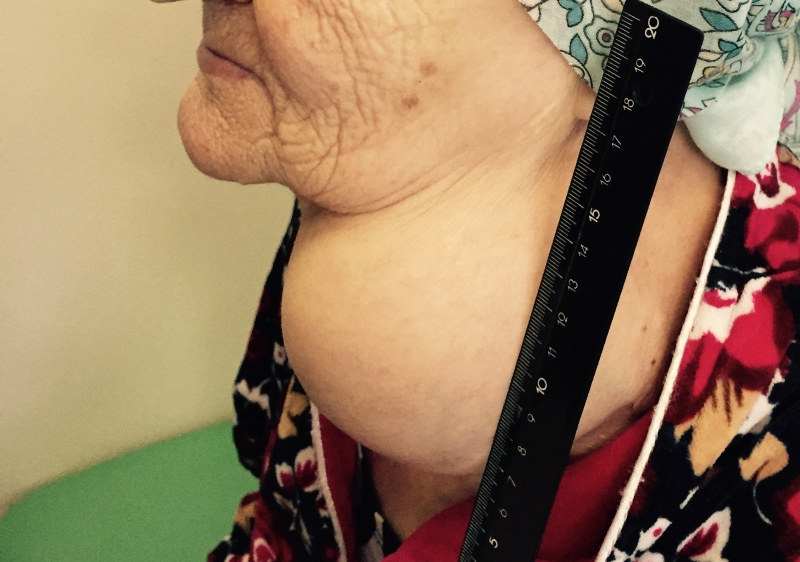
- Припухлость на шее. Небольшие узлы на шее может выявить только врач, но иногда припухлость можно заметить во время глотания.
- Увеличение шейных лимфоузлов. Однако, этот симптом часто сопровождает простуду или ангину и не связан со злокачественным процессом.
- Изменение тембра голоса. Иногда большой узел щитовидной железы давит на гортань, это может вызвать охриплость.
- Одышка. Причиной может явиться то, что увеличившаяся щитовидная железа вызывает сужение просвета трахеи.
- Затруднение глотания. Также узел щитовидной железы может сдавливать пищевод.
- Боль в шее или горле. Развитие рака щитовидной железы редко вызывает боль, но в сочетании с другими симптомами это сигнал незамедлительно обратиться к врачу.
Большая часть подобных симптомов связана с появлением узла щитовидной железы, который в более чем 95% случаев оказывается доброкачественным. Узлы щитовидной железы довольно частое явление, и в пожилом возрасте риск их появления увеличивается. При обнаружении узелков в области щитовидной железы следует обратиться к врачу.
Диагностика
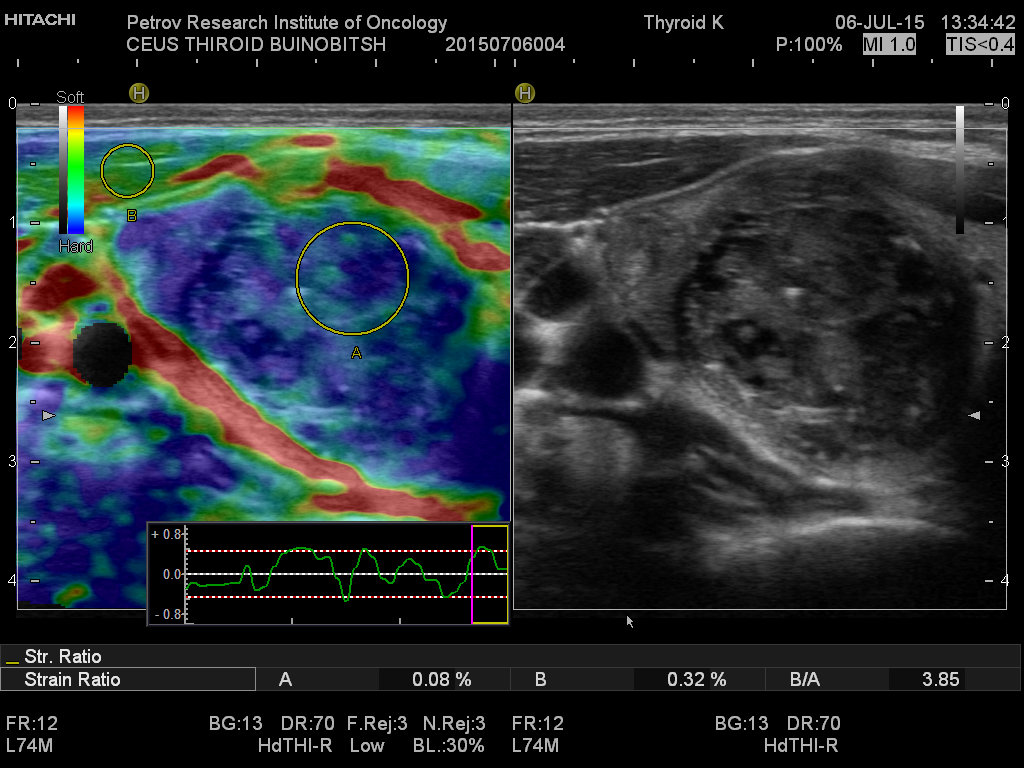
Ультразвуковая диагностика позволяет обнаружить опухолевые образования от 2-3 мм, определить точное топографическое расположение в железе, визуализировать инвазию капсулы, оценить размеры и состояние лимфатических узлов шеи.
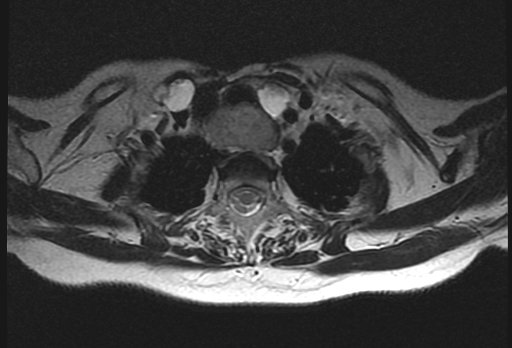
Магнитно-резонансная томография (МРТ) позволяет получить детальную топографо-анатомическую картину опухоли и ее соотношение с органами и структурами шеи. Это необходимо при планировании хирургического лечения в случае инвазии опухоли в соседние структуры.
Компьютерная томография применяется для определения метастатического поражения легких и костей.
Сцинтиграфия щитовидной железы с 125 I, 131 I применяется в основном для выявления остаточной тиреоидной ткани после хирургического лечения, а также для диагностики рецидивов. Она позволяет оценить способность метастазов захватывать йод при планировании радиойодтерапии.
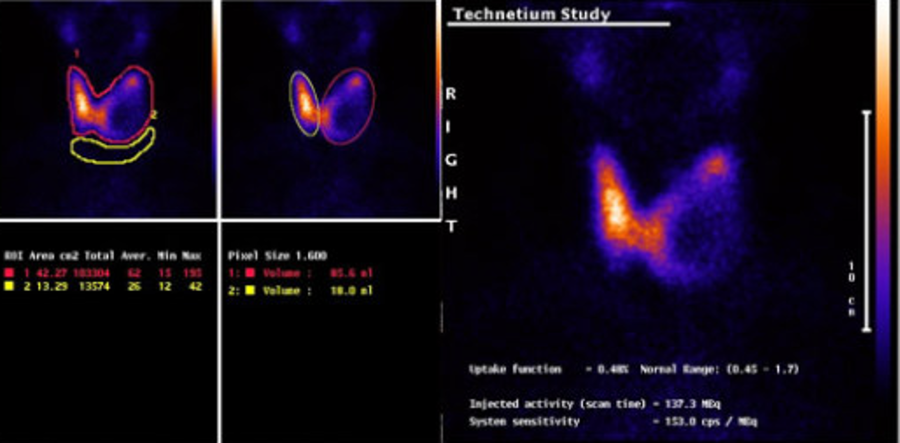
Остеосцинтиргафия позволяет оценить наличие/отсутствие метастатического поражения костей скелета.
Тонкоигольная аспирационная биопсия выполняется преимущественно под контролем УЗИ, позволяет прицельно получить материал для цитологического исследования, что позволяет в большинстве случаев верифицировать диагноз. ТАБ подозрительных лимфатических узлов дает возможность установить метастатический характер поражения.
Позитронно-эмиссионная томография (ПЭТ) выявляет очаги повышенной метаболической активности, выполняется для диагностики метастазов РЩЖ, не накапливающих йод и не выявляемых при сцинтиграфии.
Лабораторные исследования
Кальцитонин: гормон щитовидной железы, вырабатывается С-клетками. (Норма-0-11,5 пг/мл). Значительное повышение уровня гормона наблюдается при медуллярном раке, уровень повышения связан со стадией заболевания и размерами опухоли.
Тиреоглобулин: определение уровня при дифференцированном раке щитовидной железы позволяет контролировать возникновение рецидива опухоли. После тиреоидэктомии уровень тиреоглобулина должен приближаться к нулю.
Стадирование рака щитовидной железы

Лечение
Основной метод лечения больных раком щитовидной железы – хирургическое лечение в сочетании с курсами радиойодтерапии, таргетной терапией и супрессивной гормонотерапией, а также дистанционной гамма-терапией по показаниям.
Хирургическое лечение
Объем оперативного вмешательства зависит в первую очередь от стадии заболевания, от того, насколько распространился злокачественный процесс. Кроме того, лечение определяется морфологическим вариантом опухоли и возрастом пациента.
У больных папиллярным и фолликулярным раком при небольших стадиях может выполняться гемитиреоидэктомия — удаление одной доли с оставлением или резекцией перешейка железы. При распространении опухоли (T1-3N0M0) производят тотальное удаление щитовидной железы. На поздних стадиях злокачественного процесса производят экстрафисциальную тотальную тиреоидэктомию с удалением лимфоузлов.
Если диагностирован медуллярный, недифференцированный и папиллярный рак, во всех случаях показано тотальное удаление железы — тиреоидэктомия.
Если лимфатические узлы шеи поражены метастазами, выполненяют шейную лимфаденэктомии, в некоторых случаях — расширенную шейную лимфаденэктомию с резекцией соседних органов и структур, в зависимости от распространенности процесса.
Радиойодтерапия После хирургического лечения пациентам с РПЖ назначают проведение радиойодтерапия для уничтожения возможных микрометастазов и остатков тиреоидной ткани (используется 131 I).
Дистанционная лучевая терапия: стандартом лечения является проведение неоадъювантной (предоперационной) терапии для больных с недифференцированным и плоскоклеточным РЩЖ.
Супрессивная гормональная терапия (СГТ) назначается пациентам с папиллярным и фолликулярным РЩЖ в качестве компонента комплексного лечения после операции, чтобы подавить секрецию тиреотропного гормона (ТТГ).
Химиотерапия показана при медуллярном и недифференцированном РЩЖ.
Таргетная терапия применяется для лечения медуллярного и радиойодрезистентных форм дифференцированного РЩЖ.
Наблюдение и прогноз
Сроки наблюдения
- 1й год после лечения – 1раз в 3 мес
- 2 – 3й год после лечения – 1 раз в 4 мес
- 4 – 5й год после лечения – 1 раз в 6 мес
- 6й и последующие годы после лечения – 1 раз в год
Прогноз
| 5-летняя выживаемость: | 10-летняя выживаемость: | |
| Папиллярный рак | 95,3% | 94,2% |
| Фолликулярный рак | 90,1% | 85,7% |
| Медуллярный рак | 87,8% | 80% |

Авторская публикация:
НАЖМУДИНОВ РУСТАМ АСУЛЬДИНОВИЧ ,
врач-онколог ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России
Что вам необходимо сделать
Если вы хотите узнать побольше о бесплатных возможностях ФБГУ НМИЦ онкологии им. Н.Н. Петрова Минздрава России, получить очную или заочную консультацию по диагностике и лечению, записаться на приём, ознакомьтесь с информацией на официальном сайте.
Если вы хотите общаться с нами через социальные сети, обратите внимание на аккаунты в ВКонтакте и Одноклассники.
Что такое супрессивная терапия
Супрессивная гормональная терапия препаратами левотироксина (СТЛ) является средством первого выбора в курации больных с узловой патологией щитовидной железы, не нуждающихся в хирургическом вмешательстве. Подбор индивидуальной дозы, подавляющей концентрацию тиреотропного гормона в сыворотке крови до субнормальных значений, но обеспечивающей нормальное содержание тироксина и трийодтиронина — практическая задача врача-эндокринолога в случаях, когда имеются показания к СТЛ. В результате назначения левотироксина в супрессивной дозе на 3-6 месяцев и более отмечается стабилизация процесса — узел перестает прогрессировать в росте, не возникают новые перинодулярные фокусы.
Последние десятилетия стала чрезвычайно актуальной проблема узловой патологии щитовидной железы (ЩЖ), что связано с рядом причин. Во-первых, установлена реально высокая распространенность этой группы заболеваний: у детей ее частота составляет около 1%, у лиц старшего возраста (особенно у женщин) увеличивается до 7-10%, а у пожилых достигает 20% и более. Во-вторых, ослабление контроля за проведением профилактики, за состоянием окружающей среды, ряд техногенных аварий (в т.ч. на Чернобыльской АЭС) обусловили существенный рост заболеваемости по всем классам узловой патологии ЩЖ в конце XX – начале XXI века. В-третьих, наибольшая медико-социальная значимость среди этих заболеваний отводится онкологической патологии, нарастающая распространенность которой особенно настораживает. Но именно в отношении терапии последней в настоящее время достигнуты очевидные успехи, определяющие увеличение продолжительности и повышение качества жизни.
Безусловно, сложные аспекты хирургической тактики и лучевой терапии при раке ЩЖ относятся к профессиональной компетенции соответствующих специалистов и служб. Однако потребность в оказании лечебной помощи такого профиля возникает лишь у небольшой части пациентов с узлами в ЩЖ, поскольку доля тиреоидной карциномы в структуре нодулярных заболеваний этого органа не превышает 5%. Значительно больший интерес вызывают современные подходы к ведению больных с неонкологической патологией, среди которой доминируют, главным образом, псевдоопухолевые варианты без гиперфункции, в разной степени пролиферирующий нетоксический узловой коллоидный зоб (солитарные узлы, многоузловой зоб). В то же время арсенал врачебных возможностей и средств, используемый при лечении этих заболеваний, достаточно ограничен. К вариантам терапевтического ведения пациентов с доброкачественными узловыми поражениями ЩЖ на сегодняшний день можно отнести следующие пять способов:
- наблюдение (клинико-гормональное и ультразвуковое) на фоне массовой йодной профилактики или индивидуального назначения йодистых препаратов;
- супрессивная гормональная терапия препаратами левотироксина (СТЛ);
- лучевая терапия радиоактивным йодом-131;
- склерозирующая терапия (подкожные инъекции этанола);
- лазерная фотокоагуляция.
Следует отметить, что последние три способа, по разным причинам, не имеют в настоящее время широкого распространения в отечественной практике (техническое несовершенство, дефицит оборудования и лечебной субстанции, отсутствие достаточного опыта). Поэтому при установлении доброкачественного характера поражения у любого пациента с узлом в ЩЖ (без тиреотоксикоза и признаков сдавления органов шеи и/или средостения, что требует оперативного вмешательства) врачебные возможности сводятся к выбору одного из двух оставшихся способов: «Лечить (гормональная терапия) – или не лечить? (наблюдать)». Иными словами, возможность активного ведения узловой патологии ЩЖ в таких ситуациях может быть реализована только в рамках обсуждения показаний к назначению СТЛ.
В мире гормональная терапия используется уже более четырех десятилетий. Первая попытка придать ей легитимный характер была предпринята в 1960 г. в работе американских медиков Э. Аствуда, С. Кэссиди и Г. Аурбаха. С этого времени методология лечения, показания к СТЛ и противопоказания к ней продолжают широко обсуждаться – в мировой литературе по этому вопросу опубликовано более 200 статей, монографий, глав в учебниках и практических руководствах.
Примечательно, что в начале 90-х гг. прошлого века первая экспертиза реальной эффективности и безопасности СТЛ, представленная в серии работ, не смогла объективно установить явных преимуществ гормональной терапии перед выжидательной тактикой ведения. Но поскольку действительно перспективных способов альтернативного лечения так и не появилось, а проблема массовой патологии требовала решения, то неудачи первых лет стали основой оптимизации и стандартизации СТЛ. Последние 10 лет СТЛ стала предметом особо активного изучения – вплоть до многоцентровых двойных слепых плацебо-контролируемых клинических испытаний.
После проведения нескольких таких исследований, результаты которых были опубликованы после 1997 г., стало ясно, что при условии соблюдения несложной технологии и особой техники лечения СТЛ является средством первого выбора в лечении больных, не нуждающихся в хирургическом вмешательстве. Наиболее достоверным доказательством этого стали данные специального научного опроса, недавно проведенного среди ведущих экспертов по рассматриваемой проблеме, являющихся членами профессиональных организаций эндокринологов, хирургов и радиологов. Так, для лечения солитарного нетоксического узлового зоба СТЛ избрала почти половина (42-47%) представителей Европейской и Северо-Американской Тиреоидологических Ассоциаций, а для лечения многоузлового нетоксического зоба – большая их часть (52-56%). Наибольшее предпочтение консервативному ведению отдают специалисты из стран, расположенных в йододефицитных регионах Европы (Германия, Италия, Франция), тогда как представители неэндемичных территорий, наряду с гормональной, одинаково часто избирали и лучевую терапию – лечение радиойодом (Великобритания, Дания, Канада, США).
Определение понятий.Сущность СТЛ
Сравнительно недавно стало известно, что разные клетки организма человека обладают различной чувствительностью к гормонам ЩЖ. Это связано с тем, что поверхностные мембраны и ядра соматических и эндокринных клеток в своем составе имеют, как минимум, 2 типа и 5 подтипов рецепторов к тиреоидным гормонам (рис. 1). При этом в аденогипофизе, на клеточных мембранах тиреотропоцитов – клеток, продуцирующих тиреотропный гормон (ТТГ), обнаружена максимальная концентрация рецепторов типа b. Эти рецепторы обладают исключительно высокой чувствительностью к левотироксину и поэтому раньше, чем другие клетки на периферии и в головном мозге (богатые рецепторами иных типов и подтипов), реагируют на минимальные и даже транзиторные колебания концентрации гормона в системном кровотоке. При введении погранично высокой дозы левотироксина возникает ситуация, когда все периферические ткани – менее чувствительные, чем тиреотропоциты гипофиза – сохраняют клинически эутиреоидное состояние, тогда как уровень ТТГ уже подавляется до значений ниже нормальных. Иными словами, для каждого человека можно подобрать такую индивидуальную дозу препарата, при приеме которой самочувствие будет оставаться хорошим (на фоне нормальных значений свободных фракций гормонов ЩЖ и при отсутствии симптомов тиреотоксикоза), а лабораторно будет выявляться передозировка – субклинический медикаментозный гипертиреоз.
Подбор именно такой дозы – подавляющей концентрацию ТТГ в сыворотке крови до субнормальных значений, но обеспечивающей нормальное содержание тироксина и трийодтиронина – представляет клинический интерес и практическую задачу для врача-эндокринолога в случаях, когда имеются показания к СТЛ (табл. 1). Известно, что в ряде случаев узлообразование в ЩЖ имеет ТТГ-зависимый характер, когда даже нормальный уровень гипофизарного гормона способствует активации пролиферативной активности отдельных тиреоцитов. При этом не так уж важно, оказывает ли при этом ТТГ самостоятельный эффект или его влияние опосредованно потенцированием стимулирующих свойств разнообразных ростовых факторов. Это вопрос нерешенный, и его рассмотрение не входит в задачи настоящей публикации. С терапевтической точки зрения более важно то, что в результате назначения левотироксина в супрессивной дозе в течение 3-6 месяцев и дольше отмечается стабилизация процесса. Более чем у половины пациентов узел перестает увеличиваться, и не возникают новые перинодулярные фокусы, что нередко бывает при спонтанном течении. Более чем у четверти больных объем узла со временем уменьшается не менее чем в 2 раза (табл. 2).
Диагностика и показания к оперативному лечению
С учетом современных технических и методических возможностей эхографии ЩЖ, под узлом подразумевается очаговое поражение доли или перешейка железы, минимальные размеры которого превышают 0,4 см. Так как любой узел представляет собой объемное образование, требуется обязательное измерение его трех линейных размеров (в плоскостях поперечного и продольного сечения пораженной доли). Эта рекомендация подлежит безусловному выполнению, особенно в случае назначения СТЛ при некоторых вариантах тиреоидных узлов (при небольших размерах и доброкачественном характере по данным микроскопии пунктата). Наиболее информативным способом оценки эффективности консервативного лечения служит определение динамики объема узла, для расчета которого необходимы сведения о длине, ширине и толщине образования. Так как форма подобных очагов обычно округлая или овоидная, для вычисления объема узла (в мл или см3) чаще используют упрощенную формулу: перемножение 3 линейных размеров и деление полученного произведения на 2.
Для практической деятельности наиболее удобна следующая классификация узлов ЩЖ:
- солитарный узел – одиночное образование (чаще – истинная первичная опухоль) на фоне неувеличенной ЩЖ, т.е. при нормальной величине тиреоидного объема (термин «узловой зоб» в качестве синонима мы считаем менее удачным);
- диффузно-узловой (смешанный) зоб – узел в зобе, т.е. на фоне диффузного разрастания окружающей тиреоидной ткани, как проявление единого заболевания (узловая стадия зобной трансформации) или сочетанной патологии (опухоль на фоне эндемического зоба или аутоиммунного тиреоидита);
- многоузловой зоб.
Далее, по результатам дополнительной клинико-гормональной оценки (физикальное обследование с определением в сыворотке крови уровней ТТГ, свободного тироксина, трийодтиронина), предварительное заключение о выявленном узловом заболевании уточняется эндокринологом с указанием функционального состояния ЩЖ как нетоксический (при гипо- или эутиреозе) или токсический вариант (при наличии тиреотоксикоза).
Патологическое значение узлового эутиреоидного зоба сводится к следующим рискам:
- Относительно небольшой риск того, что узел является раком ЩЖ, который, в свою очередь, по современным представлениям, является излечимым заболеванием;
- Относительно небольшой риск значительного увеличения ЩЖ со сдавлением окружающих органов и/или формирования косметического дефекта;
- Вполне определенный риск развития функциональной автономии ЩЖ и тиреотоксикоза (спонтанного или йод-индуцированного) спустя десятки лет после его формирования.
По результатам морфологического исследования материала, полученного путем пункционной биопсии узла, определяются показания для завершения обследования и лечения в специализированном онкологическом стационаре (рис. 2). Это необходимо не только при явно злокачественном характере процесса (папиллярный рак), но и при сомнительной (подозрительной или суспициозной) картине, которая не позволяет гарантированно исключить рак. Так, при цитологическом исследовании, в ходе которого исследуются только тиреоциты (технически нереально оценить состояние капсулы и сосудов), невозможно отличить фолликулярную аденому от высокодифференцированного рака ЩЖ (фолликулярная карцинома). В этой связи заключение цитолога о наличии «фолликулярной неоплазии» («фолликулярной опухоли») является показанием к оперативному лечению, хотя при последующем гистологическом уточнении в большинстве случаев будет выявлена аденома, а не рак. Объем и характер онкологического лечения (тиреоидэктомия, радиойодаблация) определяются в соответствии с международными стандартами по особым протоколам, имеющимся в специальной литературе.
При доброкачественном характере цитограммы консультация онколога необязательна, а вопрос о лечебной тактике решается в зависимости от размеров образования. Крупные узлы (как правило, имеющие у детей объем более 1 мл и/или максимальный линейный размер более 15 мм, а у взрослых – 3-4 см), особенно при наличии компрессионного синдрома, подлежат оперативному удалению в условиях эндокринологического хирургического стационара. Симптомы сдавления следует исключать со стороны не только пищевода, трахеи, но и блуждающего нерва (или его возвратной ветви), верхней полой вены, шейных симпатических ганглиев. При «доброкачественном узле» меньших размеров у ребенка операция может быть проведена сразу только в редких случаях, например при явно ТТГ-независимом (автономном) характере его роста. Это имеет место либо при токсической аденоме ЩЖ (казуистическая ситуация в педиатрии), либо устанавливается при клинически эутиреоидном состоянии – по данным спонтанно подавленного уровня ТТГ в сыворотке крови (ниже нижней границы нормы) или когда величина последнего определяется на уровне нормально-низких значений (
Тиреоидэктомия щитовидной железы

Хирургическое лечение при злокачественных опухолях щитовидной железы было, остается и, возможно, еще долгое время будет основным и обязательным компонентом терапии этого заболевания. Только при помощи операции можно избавиться от злокачественных клеток, предупредить дальнейшее прогрессирование опухоли и сохранить жизнь человеку.
Показания к операции при раке ЩЖ
Хирургическое удаление опухоли проводят во всех случаях диагностирования рака ЩЖ, независимо от его типа (фолликулярная, медуллярная, анапластическая карцинома). Исключением являются только пациенты, которые находятся в терминальной стадии заболевания и операция, в случае ее проведения, не сможет продлить им жизнь. Но и в таких случаях иногда прибегают к хирургии, которая является паллиативной, то есть призвана облегчить последние месяцы или недели жизни больного человека.
Виды операций при раке щитовидной железы
Существует несколько типов оперативного вмешательства на ЩЖ:
-
(возможна при раке low risk). При этом удаляют одну (больную) долю органа. Оставшаяся доля предупреждает развитие послеоперационного гипотиреоза. Такой вид хирургического лечения возможен при раке ЩЖ, если опухоль имеет маленькие размеры и врач уверен в том, что опухолевые клетки не распространились на вторую долю. Это самый распространенный вариант хирургического лечения рака ЩЖ. В таком случае хирург полностью удаляет всю железу. Развитие гипотиреоза неизбежно, но шансы на полное выздоровление пациента значительно повышаются. . Это полное удаление ЩЖ вместе с региональными лимфатическими узлами и жировой клетчаткой. Такую операцию выполняют при прорастании опухоли за пределы ЩЖ, при наличии метастазов или подозрении на таковые.
Ввиду сложившейся неблагоприятной ситуации по поводу рака ЩЖ (с каждым годом количество этой патологии увеличивается) во всех современных рекомендациях методом выбора хирургического лечения называют тотальную тиреоидэктомию, независимо от типа и стадии опухоли.
Ниже приведен список больниц, в которых проводятся хирургические операции на щитовидной железе в Москве:
- ГКБ им Е.О. Мухина
- Клиника «Виталис»
- ГКБ № 70
- ГКБ № 36
- Боткинская больница
- Университетская клиническая больница №1, Первый МГМУ имени И.М. Сеченова
- Эндокринологический Научный Центр (ЭНЦ)
- Российский Онкологический Научный Центр им. Н.Н. Блохина — Научно-исследовательский институт клинической онкологии (Каширское шоссе 24)
- Лечебно-реабилитационный центр Минздрава России (Иваньковское шоссе)
- ГКБ № 13
Лечение после операции
Во всех современных протоколах лечения рака ЩЖ присутствует такой обязательный пункт лечебной программы, как радиойодтерапия. Введение радиоактивного йода позволяет уничтожить те раковые клетки, которые, возможно, остались после удаления щитовидной железы.
Курс лечения радиойодом назначают через месяц после операции. Оптимальные сроки проведения терапии радиоактивным йодом – 4-6 недель после операции. Наилучшие результаты РЙТ достигаются именно в эти сроки. Такая терапия повышает шансы на выживаемость и полное излечение, снижает риск развития рецидива и метастатических поражений.
Также всем пациентам после удаления органа по поводу рака назначается супрессивная, заместительная гормональная терапия. Тиреогормоны принимают в дозах выше физиологических, чтобы снизить уровень ТТГ в крови и исключить его стимулирующее влияние на тироциты (может стать причиной повторного роста опухоли).
При супрессивной терапии назначается левотироксин в высоких дозах – 2,5-3 мкг на килограмм. В дальнейшем дозировка контролируется концентрацией ТТГ. Необходимо достичь уровня ТТГ в диапазоне 0,1-0,5 мМЕ/л для пациентов высокого риска рецидива опухоли и 0,3-2,0 мМЕ/л для людей из группы низкого риска. Определять ТТГ нужно раз каждые три месяца на первом году после операции и раз в шесть месяцев на протяжении дальнейшей жизни.
Случается, что супрессивная терапия сопровождается выраженными побочными эффектами, например, остеопороз, сердечные аритмии и другие признаки тиреотоксикоза. Если не удается достичь компенсации назначением корректирующей медикаментозной терапии, то пациента переводят на заместительную гормональную терапию.
Рекомендуемая доза заместительной терапии рассчитывается на кг веса человека – 1,6 мкг для взрослых и 2 мкг для детей. Контроль нужной дозы оценивают по состоянию пациента (присутствуют симптомы гипотиреоза или нет), а также по уровню тиреотропного гормона – его количество должно находиться в пределах 0,3-2,0 мМЕ/л.
Также перевести человека с супрессивной на заместительную терапию можно при полном излечении и очень низком риске рецидива опухоли. В остальных случаях супрессивная терапия проводится пожизненно.
Хирургическое лечение рака щитовидной железы является незаменимым и эффективным методом лечения этого тяжелого заболевания. Использование современных малоинвазивных методик делают операцию на ЩЖ безопасной, а опытный хирург выполнит ее без последствий для здоровья. В сочетании с радиойодтерапией хирургическое лечение ЩЖ позволяет полностью излечится от рака ЩЖ.
Алгоритмы диагностики и лечения высокодифференцированого рака щитовидной железы
Хирургия, ТТГ-супресивная терапия, радиойодтерапия, дистанционная лучевая терапия, химиотерапия и редифференцирующая терапия используются в настоящее время на различных этапах лечения. При этом в первую очередь при дифференцированном раке щитовидной железы проводится хирургическое удаление первичной опухоли и регионарных метастазов
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
- В биоптате из узла щитовидной железы или лимфатического узла шеи обнаружены раковые (или подозрительные на таковые) клетки опухоли;
- Сочетание двух и более клинико-эхографических признаков рака щитовидной железы (пальпаторно плотный узел, гипоэхогенный, кальцификаты внутри узла, нечеткие контуры образования) или наличие эхографических признаков экстратиреоидной инвазии;
- Увеличение узла (узлов) щитовидной железы на фоне супрессивного лечения;
- Наличие метастазов с цитологическими признаками рака щитовидной железы.
Стандартной операцией при ДРЩЖ является тотальная или околототальная тиреоидэктомия. Выполнение тотальной тиреоидэктомии на стороне опухоли и околототальной тиреоидэктомии на противоположной стороне позволяет сохранять кровоснабжение паращитовидных желез, что значительно снижает риск тяжелой послеоперационной гипокальциемии. Гемитиреоидэктомия на стороне первичной опухоли может быть адекватной только в случае обнаружения папиллярной микрокарциномы с диаметром опухоли Ј 1см, так как рак щитовидной железы довольно часто бывает многофокусным и с двухсторонним поражением.
- Нерадикальной ранее выполненной операции,
- Рецидива рака щитовидной железы в оставленной тиреоидной ткани,
- Прогрессирования или рецидива регионального метастазирования.
ТТГ-СУПРЕССИВНАЯ ТЕРАПИЯ
Терапия левотироксином (L-Т4) проводится всем больным ДРЩЖ, в дозировках достаточных для супрессии эндогенной продукции ТТГ. Высокий уровень ТТГ является важнейшим фактором роста для ДРЖЩ. Доза L-Т4 определяется из расчета: 3,0 — 3,3 мкг/кг массы тела для детей и подростков, 2,0-2,5 мкг/кг для взрослых. Адекватность супрессивной терапии оценивается по уровню ТТГ через 2 месяца после операции или при изменении дозировки L-Т4. При супрессивной терапии L-Т4 пациент должен находиться в клинически эутиреоидном состоянии, уровень ТТГ не должен превышать нижнюю границу нормы (0,2 МЕ/мл), а уровень свободного триойдтиронина (СТЗ) не должен превышать верхний предел нормы; Т4 может превышать норму. Коррекция гормональной супрессии имеет целью достижение вышеуказанного состояния в течение всего периода лечения.
Несмотря на то, что пока нет проспективных исследований эффективности ТТГ супрессивной терапии, но ретроспективные данные эпохи рутинной аблации йодом-131 показали значительное статистически значимое уменьшение 10 летних рецидивов с 20% у больных без медикаментозной терапии до 12% у больных, которые получали L-Т4 в дополнении к хирургии. Некоторые противоречия существуют относительно оптимального уровня ТТГ супрессии, так как супрессивная дозировка L-Т4 может вызывать такие неблагоприятные эффекты, как увеличения риска предсердной фибрибляции и деминерализации костей. При отсутствии такого риска супрессивная терапия рекомендуется ниже 0,1–0,2 МЕ/мл. Альтернативный, риск-ориентированный подход предлагает ТТГ-супрессию ниже 0,1 МЕ/мл у больных с высоким риском опухолевого роста или рецидива и ТТГ супрессия ниже нормального уровня у больных с низким уровнем
ЛУЧЕВОЕ ЛЕЧЕНИЕ
- Девитализация остаточной тиреоидной ткани и вероятных резидуальных очагов опухоли, при невозможности удалить их оперативным путем;
- Удаление субстрата, синтезирующего тиреоглобулин, определение которого в дальнейшем наблюдении позволяет корректно использовать уровень его содержания в сыворотке крови в качестве опухолевого маркера;
- Обнаружение и последующая терапия метастазов ДРЩЖ, в том числе не выявляемых прочими методами.
- Отсутствие или недостаточное накопления йода-131 опухолевыми клетками (оксифильная или низкодифференцированная опухоль);
- Метастазы малых размеров (микрометастазы), так как энергия b -частиц поглощается вне метастаза больше, чем в опухолевой ткани.
- определение уровня ТТГ (уровень эндогенной стимуляции должен быть > 20-30 МЕ/мл)
- диагностическое сканирование с 131I для определения расположения и функциональной активности оставшейся ткани щитовидной железы (В случае накопления в остатках ткани ЩЖ более 20% 131I через 24 часа необходимо решать вопрос о повторном хирургическом вмешательстве)
- перорального введения водного раствора натрия йодида (Na131I) из расчета 1-2 мКи на килограмм массы тела;
- перевод в «активные» палаты («закрытый режим») с ежедневной дозиметрией;
- начало супрессивной гормонотерапии через 48-72 ч;
- выведения из «активных палат» и дезактивация — при снижении мощности дозы гамма-излучения на расстоянии 1м от пациента до 3 мкЗв/ч (по нормам радиационной безопасности (НРБ-99))
- проведение компьютерной сцинтиграфии всего тела;
Повторное введение 131 I с интервалом 3 – 6 месяцев проводится при выявлении очагов гиперфиксации РФП до их полного исчезновения, отсутствия ультразвуковых и/или рентгенологических признаков рецидива опухоли и метастазов РЩЖ и снижении уровня ТГ в сыворотки крови < 2-5 нг/мл
.
В последние годы широко используется для диагностических исследований с йодом-131 рекомбинантный ТТГ(рТТГ). Он позволяет проводить это исследование, не прекращая прием L-Т4, избегать больному длительной подготовки и пребывания в состоянии гипотиреоза. Использование рТТГ также может быть полезно и при радиойодтерапии у отдельных больных.
ДИСТАНЦИОННАЯ ЛУЧЕВАЯ ТЕРАПИЯ (ДЛТ)
Определенные показания для дистанционной лучевой терапии существуют при недифференцированном/анапластическом раке щитовидной железы, местном и регионарном рецидиве и/или метастазах ДРЩЖ которые невозможно удалить хирургически и опухолевая ткань или остаток опухоли после хирургического удаления не накапливает достаточно радиойода.
Сегодняшние немецкие междисциплинарные руководства рекомендуют ДЛТ проводить после нерадикальной резекции с микро -или макроскопическими опухолевыми остатками, если невозможно повторная операция и/или удаление с помощью радиойодтерапии.
Американские руководства просто указывают, что ДЛТ «может быть полезна» у больных с низкодифференцированной опухолью, которая не накапливает радиойод, и «может рассматриваться» у больных, которые имеют очевидные признаки местной инвазии, или подозревается наличие микроскопических остатков опухоли после первичного хирургического лечения.
РЕДИФФЕРЕНЦИРУЮЩАЯ ТЕРАПИЯ
Дедифференцировка является общей закономерностью для всех случаев прогрессирования ДРЩЖ, которая приводит к потере способности опухолевых клеток накапливать 131-йод, уменьшению или утрате экспрессии ТТГ рецепторов, что делает нечувствительной эту опухоль к лечению радиойодом и ТТГ-супрессивной терапии. Эксперименты с культурой клеток опухоли и предварительные клинические исследования показали, что ретиноловая кислота может индуцировать частичную редифференцировку опухолевых клеток с восстановлением способности накапливать йод.
ХИМИОТЕРАПИЯ
Химиотерапия не используется в лечении медленно растущего, хорошо отвечающего на радиойодтерапию ДРЩЖ, кроме случаев опухолевой дедиференцировки с последующим быстром ростом.
Что такое супрессивная терапия
Представлена обзорная статья, посвящённая современной фармакотерапии герпеса с использованием различных лекарственных форм, в том числе форм и комбинированного состава. Приведены сведения об уровне инфицированности данным заболеванием и его особой социальной роли в жизни человека. Проведён анализ литературных данных в области практических исследований терапии герпеса, подходах и схемах лечения. Представлены общие сведения о вирусе простого герпеса, степени его распространённости, обобщённых принципах лечения и лекарственных препаратов, для данного заболевания. Полученные материалы свидетельствуют о важной проблеме герпеса и значительной роли ацикловира в его терапии. Изучен ассортимент лекарственных форм ацикловира и представлена актуальность в разработке лекарственной формы комбинированного состава, направленной на повышение эффективности терапии герпеса.

1. Арестова И.М., Киселева Н.И. Современные возможности сочетанной химиотерапии и иммунокоррекции урогенитального герпеса в гинекологии и акушерстве // Медицинские новости. – 2013. – №. 9. – С. 21-27.
2. Волкова Л.И. Постгерпетическая невралгия: клиника, лечение, профилактика [Электронный ресурс] // Международный неврологический журнал. – 2007. – №3(13). – URL: http://www.mif-ua.com/archive/article/144 (дата обращения: 20.05.2014).
3. Горячкина М.В., Белоусова Т.А. Герпес-вирусная инфекция в дерматокосметологической практике // Русский медицинский журнал. – 2013. – Т. 21, №8. – С. 397-400.
4. Государственный реестр лекарственных средств [Электронный ресурс]. – URL: http://grls.rosminzdrav.ru/grls.aspx?s= %u0430 %u0446 %u0438 %u043a %u043b %u043e %u0432 %u0438 %u0440 (дата обращения: 28.05.14).
5. Жилякова Е.Т., Баскакова А.В., Новикова М.Ю. Разработка технологической методики повышения растворимости ацикловира // Фундаментальные исследования. – 2013. – №6 (часть 3). – С. 646-650.
6. Изучение ассортимента противовирусных глазных лекарственных форм / Е.Т. Жилякова, М.Ю. Новикова, О.О. Новиков и др. //Фундаментальные исследования. – 2012. – №1. – С. 179-183.
7. Исаков В.А. Герпес-вирусная инфекция. Рекомендации для врачей / В.А. Исаков, С.Б. Рыбалкин, М.Г. Романцов. – СПб., 2006. – 96 с.
8. Коровина А.Н., Кочетков С.Н., Куханова М.К. Поиск ингибиторов репликации вируса герпеса: 30 лет после ацикловира // Biotechnologia Acta. – 2013. – Т. 6, №4. – С. 78-85.
9. Лукьянов А.М., Полевечко Г.Н. Влияние системной терапии ациклическими нуклеозидами на иммунологические показатели и качество жизни пациентов с рецидивирующим генитальным герпесом // Русский медицинский журнал. – 2011. – Т.19, №1. – С. 10-17.
10. Марченко Л.А., Шуршалина А.В. Обоснование принципов современной терапии генитального герпеса // Consilium Medicum. Гинекология. – 2000. – Т.2, №3. – С. 296-302.
11. Панкратов О.В. Иммуномодуляторы в лечении герпетической инфекции // Охрана материнства и детства: Рецензируемый науч.-практич. мед. журнал. – 2011. – №1 (17). – С. 80-89.
12. Пашинян А.Г. Наружная терапия простого герпеса // Клиническая дерматология и венерология. – 2010. – №2. – С. 104-106.
14. Рублева О.В. К вопросу о терапии и профилактике вирусных инфекций // Русский медицинский журнал. – 2012. – Т.20, №11. – С. 571-574.
15. Самгин М.А. Простой герпес. Дерматологические аспекты / М.А. Самгин, А.А. Халдин. – М.: МЕДпресс-информ, 2002. – 160 с.
16. Сергеева И.Г., Макарова Н.Г. Современная топическая терапия пациентов с рецидивами простого герпеса // Вестник Новосибирского государственного университета. Серия: Биология, клиническая медицина. – 2014. – Т.12, №1. – С. 94-101.
17. Справочник лекарств РЛС [Электронный ресурс]. – URL: http://www.rlsnet.ru/tn_index_id_28476.htm (дата обращения: 28.05.14).
18. Cправочник лекарственных препаратов Vidal.ru [Электронный ресурс]. – URL: http://www.vidal.by/poisk_preparatov/actovir__36216.htm (дата обращения: 28.05.14).
19. Степанов М.И., Архипов Г.С. Особенности использования витаминов и эссенциальных микроэлементов для лечения и профилактики рецидивов простого герпеса // Фундаментальные исследования. – 2012. – №7 (часть 2). – С. 456-462.
20. Халдин А.А., Самгин М.А., Баскакова Д.В., Васильев А.Н. Местная терапия простого герпеса: PRO и CONTRA // Российский журнал кожных и венерических болезней. Приложение «Герпес». – 2007. – Т.2. – С. 4-10.
21. Чигвинцева Е.А., Герасимова Н.М. Современные проблемы эпидемиологии, диагностики и лечения герпес-вирусных заболеваний // Современные проблемы дерматовенерологии, иммунологии и врачебной косметологии. – 2009. – Т.3, №3. – С. 89-94.
22. Шаблакова А.С., Петров А.Ю. Маркетинговая оценка позиционирования противовирусных средств // Фундаментальные исследования. – 2012. – №8 (часть 1). – С. 204-206.
23. Шибаева Е.В. Опыт применения геля «Алломедин» в купировании рецидивов простого герпеса // Медицинский альманах. – 2011. – №6. – С. 109-114.
24. Шилова Н.П., Байкова И.А., Курс О.В. Особенности личности пациентов с рецидивирующим простым герпесом // Медико-биологические проблемы жизнедеятельности. – 2011. – №2 (6). – С. 108-113.
25. Шульженко А.Е., Зуйкова И.Н. Современные подходы к диагностике и лечению герпесвирусных инфекций // Лечащий врач. – 2007. – №5. – С. 52-55.
26. Gupta R. Genital herpes / R. Gupta, T. Warren, A. Wald // Lancet. – 2007. – Vol. 370. – № 9605. – P. 2127–2137.
В своей практической деятельности врачи многих специальностей встречаются с заболеваниями, вызванными вирусами семейства Herpesviridae, которые широко распространены в человеческой популяции. Они способны поражать практически все органы и системы организма хозяина, вызывая латентную, острую и хроническую формы инфекции при этом, спектр клинических проявлений, развитие которых они обусловливают, чрезвычайно широк [7]. Особого внимания заслуживает рецидивирующая форма герпетической инфекции (ГИ), относящаяся к числу наиболее распространенных психосоматических кожных заболеваний. Хроническое течение, зуд, частая локализация и характер высыпаний на лице или интимно значимых участках кожного покрова сопровождаются изменениями эмоциональной сферы. В свою очередь, состояния стресса, восприятие самим пациентом проявлений болезни оказывает влияние на интенсивность и частоту рецидивов простого герпеса (ПГ) [24].
Многочисленные исследования в области проблемы ГИ, особенно вызванные вирусами простого герпеса (ВПГ) 1 и 2 типов, не теряют своей актуальности в настоящее время [21, 16].
Серьёзной проблемой является высокая инфицированность здорового населения, преимущественно молодого, трудоспособного возраста. В мире ежегодно заражаются от 16 до 800, а в России – от 40 до 80 человек на 100 тыс. населения. В настоящее время заболеваемость ПГ крайне высока, по статистике ВОЗ, она занимает второе место среди вирусных поражений, уступая лишь гриппу. ВПГ-1 инфицировано около 90 % взрослого населения планеты, распространенность ВПГ-2 колеблется от 7 до 40 %. В США ежегодно регистрируется до 98 млн случаев лабиального герпеса и 20 млн случаев рецидивирующего герпеса гениталий, 500 тыс. случаев офтальмогерпеса и более 5 тыс. случаев герпетического энцефалита, около 1 тыс. случаев герпеса новорожденных. По мнению ведущих специалистов, в нашей стране ежегодная заболеваемость герпесом губ составляет 10 млн, герпесом кожи – 1 млн, офтальмогерпесом – 250 тыс. случаев. Рецидивирующими формами герпеса страдают от 10 до 20 % населения, а ежегодный прирост увеличивается на 15–17 % [3, 13, 23].
Литературные данные свидетельствуют, что большинство населения Земли инфицировано ВПГ-1, ВПГ-2 или тем и другим вирусом одновременно. Первичная инфекция, ассоциированная с ВПГ-1 или ВПГ-2, может протекать в клинически выраженной форме в очаге инфицирования (например, в орофациальной или генитальной области) либо как бессимптомная или нераспознанная инфекция. Генитальная форма простого герпеса может быть связана с ВПГ-1, так же как и лабиальная форма – с ВПГ-2. После первичного инфицирования у 50–75 % больных отмечается рецидивирующее течение простого герпеса. В течение первых 12 месяцев после инфицирования ВПГ-2 рецидив возникает у 80 % пациентов, ВПГ-1 – у 55 % [15, 26].
Современная медицина не располагает методами лечения, позволяющими элиминировать ВПГ из организма человека. Целью лечения герпеса является: 1) подавление репродукции ВПГ в период обострения (купирование рецидива); 2) снижение частоты и длительности рецидивов заболевания, тяжести их течения; 3) формирование адекватного иммунного ответа и его длительное сохранение с целью блокирования реактивации ВПГ в очагах персистенции.
Всё разнообразие методов терапии и профилактики обострения герпесвирусных инфекций можно сгруппировать в направления этиотропного, патогенетического и симптоматического лечения с применением химиотерапии, иммунотерапии и комплексного лечения [1, 7, 11].
Большое внимание уделяется антигерпетическим соединениям растительного происхождения, природным антиоксидантам, адаптогенам из лекарственного растительного сырья и витаминно-минеральным комплексам, ввиду изменения иммунного статуса пациентов [14, 19].
Патогенетическая терапия направлена на нормализацию функции иммунной системы организма, в том числе на активацию системы интерфероновой защиты, как правило, связанная с применением интерферонов (ИФН), индукторов ИФН и иммуномодуляторов. Специфическая иммунотерапия состоит в применении герпетической вакцины, хотя ряд исследователей считает, что надежды, возлагаемые на специфическую вакцинопрофилактику, не оправдали себя [11, 19]. Иммунотропные препараты, обладающие активностью против вируса герпеса, разнообразны и представлены в таблице.
Иммунотропные препараты, обладающие активностью против вируса герпеса
Использование противовирусной химиотерапии велико при лечении рецидивирующих форм простого герпеса с поражением кожи и слизистых оболочек. В лечении простого герпеса с применением противогерпетических химиопрепаратов можно выделить два принципиально отличающихся друг от друга подхода: 1) эпизодическое лечение – прием ациклических нуклеозидов (АН) в момент рецидива в терапевтических дозах при соблюдении кратности и длительности лечения; 2) супрессивная терапия – длительный, иногда многолетний, постоянный прием препаратов АН вне рецидива в более низких дозах [9, 25].
Группа препаратов АН представлена синтетическими аналогами естественных нуклеозидов. Исторически первым таким препаратом был ацикловир (синтетический ациклический аналог нуклеозида гуанозина), созданный британской фирмой «Glaxo Wellcom Foundation Ltd», ставший «золотым стандартом» терапии герпеса, механизм действия которого основан на высокой специфичности к вирусной тимидинкиназе. В настоящее время ацикловир – наиболее часто назначаемый противогерпетический препарат. Успешно прошли лечение ацикловиром и его аналогами местно, орально и парентерально, короткими и многолетними курсами более 50 млн человек. Была отмечена безопасность, высокая эффективность, хорошая переносимость препаратов и отсутствие значимых побочных эффектов, уровень доказательности – А [10].
Согласно проведенным исследованиям, биодоступность (per os) противогерпетических препаратов из группы ациклических нуклеозидов возрастает следующим образом: ацикловир – 20 %, валацикловир – 54 % и фамцикловир – 77 % [24]. Тем не менее применение ацикловира по-прежнему остаётся востребованным среди врачей и пациентов в настоящее время, и одновременно ведутся исследования по увеличению растворимости ацикловира [5] и синтезу его производных [8].
В настоящее время лекарственные препараты ацикловира представлены как моно, так и комбинированного состава, с целью предотвращения резистентности вирусов к ацикловиру и для комплексного воздействия терапии. В частности, созданы крем «Актовир», «Зовиракс дуо-актив», «Герпферон» [17, 18].
В разные годы предпринимались многочисленные попытки повысить эффективность лечения ПГ путем комбинированной терапии. С этой целью использовались различные сочетания средств иммунного влияния, а также препаратов, отличающихся по этиопатогенетическому механизму действия [20].
Возможно сочетанное использование противовирусной терапии и глюкокортикостероидов. Выявлено, что такая комбинация эффективнее монотерапии противовирусными препаратами, особенно для лечения острой боли и коррекции различных аспектов качества жизни пациентов. Комбинация ацикловир + преднизолон значительно быстрее купирует острую боль и возвращает пациента к обычной жизнедеятельности в случае постгерпетической невралгии [2].
Наружные средства дополняют системную противовирусную терапию. Многочисленные наблюдения подтверждают, что в случае назначения таблетированных форм ациклических нуклеозидов на стадии предвестников в сочетании с наружной противовирусной терапией значительно чаще удается полностью прервать дальнейшее развитие рецидива или наблюдать его абортивное течение [20].
Местная терапия противовирусных лекарственных средств при герпесе кожи и слизистых оболочек требуется для уменьшения отёка, экссудации, боли и зуда, ускорения заживления язвочек и эрозий и сокращения длительности выделения вируса на участках поражения [22]. Применение данных лекарственных форм начинают при появлении первых признаков активации инфекции (чувство жжения, зуд и т.д.) и продолжают вплоть до эпителизации эрозий. Рано начатое местное лечение может предотвратить развитие везикул.
В комплексную терапию пациентов с простым герпесом необходимо включать местные противовирусные средства, способствующие стабилизации и разрешению процесса [12].
При анализе ассортимента противовирусных средств на российском рынке установлено, что большинство противовирусных препаратов выпускается в виде твёрдых лекарственных форм – 66 %, в виде мягких лекарственных форм – 22 %, а в форме жидких – 12 % [22], лидером же является ацикловир [6].
Ассортимент лекарственных форм, содержащих в своём составе ацикловир, разнообразен (представлен на рисунке). Производители субстанции в основном представлены китайскими компаниями, тем не менее присутствуют и отечественные фирмы-производители, такие как ЗАО «АЗТ Производственно-коммерческая ассоциация» и ООО «Технология лекарств») [4].

Ассортимент лекарственных форм, содержащих ацикловир
Следует отметить, что современная фармакотерапия герпеса эффективно уменьшает его клинические проявления, положительно влияет на психическое состояние пациентов и приобретает комплексный подход. Несмотря на различные достижения в лечении герпеса, ацикловир по-прежнему играет значительную роль в данном направлении и привлекает внимание исследователей по созданию комбинированных препаратов. В связи с чем актуальными являются исследования по разработке лекарственной формы комбинированного состава, обладающей противогерпесным эффектом – медицинские карандаши.
Рецензенты:
Степанова Э.Ф., д.фарм.н., профессор, профессор кафедры технологии лекарств ПМФИ – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск;
Хаджиева З.Д., д.фарм.н., профессор, профессор кафедры технологии лекарств ПМФИ – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск.
Вагинальный кандидоз — дифференцированный подход к терапии
Вагинальный кандидоз (ВК) — распространенное заболевание, которое развивается у 70—75% женщин по крайней мере однажды в течение репродуктивного периода (по данным исследований под руководством Жерома Собеля, опубликованных в 1998 г, США). У 40—50% пациенток наблюдаются повторные случаи заболевания, а примерно 5% страдают от рецидивирующей инфекции (данные исследования 2004 г. на базе Колледжа медицины им.Альберта Энштейна, Бронкс, США).
Этиология ВК
Candida spp., возбудители вагинального кандидоза, — это условно-патогенные грибы, которые являются наиболее распространенной причиной грибковых инфекций у человека. Род Candida насчитывает около двадцати видов. Как правило, ВК ассоциируется с каким‑то одним видом Candida, но существует вероятность (2—5%) одновременного инфицирования двумя и более видами.
В России, США, Австралии и Европе у женщин с ВК чаще всего выявляется Candida albicans (76—89%). За ним следует C. glabrata (7—16%). Процент не-albicans Candida колеблется от 11 до 24%. Некоторые исследования показали тенденцию к увеличению частоты не-albicans кандидозов, однако недавняя работа ученых из США с участием девяноста тысяч образцов опровергла это утверждение: соотношение видов Candida, вызывающих ВК, с 2003 по 2007 год практически не изменялось.
Этиологически различные кандидозы клинически весьма схожи, однако нетипичные возбудители характеризуются устойчивостью к азоловым антимикотикам. Более других к азоловыми противогрибковым препаратам резистентны C. glabrata и C. krusei.
провизор первой категории и заведующая аптекой. Автор многочисленных работ по фармакологии и фармакотерапии, город Днепропетровск.
Эти данные подчеркивают важность определения вида Candida spp. у женщин с высоким риском развития не-Сandida аlbicans-ассоциированного ВК с целью подбора эффективной терапии заболевания.
Факторы риска
У многих здоровых женщин ВК развивается спорадически. Тем не менее существуют факторы риска возникновения кандидоза. Среди поведенческих факторов это частые половые контакты и оральный секс, а также использование спермицидов.
Тесная одежда и нижнее белье обычно не провоцируют заболевания. Однако среди женщин с рецидивирующим ВК (РВК) ношение тесных колготок и ежедневных прокладок положительно ассоциировано с рецидивом.
К биологическим факторам риска ВК относятся:
- применение антибиотиков;
- неконтролируемый сахарный диабет;
- генетическая предрасположенность;
- высокий уровень половых гормонов;
- прием оральных контрацептивов, содержащих высокие дозы эстрогена;
- беременность.
Антибактериальные препараты способствуют снижению количества лакто- и бифидобактерий, сдвигу pH во влагалище и росту Candida spp.
Тетрациклины, цефалоспорины и ампициллин чаще других антибиотиков широкого спектра действия провоцируют развитие кандидоза.
Беременность — один из наиболее распространенных предрасполагающих факторов. Согласно исследованиям, у трети беременных развивается ВК. Высокий уровень половых гормонов способствует увеличению содержания гликогена во влагалище, который в свою очередь обеспечивает постоянный источник углерода, необходимый для роста грибов.
Кроме того, повышенная кислотность вагинальной флоры беременных может подавлять рост других микроорганизмов, которые естественным образом ингибируют Candida. Хотя начальное прикрепление клеток гриба происходит при более высоких значениях pH (6–7), кислая среда благоприятствует развитию мицелия.
В патогенезе вагинального кандидоза (ВК) выделяют две основные фазы: фазу адгезии, то есть прикрепления клеток гриба к эпителиальным клеткам, и мицелиальную фазу. Мицелиальная фаза начинается с момента проникновения Candida spp. в эпителиоциты. Растущий псевдомицелий грибов проникает в глубокие слои цервикального и вагинального эпителия.
Cаndida способны пенетрировать клетки, не нарушая целостности своей маннопротеиновой оболочки (это фибриллярное покрытие клеточной стенки гриба, участвующего в адгезионных процессах). В итоге Cаndida противостоит факторам защиты и выживает в макроорганизме.
Группы риска инфицирования не-albicans видами Candida включают:
- женщин с рецидивирующим ВК;
- ВИЧ-инфицированных женщин;
- женщин в возрасте старше 50 лет;
- женщин с неконтролируемым сахарным диабетом.
Во всех вышеперечисленных группах наиболее распространенным видом является С. glabrata.
Процент случаев заболевания не-albicans Сandida-ассоциированной инфекцией увеличивается с возрастом женщин.
Большинство женщин с ВК быстро реагируют на терапию, однако в некоторых случаях может развиться рецидивирующая форма, которая характеризуется четырьмя и более эпизодами инфекции в год. Предрасполагающие факторы:
- неконтролируемый сахарный диабет;
- прием иммунодепрессантов;
- отклонения в местном вагинальном иммунитете слизистых оболочек;
- генетическая предрасположенность.
Исследования доказали, что у пациенток с РВК регистрируется более высокая частота специфических генных полиморфизмов по сравнению с контрольной группой. Кроме того, у этих пациенток обнаруживаются определенные антигены системы Льюис в крови.
Периодический ВК может быть также связан со снижением в естественных условиях концентрации манноз-связывающего лектина. Последний, связываясь с сахарами на поверхности клетки Candida, запускает путь активации системы комплемента и приводит к гибели гриба с помощью комплемент-опосредованного фагоцитоза.
При данном заболевании также фиксируется повышенная концентрация интерлейкина-4, что тормозит местные защитные механизмы.
Система антигенов Льюис зависит от группы генов, которые экспрессируются в железистом эпителии. Антигены Льюис, в отличие от эритроцитарных антигенов, являются компонентами экзокринных эпителиальных выделений, в том числе и влагалищных.
Роль полового пути передачи остается недоказанной. Тем не менее большинство исследований говорит о необходимости лечения половых партнеров. Так, эксперимент доктора Горовитц, Великобритания, продемонстрировал наличие видов Candida в эякуляте мужчин, партнерши которых страдали РВК.
Однако тот же Горовитц провел еще одно исследование, где изучались результаты терапии у 54 женщин, разделенных на две группы. Партнеров из первой группы подвергали противогрибковой терапии, а из второй — нет. Существенных различий в скорости наступления рецидива у женщин этих групп обнаружено не было.
Рецидивы могут быть вызваны и другими видами Candida, которые не являются в равной степени чувствительными к терапии препаратами первой линии.
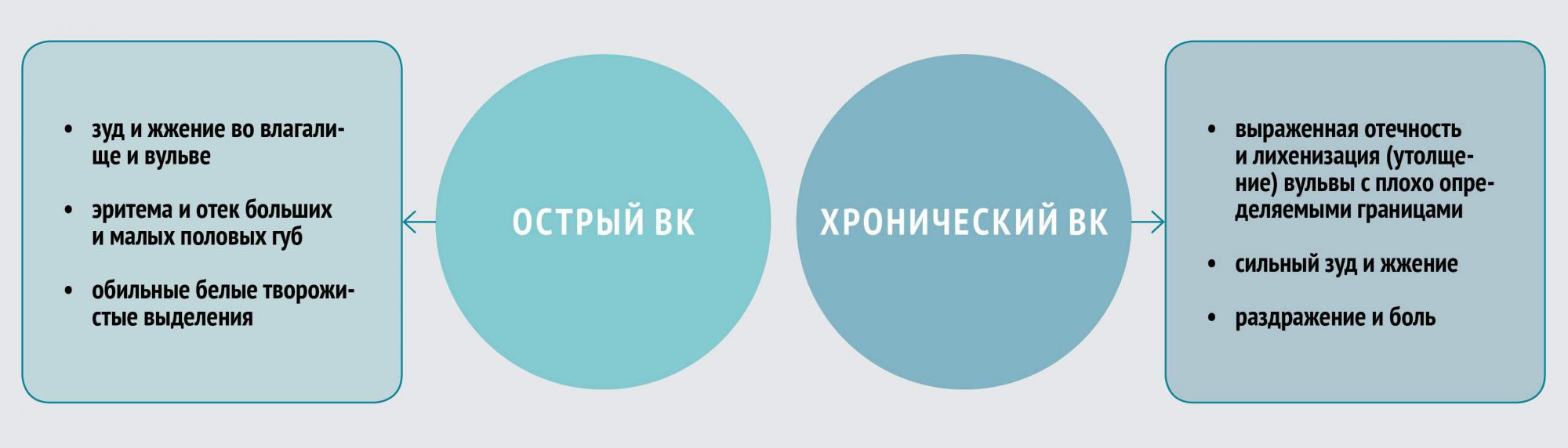
Клиника ВК
Клинические симптомы ВК неспецифичны и могут быть связаны с другими вагинальными заболеваниями, в том числе бактериальным вагинозом, трихомониазом, хламидиозом, гонореей. Отличительной чертой симптоматики являются зуд и жжение. В некоторых случаях возможно развитие диспареунии (болезненности при половом акте) и дизурии.
Исследования in vivo показали, что противогрибковые препараты имидазола (миконазол и клотримазол) менее эффективны в лечении не-albicans видов Candida. Так, C. tropicalis и C. glabrata в 10 раз менее чувствительны к миконазолу, чем C. albicans.
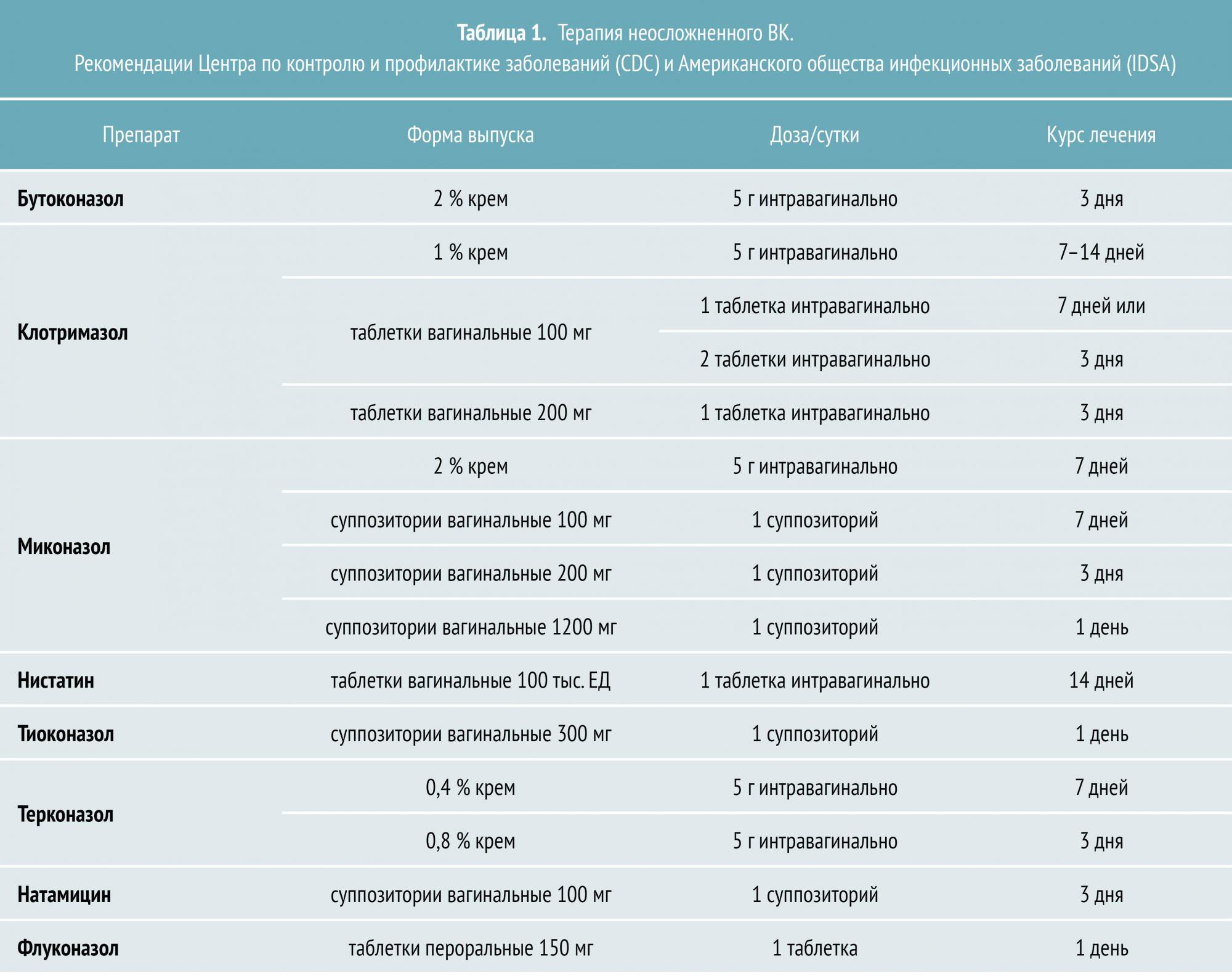
Лечение неосложненного ВК
Неосложненный ВК вызывается штаммами C. albicans, большинство из которых демонстрируют чувствительность к азоловым противогрибковым препаратам. Лечение неосложненного заболевания приводит к положительному результату в 90% случаев даже при назначении однократной дозы пероральных или короткого курса местных антимикотиков. На выбор можно использовать несколько топических азоловых препаратов с приблизительно одинаковой эффективностью.
Эмпирическое назначение антимикотиков при этой форме заболевания совершенно оправданно. Более того, зачастую выбор лечения основывается на индивидуальных предпочтениях пациентки.
Клеточная стенка Candida представляет собой комплексный гликопротеин, который зависит от постоянного синтеза эргостерола. Соединения азола, которые являются действующими веществами азоловых противогрибковых препаратов, блокируют выработку эргостерола, позволяя топическим антимикотикам оказывать эффект в 80—90% случаев.
Азоловые препараты, которые подразделяются на производные имидазола и триазола, являются самой многочисленной и эффективной группой противогрибковых средств. К азоловым антимикотикам относятся как системные препараты (кетоконазол, клотримазол, изоконазол, эконазол и другие).
В сравнительных испытаниях 10—14‑дневных курсов терапии азолами и нистатином была выявлена преимущественная эффективность первых (80—95 % микологического излечения по сравнению с 70—80 % в группе нистатина). Кроме того, азолы доказали эффективность даже при лечении короткими курсами.
Терапия ВК у беременных женщин предусматривает применение местных противогрибковых препаратов. К числу безопасных топических антимикотиков относятся миконазол и клотримазол, рекомендуемый курс лечения — семь дней. Кроме того, при беременности назначают полиеновый антибиотик натамицин. Стандартная схема противогрибковой терапии местными формами натамицина рассчитана на применение в течение трех дней. При необходимости курс может быть увеличен вдвое.
Лечение осложненного РВК
Оптимальный курс лечения осложненного ВК до сих пор точно не определен. Некоторые исследования показали эффективность противогрибковой супрессивной терапии в течение нескольких месяцев.
Препаратом выбора при РВК является пероральный флуконазол. При тяжелом рецидивирующем ВК флуконазол применяют по схеме 150 мг (три дозы) каждые 72 часа в течение девяти дней, после чего лечение продолжают по 150 мг в неделю на протяжении длительного времени. Такой режим противогрибковой терапии значительно снижает вероятность рецидивов по сравнению с тремя дозами флуконазола без поддерживающего лечения.
Долгосрочная супрессивная терапия пероральным флуконазолом отличается удобством и хорошей переносимостью по сравнению с другими антимикотиками. Как показали исследования, эффективность супрессивной схемы лечения РВК достигает 90%. Вопреки ожиданиям, у больных, длительно принимающих флуконазол, не подтвердилось развитие резистентности к C.albicans или суперинфекции не-albicans видами. Тем не менее пациенткам с упорной инфекцией рекомендуется проводить идентификацию возбудителя.
В качестве препаратов для супрессивной терапии могут применяться иные пероральные средства, которые доказали эффективность в лечении РВК. В качестве альтернативных схем лечения назначают:
- кетоконазол по 100 мг в сутки (из‑за гепатотоксичности перорального кетоконазола предпочтение обычно отдают другим препаратам);
- итраконазол по 200 мг два раза в день в течение одного дня каждого месяца;
- клотримазол вагинальные свечи.

Женщинам, предпочитающим местное лечение, клотримазол рекомендуется в дозировке 500 мг в неделю или 200 мг дважды в неделю. Также допустимо применение других местных противогрибковых препаратов, при этом практически не имеет значения, какое действующее вещество используется.
У пациенток с РВК, которым не проводится поддерживающая терапия, вероятность рецидива в течение шести месяцев после успешного лечения очередного эпизода заболевания составляет 70%. Риск рецидива у женщин, принимающих антимикотики в качестве супрессивного лечения, составляет 40—50% в течение одного года после прекращения приема препаратов.
Лечение РВК, вызванного не-albicans видами Candida
Не-albicans виды весьма умеренно отвечают на терапию азоловыми антимикотиками. Поэтому схему лечения в таких случаях подбирают индивидуально, основываясь на степени тяжести заболевания и реакции на препараты.
В течение многих десятилетий для лечения РВК местно использовалась борная кислота. Однако препараты борной кислоты могут всасываться через слизистую оболочку влагалища в кровь и оказывать токсическое действие. Во избежание всасывания вагинальные средства на основе борной кислоты выпускают в желатиновых капсулах. Рекомендуемая схема лечения — одна капсула 600 мг в сутки в течение двух недель.
Готовой лекарственной формы в России нет, но капсулы могут готовить в аптеках ex tempore. Согласно исследованиям, лечение вагинальными капсулами с борной кислотой эффективно в 70% случаев РВК, ассоциированного с C. glabrata.
Альтернативой токсичной борной кислоте являются суппозитории с амфотерицином В. Антибиотик проникает через клеточную мембрану гриба и, связываясь с эргостеролом, разрушает клеточную стенку. Курс лечения составляет 50 мг на ночь per os в течение двух недель. Такая схема терапии успешна у 70% пациенток, страдающих заболеванием, вызванным не-albicans видами, не поддающимися азоловой терапии, особенно C. glabrata.
Активность по отношению к не-albicans видам Candida доказали и местные препараты для вагинального применения, содержащие 17% флуцитозина. Клетки гриба поглощают флуцитозин, после чего он дезаминируется и превращается в 5‑фторурацил, который встраивается в ДНК Candida вместо урацила. В результате нарушается синтез белка и клетка погибает. Возможна также комбинация 17% крема флуцитозина и 3% крема амфотерицина В. Средняя продолжительность лечения флуцитозином должна быть не меньше двух недель. Особенность препарата — его высокая стоимость.
Альтернативные методы лечения РВК
В некоторых случаях пациентки прибегают к применению пробиотиков, большинство из которых содержат лактобактерии. Предполагается, что лактобактерии способны ингибировать или уменьшать рост Candida во влагалище. Однако единого мнения специалистов по этому поводу пока нет. Действительно, часть клинических исследований подтверждает эффективность пробиотиков при ВК. В то же время другие эксперименты полностью опровергают эти данные.
Так, недавно было опубликовано рандомизированное исследование с участием двух групп женщин с РВК. Пациенткам первой группы в схему лечения включали вагинальные пробиотики, а участницы второй подвергались монотерапии итраконазолом. Исследование показало, что исход терапии в течение месяца был одинаково положительным в двух группах.
Учитывая безопасность применения пробиотиков, право включения этих препаратов в схему лечения РВК имеет и врач, и пациентка.
Лекарства для щитовидки: обзор от фармаколога

25 мая отмечается Всемирный день щитовидной железы. Сегодня целесообразно поговорить о тех препаратах, которые применяют при дефиците выработки этим органом своих гормонов. По данным медицинской статистики, каждая пятая женщина старше 50 лет имеет признаки гипотиреоза. Что это за лекарства, каковы правила их приема и самые распространенные побочные действия? Подробности в новой статье на портале MedAboutMe.
Лекарства — препараты гормонов щитовидной железы
- Левотироксин (L-тироксин, Эутирокс, Л-тирок, Баготирокс и др.)
Левотироксин натрия представляет собой левовращающую форму гормона тироксина. После попадания в организм человека он вначале связывается с белками плазмы крови и тканевыми рецепторами. По этой причине клинический эффект начинается не ранее чем через 12 часов. Однако для того, чтобы препарат начал работать в полной мере, необходим период насыщения. Он составляет около 10-15 суток. То есть, только тогда можно ожидать первых признаков улучшения.
После отмены препарата он продолжает действовать примерно в течение 7-10 дней. По этим причинам лечение левотироксином предполагается длительное: пропуски приема, преждевременная отмена и самостоятельное возобновление крайне нежелательны, так как не дают возможности достичь оптимального для жизнедеятельности уровня этого гормона в крови.
- Лиотиронин (Трийодтиронин, Лиотиронин и др.)
Лиотиронин представляет собой натриевую соль трийодтиронина. Он начинает действовать гораздо быстрее, так как не так прочно связывается с белками крови. Уже через 6-8 часов уровень гормона щитовидной железы в крови при этом повышается. Однако у этого препарата есть и минусы.
Несмотря на то, что он в 5 раз более эффективен, чем левотироксин, и уже через 24 часа дает максимальный эффект, он не отличается стабильностью. На фоне регулярного приема в течение недели действие постепенно снижается, препарат довольно быстро выводится из организма почками. По этой причине основное назначение лиотиронина — лечение такого неотложного состояния, как гипотиреоидная кома. Для этого его применяют внутривенно струйно. После выведения больного из тяжелого состояния ему подбирают поддерживающую дозу левотироксина, на которой впоследствии он будет выписан домой.
- Комбинированные средства
Помимо монолекарств, выпускают еще и комбинированные препараты, в состав которых входят лиотиронин, левотироксин и йодид калия.
Тиреокомб в своем составе содержит 10, 70 и 150 мкг этих соединений соответственно. Его применяют при тяжелом гипотиреозе и тиреоидите. Начинают терапию с 1 таблетки в сутки под контролем уровня ТТГ и Т4 в крови. Далее дозировку постепенно повышают, иногда приходится назначать больным по 2 таблетки 3 раза в сутки.
Тиреотом — это комбинированный препарат, в состав которого входит 40 мг лиотиронина и 120 мкг левотироксина. Он очень эффективен и применяется при выраженном гипотиреозе под строгим лабораторным контролем.
Основные показания для применения этих препаратов
Определены пять основных показаний, по которым можно применять данные лекарства. К ним относятся:
- заместительная терапия гипотиреоза и аутоиммунного тиреоидита,
- супрессивная терапия, которая направлена на подавление активности щитовидной железы у больных, оперированных по поводу высокодифференцированного рака этого органа,
- лечение гипотиреодной комы в качестве одного из многочисленных компонентов терапии,
- лечение болезни Грейвса, которое протекает по схеме «блокируй-замещай»,
- лечение больных после резекции части или тотальной тиреоидэктомии (удаления щитовидной железы).
Препараты эти не из тех, что назначают по классической привычной многим схеме — по 1 таблетке 2-3 раза в день. В большинстве случаев лекарство пьется однократно в сутки, что очень удобно для больных. Однако точная доза определяется путем подбора под контролем уровня ТТГ и Т4. Врачи-эндокринологи советуют сдавать эти анализы как минимум раз в 3 месяца и, если результат укладывается в норму, значит дозировка лекарства верна и беспокоиться не о чем. Если же он выходит за пределы референтных значений — это повод для очередного визита к доктору и корректировки дозы.
Некоторые особенности применения препаратов гормонов щитовидной железы

- Стартовый выбор дозы является эмпирическим, то есть ориентировочным, доктор назначает его после первичного обследования больного. При манифестном гипотиреозе усредненная доза составляет 1,6-1,8 мкг на 1 кг массы тела больного, а при субклиническом — 1 мкг на 1 кг. При контроле уровня ТТГ результат 0,5-3,5 мЕД/л говорит о том, что доза подобрана верно и коррекции ее не требуется.
- Для супрессивной терапии у тех людей, что перенесли лечение по поводу рака щитовидки, доза назначается еще выше. Она составляет 2,2-2,8 мкг на 1 кг массы тела больного, в результате чего уровень ТТГ должен составлять 0,1-0,5 мЕД/л.
- Препараты гормонов щитовидной железы вступают во взаимодействие с различными пищевыми продуктами и лекарствами. Поэтому для того, чтобы они хорошо действовали, необходимо принимать их не менее чем за 40 минут до первого приема пищи. Оптимально принять таблетку сразу после подъема с постели, запить ее полным стаканом воды и дать возможность организму спокойно проснуться. Желательно по возможности разнести прием этих лекарств со всеми остальными с интервалом не менее 3 часов.
- Если гипотиреоз возник до наступления беременности или уже во время нее, то в любом случае женщине показан прием препаратов щитовидной железы под строгим лабораторным контролем. Отсутствие лечения может привести к серьезным осложнениям и порокам развития у плода. Лекарства эти относятся к категории А, то есть не оказывают тератогенного действия. Они проникают в грудное молоко, но не влияют негативно на организм младенца, поэтому их спокойно можно применять и при послеродовом гипотиреозе.
- Врожденный гипотиреоз — тяжелое заболевание, при котором жизненно необходим прием препаратов щитовидной железы. Стартовая терапия составляет 10-15 мкг на 1 кг массы тела младенца, с течением времени она постепенно снижается и составляет 2-3 мкг на 1 кг к возрасту совершеннолетия.
Противопоказания и побочные эффекты этих лекарств

К сожалению, лекарства эти — не безобидные витаминки. Они влияют на обмен веществ, поэтому на фоне терапии иногда возможны и осложнения.
- Побочными эффектами приема левотироксина и лиотрионина являются прежде всего аллергические реакции и другие признаки непереносимости. Они объясняются наличием в составе йода и белковых примесей. Помимо этого, возможны различные диспептические расстройства, тошнота, боли в животе, вздутие и нарушение стула. Если назначить слишком высокую дозу, либо не контролировать ее лабораторно, возможно развитие медикаментозного тиреотоксикоза. У больных с ишемической болезнью сердца возможно учащение приступов стенокардии, снижение толерантности к нагрузке.
- Абсолютным противопоказанием к приему препаратов гормонов щитовидной железы являются некомпенсированный тиреотоксикоз, острый инфаркт миокарда и острая надпочечниковая недостаточность. Вопрос остается открытым при наличии у больного мерцательной аритмии, нестабильной стенокардии и миокардита. В каждом случае ситуация решается индивидуально.
Препараты гормонов щитовидной железы изменяют метаболизм лекарств, влияющих на свертываемость крови, антидепрессантов, сердечных гликозидов и некоторых антибиотиков. О приеме этих лекарственных средств следует обязательно уведомить врача-эндокринолога.
Препараты гормонов щитовидной железы должны назначаться и отменяться только доктором.