Сурфактанты у новорожденного: что нового? XXI Всероссийский научно-образовательный форум «Мать и дитя». Сателлитный симпозиум компании «Натива»
Респираторный дистресс-синдром (РДС), в патогенезе которого лежит дефицит сурфактанта, является частым и тяжелым заболеванием раннего неонатального периода у недоношенных новорожденных. В связи с этим особый интерес представляет доклад Андрея Юрьевича РЫНДИНА, к.м.н., старшего научного сотрудника отделения реанимации и интенсивной терапии им. А.Г. Антонова ФГБУ «НМИЦ акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России, посвященный актуальным вопросам использования заместительной сурфактантной терапии на примере Сурфактанта-БЛ для стабилизации респираторной функции при РДС и врожденной пневмонии у недоношенных новорожденных.
- КЛЮЧЕВЫЕ СЛОВА: сурфактантная терапия, дистресс-синдром, недоношенные дети
Респираторный дистресс-синдром (РДС), в патогенезе которого лежит дефицит сурфактанта, является частым и тяжелым заболеванием раннего неонатального периода у недоношенных новорожденных. В связи с этим особый интерес представляет доклад Андрея Юрьевича РЫНДИНА, к.м.н., старшего научного сотрудника отделения реанимации и интенсивной терапии им. А.Г. Антонова ФГБУ «НМИЦ акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России, посвященный актуальным вопросам использования заместительной сурфактантной терапии на примере Сурфактанта-БЛ для стабилизации респираторной функции при РДС и врожденной пневмонии у недоношенных новорожденных.
Заместительная сурфактантная терапия считается одним из основных методов лечения респираторного дистресс-синдрома (РДС) новорожденных, однако оптимальный выбор препарата, сроки его введения, дозы, а также особенности проведения сурфактантной терапии у новорожденных различного гестационного возраста остаются предметом обсуждения.
Препараты сурфактанта подразделяются на синтетические и натуральные. Последние получают из измельченной легочной ткани свиней или телят. На сегодняшний день в России разрешено использовать в рекомендуемых дозах четыре препарата животного происхождения: свиной сурфактант – порактант альфа (Куросурф) 100–200 мг/кг и три бычьих – берактант (Сюрванта) 100 мг/кг, бовактант (Альвеофакт) 50 мг/кг и отечественный Сурфактант-БЛ 75 мг/кг.
В неонатальной практике широкое распространение получил Сурфактант-БЛ – препарат природного происхождения, включающий комплекс веществ из смеси фосфолипидов и сурфактант-ассоциированных белков.
Активное использование Сурфактанта-БЛ в НМИЦ акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова началось в 2000 г. Только за шесть лет (2000–2006 гг.) Сурфактант-БЛ был применен с лечебной целью более чем у 180 детей, рожденных на различных сроках гестации (26–34 недели) с РДС и врожденной пневмонией. Внедрение заместительной сурфактантной терапии позволило существенно повысить выживаемость недоношенных.
Препарат применяли в первые сутки жизни в дозе 75 мг/кг у детей с первичным диагнозом РДС, находившихся на искусственной вентиляции легких (ИВЛ). Повторные дозы вводились при необходимости через 12 часов в случае продолжающейся ИВЛ с FiO2 > 0,4 и МАР > 7 см.
Сурфактант-БЛ (флакон 75 мл) разводили в 3,0 мл изотонического раствора хлорида натрия для инъекций и вводили эндотрахеально через боковое отверстие адаптера интубационной трубки с помощью шприцевого дозатора, капельно (микроструйно) в течение 30–60 минут. Максимальное число введений препарата – трехкратно.
Выживаемость маловесных новорожденных на фоне терапии Сурфактантом-БЛ была высокой и в среднем составила 82,3% при РДС и 89% при врожденной пневмонии. Кроме того, применение у детей высокочастотной осцилляторной вентиляции в комплексе с Сурфактантом-БЛ способствовало снижению продолжительности ИВЛ с токсической концентрацией кислорода (> 60%), более быстрому достижению нетоксической концентрации ( 1 было осуществлено ингаляционное введение порактанта альфа новорожденным с РДС в период использования nCPAP. Но эффекта не наблюдалось. В 2004 г. J. Brimacombe и соавт. описали два случая введения сурфактанта через LMA 2 , а J. Kattwinkel и соавт. – случай назофарингеального введения сурфактанта Infasurf при рождении 3 .
Метод назофарингеального введения сурфактанта Infasurf во время родов без интубации трахеи был интересен, но не получил продолжения. Хотя, согласно полученным результатам, большинство недоношенных после введения сурфактанта сразу начинали дышать. У пяти из 15 родившихся с помощью стандартного родоразрешения и двух из восьми появившихся на свет с помощью кесарева сечения возникла потребность в ИВЛ. У четырех новорожденных развился РДС, но только у одного он был подтвержден при выполнении рентгенографии.
В 2005 г. D. Trevisanuto и соавт. оценивали эффективность ларингеальной маски для введения натурального сурфактанта десяти новорожденным с РДС, массой тела менее 800 г и гестационным возрастом менее 35 недель 4 . Пациенты получали терапию сурфактантом 100 мг/кг. Двое из десяти получили две дозы сурфактанта, еще двум потребовалась ИВЛ, у одного ребенка развился пневмоторакс.
В 2017 г. было проведено рандомизированное контролируемое исследование, результаты которого позволили сделать вывод, что введение сурфактанта с помощью ларингеальной маски снижает частоту интубации и механической вентиляции легких 5 .
В ряде исследований оценивали эффективность ингаляционного введения сурфактанта детям во время проведения nCPAP. Как уже отмечалось, в исследовании E. Berggren и соавт. 1 эффекта не наблюдалось. Однако, по мнению исследователей, на отсутствие эффекта могли повлиять различия в методиках введения, поскольку единого протокола не было. Необходимы дальнейшие исследования для оптимизации аэрозольного введения сурфактанта новорожденным.
В многоцентровом исследовании N.N. Finer и соавт. (2006 г.) недоношенным новорожденным, находившимся на оксигенотерапии с помощью nCPAP с вариабельным потоком с целью профилактики РДС, вводили синтетический сурфактант Aerosurf через небулайзер. Согласно полученным данным, все 17 пациентов выжили, семерым потребовалась ИВЛ, шестеро из семи получили Aerosurf эндотрахеально. К 28-му дню БЛД развилась у 11,7% новорожденных.
Установлены показания для поздней терапии сурфактантом формирующейся БЛД. Основанием послужили результаты исследований, свидетельствующие о том, что терапия сурфактантом оправданна при длительной (более недели) респираторной терапии (ИВЛ, CPAP) у детей с ЭНМТ и очень низкой массой тела (ОНМТ) 6 . У большинства младенцев, которые находились на ИВЛ в течение недели или более, развился дефицит сурфактанта и белков сурфактанта В и С, что сопровождалось дыхательной недостаточностью.
В 2011 г. была разработана методика поздней заместительной терапии Сурфактантом-БЛ. Ее суть в том, что новорожденному с ОНМТ и ЭНМТ, находящемуся на инвазивной или неинвазивной ИВЛ в течение семи суток, вводят через небулайзер легочный сурфактант сеансами по 10–15 минут в разовой дозе 53–75 мг/кг ежедневно или с суточным интервалом в течение 1–5 дней.
Сурфактант-БЛ через небулайзер с генератором аэрозоля OnQ Aeroneb Pro вводят новорожденным, находящимся на неинвазивной ИВЛ (Biphasic/DuoPAP) в режиме nCPAP, через назальные канюли с восьмого дня респираторной терапии, ежедневно или с суточным промежутком, сеансами по 10–15 минут в зависимости от объема вводимой эмульсии сурфактанта, в разовой дозе 53–75 мг/кг. Максимально – пять сеансов.
Целесообразность применения небулайзера Aeroneb обусловлена тем, что апертурная пластина вибрирует со скоростью свыше 130 Гц. Это стимулирует отверстие действовать подобно микропомпе и проталкивать капли жидкости через отверстия одинакового размера. В результате аэрозоль поступает с низкой скоростью, оптимальной для альвеолярного осаждения. OnQ-аэрозоли используются полностью, при этом лекарство не нагревается и его молекулярная целостность сохраняется.
Результаты применения поздней заместительной терапии Сурфактантом-БЛ новорожденным с пролонгированной nCPAP (более двух недель) показали, что из семи детей шестеро получили при рождении Куросурф (методом INSURE), одному ребенку проведена терапия Сурфактантом-БЛ после клипирования открытого артериального протока. Только у двух пациентов к 36-му дню жизни отмечались признаки БЛД легкой степени.
Специалисты отделения реанимации и интенсивной терапии НМИЦ акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова участвовали в протоколе клинической апробации применения методик малоинвазивного применения сурфактанта и позднего ингаляционного введения сурфактанта с целью профилактики БЛД у новорожденных с ОНМТ и ЭНМТ при рождении.
В исследование включались пациенты с ОНМТ и ЭНМТ с дыхательными расстройствами и показаниями для сурфактантной терапии при рождении, а также продолжающейся дыхательной терапии на второй неделе жизни.
Полученные в ходе клинической апробации данные позволили сделать вывод, что применение малоинвазивного введения сурфактанта с целью профилактики БЛД у новорожденных с ОНМТ и ЭНМТ при рождении имеет клинико-экономическую эффективность.
Завершая выступление, А.В. Рындин акцентировал внимание коллег на результатах круглого стола по актуальным вопросам использования препарата Сурфактант-БЛ в клинической практике, состоявшегося 18 сентября 2020 г. В ходе мероприятия обсуждались такие вопросы, как повышение качества потребительских свойств препарата, включение в клинические рекомендации обновленных данных о применении Сурфактанта-БЛ при РДС новорожденных, инициация обучающих программ по использованию Сурфактанта-БЛ в рамках повышения квалификации специалистов. В обсуждении приняли участие соучредители и представители компании-производителя ООО «Биосурф» и ООО «Натива» – фармацевтической компании по продвижению и продажам препарата Сурфактант-БЛ, специалисты-эксперты из российских регионов, главные внештатные неонатологи Москвы и Московской области, ключевые специалисты в области неонатальной реанимации и интенсивной терапии НМИЦ акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова.
В трех презентациях был представлен опыт применения Сурфактанта-БЛ у новорожденных как при РДС, так и при БЛД. «Участники круглого стола пришли к единодушному мнению, что препарат Сурфактант-БЛ необходим и востребован специалистами-неонатологами. В дальнейшем важно особое внимание уделять вопросам усовершенствования его свойств. Речь, в частности, идет об увеличении концентрации фосфолипидов, изменении особенностей хранения, а также выпуске препарата в форме готовой эмульсии», – резюмировал докладчик.
Что такое сурфактант легочный
Сурфактант. Поверхностное натяжение и спадение альвеол
а) Принцип поверхностного натяжения. Молекулы воды на поверхности водной среды, граничащей с воздухом, имеют между собой особо прочную связь. В результате такая поверхность воды всегда стремится к сокращению. Именно это явление формирует дождевые капли: в них образуется плотная стягивающая мембрана из молекул воды по всей поверхности дождевой капли. Посмотрим на эту закономерность с обратной стороны и постараемся понять, что происходит на внутренних поверхностях альвеол. Здесь поверхность жидкости также стремится к сокращению.
Появляется стремление к выжиманию воздуха из альвеол к бронхам, в результате альвеолы начинают спадаться, и в легких образуется эластическая сила сокращения, которую называют эластической силой поверхностного натяжения.
б) Сурфактант и его влияние на поверхностное натяжение. Сурфактант — это поверхностно активное вещество, которое значительно уменьшает поверхностное натяжение воды. Оно секретируется специальными сурфактант-секретирующими эпителиальными клетками, которые составляют около 10% площади поверхности альвеол. Эти клетки называют альвеолярными эпителиальными клетками второго типа. Они являются гранулярными, т.к. содержат липидные включения, которые в составе сурфактанта секретируются в альвеолы.
Сурфактант представляет собой сложную смесь из нескольких фосфолипидов, белков и ионов. Наиболее важными его составляющими являются фосфолипид дипальмитоилфосфатидилхолин, апопротеины сурфактанта и ионы кальция. Именно дипальмитоилфосфатидилхолин наряду с некоторыми менее важными фосфолипидами вызывает снижение поверхностного натяжения. При этом в жидкостной мембране на поверхности альвеол растворяется только часть его молекулы, а остальная часть расплывается на поверхности жидкостного слоя в альвеоле.
Поверхностное натяжение такой поверхности составляет только от 1/12 до 1/2 по сравнению с таковым чистой воды.
Количественные соотношения поверхностного натяжения для разных жидкостей выглядят примерно так: чистая вода — 72 дин/см, нормальная альвеолярная жидкость без сурфактанта — 50 дин/см, нормальная альвеолярная жидкость, содержащая нормальное количество сурфактанта, — от 5 до 30 дин/см.
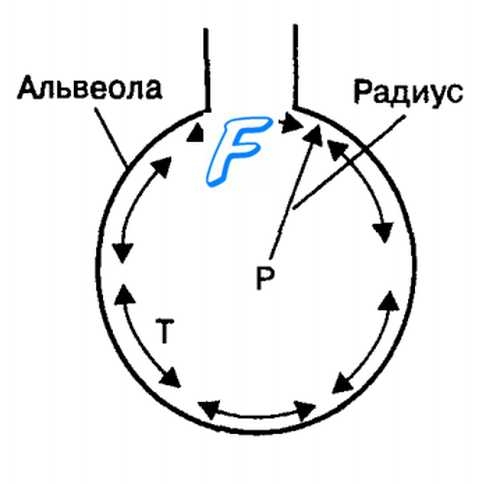
Приложение закона Лапласа к изменению поверхностного натяжения слоя жидкости, покрывающего поверхность альвеол.
Изменение радиуса альвеол изменяет в прямой зависимости величину поверхностного натяжения в альвеолах (Т).
Давление (Р) внутри альвеол также варьирует при изменении их радиуса: уменьшается при вдохе и увеличивается при выдохе.
в) Давление в закрытых альвеолах, вызванное поверхностным натяжением. Когда воздухоносные пути, ведущие от легочных альвеол, закрыты, поверхностное натяжение в альвеолах обусловливает спадение альвеол. Вследствие этого в альвеолах развивается положительное давление, действие которого направлено на выталкивание воздуха. Величину развивающегося таким путем давления в альвеоле можно вычислить по формуле:
Давление = 2 х Поверхностное натяжение / Радиус альвеолы.
Для альвеолы среднего размера, имеющей радиус около 100 мкм и выстланной нормальным сурфактантом, давление равно около 4 см вод. ст. Если альвеола была бы выстлана слоем чистой воды без сурфактанта, расчетное давление составляло бы около 18 см вод. ст., т.е. в 4,5 раз больше. Отсюда видно, насколько важным является сурфактант для снижения поверхностного натяжения в альвеолах и, следовательно, для снижения усилия, которое потребуется от дыхательных мышц для растяжения легких.
г) Влияние радиуса альвеолы на вызванное поверхностным натяжением давление. Из приведенной формулы следует, что давление, возникающее в альвеоле вследствие поверхностного натяжения, обратно пропорционально величине радиуса альвеолы, т.е. чем меньше альвеола, тем больше вызванное поверхностным натяжением давление. Таким образом, если радиус альвеолы окажется в 2 раза меньше нормального (50 мкм вместо 100), давление увеличивается в 2 раза.
Особое значение это имеет для недоношенных новорожденных, у многих из которых размеры радиуса альвеол составляют менее 1/4 таковых у взрослых. Обычно секреция сурфактанта в альвеолах начинается на 6-7 мес внутриутробного развития, в некоторых случаях даже позднее этого срока, поэтому у многих недоношенных детей в момент рождения в альвеолах еще нет сурфактанта или его очень мало, в результате их легкие имеют высокую тенденцию к спадению (иногда в 6-8 раз больше, чем у нормального взрослого). Такое состояние называют синдромом респираторного дистресса новорожденных. Без применения интенсивной терапии (продолжительного искусственного дыхания под положительным давлением) такое состояние приводит к смерти.
Видео физиология этапов дыхания, внешнего дыхания, спирометрии — профессор, д.м.н. П.Е. Умрюхин
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Сурфактант-БЛ (Surfaktant-BL)
1 флакон содержит 25 мг сурфактанта, выделенного из легких крупного рогатого скота и представляющего собой смесь фосфолипидов и сурфактант-ассоциированных белков.
Описание лекарственной формы
Лиофилизированная, спрессованная в таблетку масса или порошок белого или белого с желтоватым оттенком цвета. При добавлении к препарату 0,9% раствора натрия хлорида и тщательном перемешивании образуется однородная эмульсия белого с кремоватым или белого с желтоватым оттенком цвета, в которой не должны наблюдаться хлопья или твердые частицы.
Фармакокинетика
Экспериментально показано, что после однократного интратрахеального введения препарата Сурфактант‑БЛ, его содержание в легких через 6–8 часов снижается и достигает исходной величины спустя 12 часов. Препарат полностью метаболизируется в легких альвеолоцитами II типа и альвеолярными макрофагами и не накапливается в организме.
Фармакодинамика
Препарат Сурфактант-БЛ высокоочищенный природный сурфактант из легких крупного рогатого скота является комплексом веществ из смеси фосфолипидов и сурфактант-ассоциированных белков, обладает способностью снижать поверхностное натяжение на поверхности легочных альвеол, предотвращая их коллапс и развитие ателектазов.
Препарат Сурфактант-БЛ восстанавливает содержание фосфолипидов на поверхности альвеолярного эпителия, стимулирует вовлечение в дыхание дополнительных участков легочной паренхимы и способствует удалению вместе с мокротой токсичных веществ и инфекционных возбудителей из альвеолярного пространства. Препарат повышает активность альвеолярных макрофагов и угнетает экспрессию цитокинов полиморфноядерными лейкоцитами (в том числе эозинофилами); улучшает мукоцилиарный клиренс и стимулирует синтез эндогенного сурфактанта альвеолоцитами II типа, а также защищает альвеолярный эпителий от повреждений химическими и физическими агентами, восстанавливает функции местного врожденного и адаптивного иммунитетов.
В исследованиях установлено, что при ежедневном ингаляционном введении в течение 10 дней, а также в течение 6 месяцев (с дополнительным периодом наблюдения в течение 1 месяца) препарат не оказывает влияния на сердечно-сосудистую систему, не обладает местнораздражающим действием, не влияет на состав крови и кроветворение, не влияет на биохимические параметры крови, мочи и свертывающую систему крови, не вызывает патологических изменений функций и структуры внутренних органов, не обладает тератогенными, аллергенными и мутагенными свойствами.
В многоцентровых рандомизированных клинических исследованиях с участием пациентов с туберкулезом легких, которые получали стандартное лечение противотуберкулезными препаратами в течение 2–6 месяцев и у которых не отмечено положительной динамики, по результатам оценки эффективности двухмесячного курса ингаляций препарата Сурфактант‑БЛ в составе комплексной терапии отмечено следующее: прекращение бактериовыделения после окончания курса препарата Сурфактант‑БЛ наблюдалось у 50% пациентов и у 24,0% пациентов в контрольной группе. Через 16 недель после начала лечения у 80,0% пациентов было достигнуто абацилирование по сравнению с 62,0% в контрольной группе; у 100% пациентов основной группы и у 68,0% пациентов контрольной группы выявлено уменьшение инфильтративных и очаговых изменений; у 70,0% пациентов основной группы и у 36,0% пациентов группы сравнения выявлено закрытие каверны (каверн). Таким образом, эффект при такой комбинированной терапии наступает существенно быстрее и у достоверно большего процента пациентов в сравнении с принятыми схемами противотуберкулезной терапией.
Показания
В комплексной терапии туберкулеза легких, как у пациентов с впервые выявленным туберкулезом, так и при рецидиве заболевания, при инфильтративной (с распадом и без распада) или кавернозной клинической форме, в том числе при наличии лекарственной устойчивости Mycobacterium tuberculosis, вплоть до множественной лекарственной устойчивости.
Противопоказания
· Склонность к кровохарканью и легочным кровотечениям.
· Синдром утечки воздуха.
· Детский возраст до 18 лет, так как клинические исследования в данной возрастной группе не проводились и дозы не определены.
Способ применения и дозы
Препарат Сурфактант-БЛ применяется в составе комплексной терапии пациентов с туберкулезом легких на фоне полностью развернутой терапии противотуберкулезными препаратами (ПТП), то есть, когда пациенту эмпирически или на основе данных о лекарственной чувствительности возбудителя, подобраны 4–6 ПТП, которые в назначенной дозе и комбинации хорошо переносятся пациентом. Препарат Сурфактант‑БЛ назначается многократно в дозе 25 мг на одну ингаляцию:
— первые 2 недели — по 5 раз в неделю,
— последующие 6 недель — по 3 раза в неделю (через 1–2 дня).
Продолжительность курса 8 недель — 28 ингаляций, суммарная доза препарата Сурфактант‑БЛ 700 мг. Ингаляции назначают до еды или через 1,5–2 часа после еды. В процессе курса лечения препаратом Сурфактант‑БЛ можно по показаниям отменять (заменять) ПТП. Химиотерапия продолжается и после завершения курса лечения препаратом Сурфактант‑БЛ.
1. Перед приготовлением эмульсии флакон с препаратом Сурфактант‑БЛ согрейте в руке в течение не менее 1 минуты.
2. Возьмите шприц объемом 3–5 мл с иглой 18G или 19G длиной не менее 50 мм и присоедините иглу к шприцу. Наберите в шприц 2,5 мл теплого (37 °C) 0,9% раствора натрия хлорида для инъекций.
3. Снимите пластиковую крышечку с флакона препарата Сурфактант‑БЛ, содержащего лиофилизат. Продезинфицируйте резиновую пробку флакона спиртовым раствором.
4. Вставьте иглу во флакон с лиофилизатом через центр резиновой пробки (рисунок 1) и осторожно введите раствор натрия хлорида по внутренней стенке флакона (рисунок 2).
5. Немедленно круговыми движениями перемешайте содержимое флакона в течение 5–10 секунд (рисунок 3). Флакон нельзя переворачивать и встряхивать.
6. Дайте флакону постоять 2–3 минуты.
7. Содержимое флакона полностью наберите в шприц, при этом флакон необходимо расположить под небольшим углом, а иглу шприца — срезом к стенке флакона (рисунок 4).
8. Затем содержимое шприца введите обратно по стенке флакона, избегая образования пены. Повторите процедуру 4–5 раз. Флакон нельзя переворачивать и встряхивать.
9. Удалите иглу из эмульсии (но не из флакона), чтобы эмульсия не поступала в шприц (рисунок 5).
10. Выдержите флакон около 1 минуты неподвижно на прямой поверхности с помощью штатива для флаконов, пока не произойдет отделения пены (рисунок 6). Готовая эмульсия белого с кремоватым или белого с желтоватым оттенком цвета, в ней не должны наблюдаться хлопья или твердые частицы.
11. Не удаляя иглы из флакона с готовой эмульсией, отсоедините шприц от иглы. Затем возьмите новую иглу 18G или 19G длиной не менее 50 мм и присоедините ее к шприцу. Наберите в шприц 2,5 мл теплого (37 °C) 0,9% раствора натрия хлорида для инъекций.
12. Отсоедините шприц от иглы, с помощью которой набирали 0,9% раствор натрия хлорида для инъекций, и присоедините шприц с раствором к игле, находящейся во флаконе с эмульсией, и дополнительно разведите полученную эмульсию 0,9% раствором натрия хлорида до 5 мл (получится 0,5% эмульсия, 5 мг в 1 мл 0,9% раствора натрия хлорида). Полученную эмульсию дополнительно разведите 0,9% раствором натрия хлорида до 5 мл (получится 0,5% эмульсия, 5 мг в 1 мл 0,9% раствора натрия хлорида).
13. Медленно наберите эмульсию в шприц, при этом оставляя пену во флаконе (рисунок 7).
14. Эмульсию перенесите в камеру небулайзера, затем обмойте внутреннюю поверхность флакона 2 мл 0,9% раствора натрия хлорида и также перенесите их в небулайзер.
Предупреждение: игла должна оставаться во флаконе на протяжении всей процедуры приготовления восстановленной эмульсии. После завершения процесса приготовления эмульсии иглу больше нельзя использовать, ее необходимо утилизировать.
Эмульсия, приготовленная для проведения ингаляций, должна быть использована в течение 12 часов при хранении при температуре от +4 °C до +8 °C (эмульсию не замораживать). Перед использованием эмульсию необходимо осторожно перемешать и согреть до 36–37 °C.
Ингаляционное введение: 5,0 мл полученной эмульсии (25 мг), находящейся в камере небулайзера, используют для ингаляции. Ингаляции проводят за 1,5–2 часа до или 1,5–2 часа после приема пищи. Для проведения ингаляций используют mesh-небулайзеры или небулайзеры компрессорного типа (например, «Elisir» компании «ИзоМед», Россия, «Borel» фирмы «Flaem Nuova», Италия или «Pari Boy SX» фирмы Pari GmbH, Германия или их аналоги, позволяющие распылять небольшие объемы лекарственных средств и снабженные приспособлением экономайзер, который позволяет прекращать подачу препарата во время выдоха, что существенно уменьшает потери препарата). Использование экономайзера с небулайзерами компрессионного типа чрезвычайно важно, чтобы пациенту была введена терапевтическая доза препарата без потерь (25 мг). Если из-за тяжести состояния пациент не может использовать весь объем эмульсии, следует делать перерывы на 15–20 минут, а затем продолжать ингаляцию. При наличии большого количества мокроты перед ингаляцией следует тщательно ее откашлять. При наличии данных о бронхообструкции за 30 минут до ингаляции эмульсии препарата Сурфактант‑БЛ необходимо предварительно сделать ингаляцию β2‑адреномиметика (по выбору врача), уменьшающего бронхообструкцию.
Необходимо использовать только компрессорные, а не ультразвуковые небулайзеры, так как препарат Сурфактант‑БЛ разрушается при обработке эмульсии ультразвуком. До введения препарата необходимо провести тщательную санацию трахеобронхиального дерева, предварительно приняв меры для улучшения дренирования мокроты: вибромассаж, постуральная терапия и муколитики, которые необходимо назначать за 3–5 дней до начала терапии препаратом Сурфактант‑БЛ при отсутствии противопоказаний к их назначению.
Передозировка
Препарат Сурфактант–БЛ при внутривенном, внутрибрюшинном и подкожном способах введения мышам в дозе 600 мг/кг и при ингаляционном введении крысам в дозе 400 мг/кг не вызывал изменений в поведении и состоянии животных. Ни в одном случае не было гибели животных. В клинической практике случаев передозировки не наблюдалось.
Побочные действия
При лечении туберкулеза легких у 60–70% пациентов после 3–5 ингаляций происходит существенное увеличение объема отделяемой мокроты или появляется мокрота, которой до начала ингаляций не было. Также отмечается эффект «легкого отхождения мокроты», при этом значительно снижается интенсивность и болезненность кашля, улучшается переносимость физической нагрузки. Эти объективные изменения и субъективные ощущения являются проявлением прямого действия препарата Сурфактант‑БЛ и не являются побочными реакциями.
В редких случаях после 2–3 ингаляций может возникнуть кровохарканье. В этом случае необходимо прекратить курс лечения препаратом Сурфактант‑БЛ, а затем через 3–5 дней возобновить ингаляции.
Особые указания
Использование препарата Сурфактант‑БЛ возможно для лечения пациентов с туберкулезом легких в стационаре и в условиях дневного стационара противотуберкулезного диспансера.
Влияние на способность управлять транспортными средствами, механизмами
Влияние терапии препаратом Сурфактант‑БЛ на способность управлять транспортными средствами, механизмами не изучалось.
Взаимодействие
Препарат Сурфактант-БЛ нельзя использовать совместно с отхаркивающими средствами, так как последние будут удалять введенный препарат вместе с мокротой.
Несовместимость препарата Сурфактант‑БЛ с каким-либо ПТП не отмечена. Нет данных о взаимодействиях с ПТП, вводимыми в аэрозолях, поэтому следует воздержаться от их совместного применения.
Форма выпуска
Лиофилизат для приготовления эмульсии для ингаляционного введения 25 мг.
По 25 мг во флаконах стеклянных вместимостью 10 мл, укупоренных резиновыми пробками и завальцованных алюминиевыми колпачками.
По 2 флакона помещают в пачку картонную, по 5 пачек вместе с равным количеством инструкций по применению помещают в коробку из картона коробочного с вкладышем из пенопласта.
Функции белков сурфактанта в лёгких
Поверхность альвеолярного эпителия в лёгких покрыта сурфактантом, необходимым для обеспечения дыхания и адекватной иммунной защиты. Лёгочный сурфактант состоит из липидов (90%) и ряда белков, имеющих различные функции. Сурфактантные белки представлены белками SP-A, SP-D, SP-B и SP-C. В данном обзоре обсуждаются основные функции сурфактантных белков.
Ключевые слова
Обзор
Лёгкие выполняют две главные функции в организме: обеспечение дыхания и функционирование механизмов иммунной защиты. Корректное выполнение данных функций связано с лёгочным сурфактантом.
Сурфактант в лёгких синтезируется альвеолярными клетками II типа и секретируется в альвеолярное пространство. Сурфактант покрывает поверхность альвеолярного эпителия и состоит из липидов (90 %) и белков (10 %), составляя липопротеидный комплекс. Липиды представлены в основном фосфолипидами. Дефицит и/или качественные изменения состава легочного сурфактанта описаны при туберкулезе, респираторном дистресс-синдроме новорожденных, пневмонии и других заболеваниях. [1-4].
Сурфактантные белки представлены белками SP-A, (Surfactant Protein A, 5,3%), SP-D (0,6 %), SP-B (0,7 %), и SP-C (0,4%). [4-6].
Функции гидрофильных белков SP-A и SP-D связаны с иммунной защитой в легких. Эти белки связывают липополисахарид грамотрицательных бактерий и агрегируют различные микроорганизмы, влияют на активность тучных, дендритных клеток, лимфоцитов и альвеолярных макрофагов. SP-A ингибирует созревание дендритных клеток, тогда как SP-D увеличивает способность альвеолярных макрофагов к захвату и презентации антигенов, стимулируя адаптивный иммунитет [7,8].
Сурфактантный белок А является наиболее обильным белком лёгочного сурфактанта. Он обладает выраженными иммуномодулирующими свойствами. Белок SP-A воздействует на рост и жизнеспособность микроорганизмов, повышая проницаемость их цитоплазматической мембраны. Более того, SP-A стимулирует хемотаксис макрофагов, влияет на пролиферацию клеток иммунного ответа и на продукцию цитокинов, повышает продукцию реактивных оксидантов, повышает фагоцитоз клеток, подвергшихся апоптозу и стимулирует фагоцитоз бактерий. SP-A человека состоит из двух генных продуктов — SP-A1 и SP-A2, структура и функция которых различна. Наиболее важное различие в структуре SP-A1 и SP-A2- аминокислотная позиция 85 коллагеноподобного региона белка SP-A, где SP-A1 имеет цистеин, а SP-A2 – аргинин. Функциональные различия между SP-A1 и SP-A2 включают их способность стимулировать фагоцитоз, ингибировать секрецию сурфактанта.[7]. Во всех этих случаях SP-A2 обладает большей активностью, чем SP-A1. [8].
Функции гидрофобных белков SP-B и SP-C связаны с обеспечением возможности дыхания. Они снижают поверхностное натяжение в альвеолах и способствуют равномерному распределению сурфактанта на поверхности альвеол. [9].
Литература
1. Ерохин В.В., Лепеха Л.Н., Ерохина М.В., Бочарова И.В., Курынина А.В., Онищенко Г.Е. Избирательное влияние легочного сурфактанта на разные субпопуляции альвеолярных макрофагов при туберкулезе // Актуальные вопросы фтизиатрии.- 2012. — №11.- С. 22-28.
2. Филоненко Т.Г., Распределение сурфактант-ассоциированных белков при фиброзно-кавернозном туберкулезе легких с активным бактериовыделением // Таврический медико-биологический вестник. – 2010.- №4 (52). – С. 188-192.
3. Chroneos Z.C., Sever- Chroneos Z., Shepherd V.L. Pulmonary surfactant: an immunological perspective //Cell Physiol Biochem 25: 13-26. – 2010.
4. Розенберг О.А. Легочный сурфактант и его применение при заболеваниях легких // Общая реаниматология. – 2007. — №1. – С. 66-77
5. Pastva A.M., Wright J.R., Williams K.L. Immunomodulatory roles of surfactant proteins A and D: implications in lung disease // Proc Am Thorac Soc 4: 252-257.-2007.
6. Oberley R.E., Snyder J.M. Recombinant human SP-A1 and SP-A2 proteins have different carbohydrate-binding characteristics // Am J Physiol Lung Cell Mol Physiol 284: L871-881, 2003.
7. A.N. Mikerov, G. Wang, T.M. Umstead, M. Zacharatos, N.J. Thomas, D.S. Phelps, J. Floros. Surfactant protein A2 (SP-A2) variants expressed in CHO cells stimulate phagocytosis of Pseudomonas aeruginosa more than do SP-A1 variants // Infection and Immunity. — 2007. — Vol. 75. — P. 1403-1412.
8. Микеров А.Н. Роль сурфактантного белка А в иммунной защите легких // Фундаментальные исследования. – 2012. — №2. – С. 204-207.
9. Синюкова Т.А., Коваленко Л.В. Сурфактантные белки и их роль в функционировании дыхательной системы // Вестник СурГУ Медицина. – 2011. — №9. – С. 48-54
СУРФАКТАНТ
Сурфактант (от англ. surface active agents поверхностно-активные вещества; син.: антиателектатический фактор, поверхностно-активный фактор) — сложное вещество липидно-белково-углеводной природы, располагающееся в виде пленки на границе раздела фаз воздух — жидкость в альвеолах легких и регулирующее поверхностное натяжение при изменении их объема. Основная физиологическая роль Сурфактанта заключается в поддержании стабильности альвеолярной структуры легких (см.) путем понижения поверхностного натяжения в альвеолах при уменьшении их объема на выдохе. Сурфактант участвует в обмене газов и жидкости через аэрогематический барьер, удалении инородных частиц с поверхности альвеол, защите элементов стенки альвеол от повреждающего действия окислителей и перекисей, а также, как предполагают, в иммунных реакциях.
Структура Сурфактанта, его функции, значение в патологии остаются недостаточно ясными и являются предметом дискуссий. Наиболее обосновано представление о Сурфактанте как пластинчатой или сетчатой структуре, к-рая состоит из билипидных мембран и включает липопротеидные и гликопротеидные комплексы. Сходное строение имеют мембраны осмиофильных ламеллярных телец альвеолоцитов, синтезирующих и секретирующих поверхностно-активные вещества. Главным химическим компонентом Сурфактанта являются фосфолипиды, из к-рых наиболее выраженной поверхностной активностью обладает фракция насыщенного фосфатидилхолина (лецитина) — дипальмитилфосфатидилхолин; кроме того, выделены фракции фосфатидилэтаноламина, фосфатидилглицерина, фосфатидилсерина, лизофосфатидилхолина, сфингомиелина, фосфатидилинозитола, фосфатидной и лизодифосфатидной к-т. В состав С. входят также триглицериды, холестерин, сывороточные (альбумин, иммуноглобулины и др.) и специфические несывороточные (апопротеины Сурфактанта) белки, углеводы (глюкоза, галактоза, фукоза, гликозаминогликаны и др.).
На С. могут оказывать повреждающее действие различные экзогенные и эндогенные факторы: нарушение парциального давления кислорода во вдыхаемом воздухе, загрязнение воздуха, микроорганизмы, средства для наркоза, нарушения гемодинамики, вентиляции, иннервации и метаболизма в легких при заболеваниях легких и сердца, оперативных вмешательствах и др.
Многие патологические процессы в легких (отек, кровоизлияния, ателектаз, эмболия сосудов) сопровождаются снижением поверхностной активности С. Изменения С. обнаружены в очагах пневмонии, пневмосклероза, туберкулеза, при эмфиземе легких. Однако в большинстве случаев окончательно не выяснена причинная связь нарушений свойств С. с определенным видом поражения, как и роль изменений С. в развитии того или иного патол. состояния легких. Установлено значение дефицита С. в патогенезе врожденного ателектаза (см.), гиалиново-мембранной болезни новорожденных (см.) и других пневмопатий новорожденных, клинически проявляющихся респираторным дистресс-синдромом (см.). Уменьшение активности С. рассматривают как один из механизмов развития очагового ателектаза, отека и гиалиновых мембран при дыхательной недостаточности у взрослых.
Сурфактант изучают с помощью морфологических методов, гл. обр. электронной микроскопии (см.) ткани легких, а также путем физ.-хим. и биохимических исследований эндобронхиальных смывов, аспиратов, экстрактов из ткани легких, из трахеи и глотки, амниотической жидкости. Хим. состав С. изучают с помощью общепринятых методов. Результаты исследования С. нашли применение в клинике для разработки диагностических тестов антенатальной оценки риска развития дистресс-синдрома (напр., определение количественного отношения лецитина к сфингомиелину в амниотической жидкости, шейк-тест), прогнозирования исхода этого синдрома, изыскания средств профилактики и лечения дыхательной недостаточности (см.).
Библиография: Березовский В. А. и Горчаков В. Ю. Поверхностно-активные вещества легкого, Киев, 1982, библиогр.; Биркун А. А., Нестеров E. Н. и Кобозев Г. В. Сурфактант легких, Киев, 1981, библиогр.; Ларюшвина Р. М. и Пуховская Н. В. Биохимическая диагностика состояния сурфактантной системы легких плода и новорожденного, Педиатрия, № 1, с. 9, 1980; Магомедов М. К., Титова Г. П. и Баринова М. В. Морфология ателектаза легких у оперированных и неоперированных больных с учетом состояния легочного сурфактанта, Арх. патол., т. 41, № 11, с. 57, 1979; Романова Л. К. и др. Адаптационные механизмы, обеспечивающие поверхностное натяжение в легких, Физиол. человека, т. 3, № 6, с. 1006, 1977; Оbladen М. Factors influencing surfactant composition in the newborn infant, Europ. J. Pediat., v. 128, p. 129, 1978; Robertson B. Surfactant substitution, Lung, v. 158, p. 57, 1980; Scarpelli E. M. The surfactant system of the lung, Philadelphia, 1968, bibliogr.
Что такое сурфактант легочный
Механизмы врождённого компонента иммунитета играют важную роль в первичном ответе на инфекцию. Врождённый иммунитет лёгких связан с функцией лёгочного сурфактанта, который наряду с поддержанием необходимого для дыхания поверхностного натяжения, обеспечивает иммунную защиту лёгких. В организме человека белок SP-A (SP-A, Surfactant Protein A), наиболее обильный белок сурфактанта лёгких человека с выраженными иммуномодулирующими свойствами, кодируется двумя генами – SP-A1 и SP-A2. Соотношение белков SP-A1 и SP-A2 в лёгких может отличаться у разных индивидумов. В данном обзоре рассматриваются вопросы, связанные с ролью лёгочного сурфактанта в имунной защите. Описаны строение и функции сурфактантного белка А. Значительное внимание уделено различиям в иммунобиологической активности между SP-A1 и SP-A2 вариантами белка SP-A и механизмам, лежащим в основе данных различий.

1. Surfactant protein A inhibits T cell proliferation via its collagen-like tail and a 210-kDa receptor / P. Borron, F.X. McCormack, B.M. Elhalwagi, Z.C. Chroneos, J.F. Lewis, S. Zhu, J.R. Wright, V.L. Shepherd, F. Possmayer, K. Inchley, L.J. Fraher // Am J Physiol Lung Cell Mol Physiol 275: L679-686. — 1998.
2. Surfactant-associated protein A inhibits LPS-induced cytokine and nitric oxide production in vivo / P. Borron, J.C. McIntosh, T.R. Korfhagen, J.A. Whitsett, J. Taylor, J.R. Wright // Am J Physiol Lung Cell Mol Physiol 278: L840-847. — 2000.
3. Brinker K.G., Garner H., Wright J.R. Surfactant protein A modulates the differentiation of murine bone marrow-derived dendritic cells // Am J Physiol Lung Cell Mol Physiol 284:
4. Chroneos Z.C., Sever-Chroneos Z., Shepherd V.L. Pulmonary surfactant: an immunological perspective // Cell Physiol Biochem 25: 13-26. — 2010.
5. Structural analysis and lipid-binding properties of recombinant human surfactant protein a derived from one or both genes / I. Garcia-Verdugo, G. Wang, J. Floros, C. Casals // Biochemistry 41: 14041-14053. — 2002.
6. By binding SIRPalpha or calreticulin/CD91, lung collectins act as dual function surveillance molecules to suppress or enhance inflammation / S.J. Gardai, Y.Q. Xiao, M. Dickinson, J.A. Nick, D.R. Voelker, K.E. Greene, P.M. Henson // Cell 115: 13-23. — 2003.
7. Pulmonary surfactant, lung function, and endobronchial inflammation in cystic fibrosis / M. Griese, R. Essl, R. Schmidt, E. Rietschel, F. Ratjen, M. Ballmann, K. Paul // Am J Respir Crit Care Med 170: 1000-1005. — 2004.
8. Role of surfactant protein-A in nitric oxide production and mycoplasma killing in congenic C57BL/6 mice / J.M. Hickman-Davis, J. Gibbs-Erwin, J.R. Lindsey, S. Matalon // American journal of respiratory cell and molecular biology 30: 319-325. — 2004.
9. Killing of Klebsiella pneumoniae by human alveolar macrophages / J.M. Hickman-Davis, P. O´Reilly, I.C. Davis, J. Peti-Peterdi, G. Davis, K.R. Young, R.B. Devlin, S. Matalon // Am J Physiol Lung Cell Mol Physiol 282: L944-956. — 2002.
10. Decreased contents of surfactant proteins A and D in BAL fluids of healthy smokers / Y. Honda, H. Takahashi, Y. Kuroki, T. Akino, S. Abe // Chest 109: 1006-1009. — 1996.
11. Hoover R.R., Floros J. Organization of the human SP-A and SP-D loci at 10q22-q23. Physical and radiation hybrid mapping reveal gene order and orientation // American journal of respiratory cell and molecular biology 18: 353-362. — 1998.
12. Surfactant proteins SP-A and SP-D: structure, function and receptors / U. Kishore, T.J. Greenhough, P. Waters, A.K. Shrive, R. Ghai, M.F. Kamran, A.L. Bernal, K.B. Reid, T. Madan, T. Chakraborty // Mol Immunol 43: 1293-1315. — 2006.
13. Kremlev S.G., Phelps D.S. Surfactant protein A stimulation of inflammatory cytokine and immunoglobulin production // Am J Physiol Lung Cell Mol Physiol 267: L712-719. — 1994.
14. Kremlev S.G., Umstead T.M., Phelps D.S. Effects of surfactant protein A and surfactant lipids on lymphocyte proliferation in vitro // Am J Physiol Lung Cell Mol Physiol 267: L357-364. — 1994.
15. Surfactant protein A-deficient mice are susceptible to group B streptococcal infection / A.M. LeVine, M.D. Bruno, K.M. Huelsman, G.F. Ross, J.A. Whitsett, T.R. Korfhagen // J Immunol 158: 4336-4340. — 1997.
16. Surfactant protein-A-deficient mice are susceptible to Pseudomonas aeruginosa infection / A.M. LeVine, K.E. Kurak, M.D. Bruno, J.M. Stark, J.A. Whitsett, T.R. Korfhagen // American journal of respiratory cell and molecular biology 19: 700-708. — 1998.
17. Distinct effects of surfactant protein A or D deficiency during bacterial infection on the lung / A.M. LeVine, J.A. Whitsett, J.A. Gwozdz, T.R. Richardson, J.H. Fisher, M.S. Burhans, T.R. Korfhagen // J Immunol 165: 3934-3940. — 2000.
18. Immunosuppressed surfactant protein A-deficient mice have increased susceptibility to Pneumocystis carinii infection / M.J. Linke, C.E. Harris, T.R. Korfhagen, F.X. McCormack, A.D. Ashbaugh, P. Steele, J.A. Whitsett, P.D. Walzer // J Infect Dis 183: 943-952. — 2001.
19. Surfactant proteins A and D protect mice against pulmonary hypersensitivity induced by Aspergillus fumigatus antigens and allergens / T. Madan, U. Kishore, M. Singh, P. Strong, H. Clark, E.M. Hussain, K.B. Reid, P.U. Sarma // J Clin Invest 107: 467-475. — 2001.
20. Ablation of SP-A has a negative impact on the susceptibility of mice to Klebsiella pneumoniae infection after ozone exposure: sex differences / A.N. Mikerov, R. Haque, X. Gan, X. Guo, D.S. Phelps, J. Floros // Respir Res 9: 77. — 2008.
21. SP-A1 and SP-A2 variants differentially enhance association of Pseudomonas aeruginosa with rat alveolar macrophages / A.N. Mikerov, T.M. Umstead, W. Huang, W. Liu, D.S. Phelps, J. Floros // Am J Physiol Lung Cell Mol Physiol 288: 150-158. — 2005.
22. Surfactant protein A2 (SP-A2) variants expressed in CHO cells stimulate phagocytosis of Pseudomonas aeruginosa more than Do SP-A1 variants / A.N. Mikerov, G. Wang, T.M. Umstead, M. Zacharatos, N.J. Thomas, D.S. Phelps, J. Floros // Infect Immun 75: 1403-1412. — 2007.
23. Oberley R.E., Snyder J.M. Recombinant human SP-A1 and SP-A2 proteins have different carbohydrate-binding characteristics //Am J Physiol Lung Cell Mol Physiol 284: L871-881, 2003.
24. Pastva A.M., Wright J.R., Williams K.L. Immuno- modulatory roles of surfactant proteins A and D: implications in lung disease // Proc Am Thorac Soc 4: 252-257. — 2007.
25. Phelps D.S. Surfactant regulation of host defense function in the lung: a question of balance // Pediatr Pathol Mol Med 20: 269-292. — 2001.
26. Schagat T.L., Wofford J.A., Wright J.R. Surfactant protein A enhances alveolar macrophage phagocytosis of apoptotic neutrophils // J Immunol 166: 2727-2733. — 2001.
27. Characterization of a human surfactant protein A1 (SP-A1) gene-specific antibody; SP-A1 content variation among individuals of varying age and pulmonary health / H.R. Tagaram, G. Wang, T.M. Umstead, A.N. Mikerov, N.J. Thomas, G.R. Graff, J.C. Hess, M.J. Thomassen, M.S. Kavuru, D.S. Phelps, J. Floros // American journal of physiology 292: L1052-1063. — 2007.
28. Pulmonary surfactant protein A enhances the host-defense mechanism of rat alveolar macrophages / F. van Iwaar- den, B. Welmers, J. Verhoef, H.P. Haagsman, L.M. van Golde // American journal of respiratory cell and molecular biology 2: 91-98. — 1990.
29. Voss T., Melchers K., Scheirle G., Schafer K.P. Stru- ctural comparison of recombinant pulmonary surfactant protein SP-A derived from two human coding sequences: implications for the chain composition of natural human SP-A // American journal of respiratory cell and molecular biology 4: 88-94. — 1991.
30. Differences in biochemical properties and in biological function between human SP-A1 and SP-A2 variants, and the impact of ozone-induced oxidation / G. Wang, S.R. Bates-Kenney, J.Q. Tao, D.S. Phelps, J. Floros // Biochemistry 43: 4227-4239. — 2004.
31. Effect of cysteine 85 on biochemical properties and biological function of human surfactant protein A variants Wang G., Myers C., Mikerov A., Floros J. // Biochemistry 46: 8425-8435. — 2007.
32. Wang G., Phelps D.S., Umstead T.M., Floros J. Human SP-A protein variants derived from one or both genes stimulate TNF-alpha production in the THP-1 cell line // Am J Physiol Lung Cell Mol Physiol 278: L946-954. — 2000.
34. Wright J.R., Youmans D.C. Pulmonary surfactant protein A stimulates chemotaxis of alveolar macrophage // Am J Physiol Lung Cell Mol Physiol 264: L338-344. — 1993.
35. Surfactant proteins A and D inhibit the growth of Gram-negative bacteria by increasing membrane permeability / H. Wu, A. Kuzmenko, S. Wan, L. Schaffer, A. Weiss, J.H. Fisher, K.S. Kim, F.X. McCormack // J Clin Invest 111: 1589-1602. — 2003.
36. Розенберг О.А. Лёгочный сурфактант и его применение при заболеваниях лёгких. Общая реаниматология. — 20073. — №1. — С. 66-77.
Известно, что лёгкие выполняют две главные функции в организме: обеспечение дыхания и функционирование механизмов врождённого иммунитета. Для выполнения этих двух функций важное значение отводится лёгочному сурфактанту, покрывающему поверхность альвеолярного эпителия лёгких. Лёгочный сурфактант состоит из липидов (~90 %) и белков (~10 %), представляя собой липопротеидный комплекс. Сурфактантные белки представлены белками SP-A, (Surfactant Protein A, ~5,3 %), SP-D (~0,6 %), SP-B (~0,7 %), and SP-C (~0,4 %). [4]. Компоненты липидной фракции и гидрофобные белки SP-B и SP-C участвуют в снижении поверхностного натяжения в лёгких, что позволяет предотвращать слипание альвеол в конце выдоха. Гидрофильные белки SP-A и SP-D отвечают за регулирование механизмов врождённого иммунитета. Нарушение состава и свойств сурфактанта связано с такими заболеваниями, как респираторный дистресс-синдром новорожденных, острый респираторный дистресс-синдром взрослых, бронхиальная астма, пневмония, туберкулез легких и др. [36].
Сурфактантный белок А (SP-A, Surfactant Protein A) является основным белком лёгочного сурфактанта, обладающим выраженными иммуномодулирующими свойствами. Белок SP-A функционирует как в качестве опсонизирующего агента, так и в качестве иммуномодулятора. Опсонизация и аггрегация патогенных микроорганизмов белком SP-A способствует их последующему фагоцитозу и киллингу. Было показано, что SP-A воздействует на рост и жизнеспособность микроорганизмов, повышая проницаемость микробной клеточной мембраны [35]. Более того, SP-A регулирует механизмы иммунной защиты в лёгких путём связывания звеньев врождённого и приобретённого компонентов иммунитета [3]. Среди регуляторных функций SP-A — его способность стимулировать хемотаксис макрофагов [34], влиять на пролиферацию клеток иммунного ответа [14] и на продукцию провоспалительных цитокинов [2, 13], повышать продукцию реактивных оксидантов [28], регулировать продукцию оксида азота [8], повышать фагоцитоз клеток, подвергшихся апоптозу [26], и стимулировать фагоцитоз [9, 21]. Роль SP-A во многих процессах была также доказана при использовании генетически модифицированных SP-A (-/-) нокаут мышей, у которых отсутсвует ген SP-A. Такие мыши проявляли повышенную чувствительность к ряду патогенных микроорганизмов, включая группу B Streptococcus (GBS) [15], Pseudomonas aeruginosa [16], Haemophillus influenza [17], Pneumocystis carinii [18], Klebsiella pneumonia [20].
Gardai с соавт. [6] предложили модель, согласно которой SP-A может опосредовать как про-, так и антивоспалительные процессы в лёгких в зависимости от обстоятельств. В случае, если углевод-связывающий домен (CRD, Carbohydrate Recognition Domain) белка SP-A не связан c микробными лигандами, он может взаимодействовать с рецептором SIRPα, приводя к снижению активации NF-κB, что, в конечном итоге, будет снижать продукцию про-воспалительных цитокинов и активацию альвеолярных макрофагов. В случае лёгочной инфекции, CRD домен связывается с микробными лигандами и поэтому связь CRD с SIRPα становится невозможной. Вместо этого появляется возможность связывания «коллагенового хвоста» SP-A с рецепторами калретикулин/CD91. Такое взаимодействие стимулирует активацию NF-κB, что, в конечном итоге, повышает продукцию провоспалительных цитокинов и активацию альвеолярных макрофагов. Данная модель объясняет, каким образом один и тот же белок, в данном случае белок SP-A, может оказывать как позитивный, так и негативный эффект на регуляцию воспаления в лёгких в зависимости от наличия или отсутствия лёгочной инфекции, соответственно. В то же время, показано, что SP-A всё же проявляет базовый уровень про-воспалительной активности и в отсутствии микробных лигандов [25]. Это может иметь большое физиологическое значение в поддержании имунного статуса лёгких в состоянии постоянной готовности, поскольку лёгкие находятся в постоянном контакте с бактериями, вирусами, токсинами, аллергенами и т.д., поступающими вместе с вдыхаемым воздухом.
Исследования последних лет показали, что SP-A, являясь частью системы врождённого иммунитета, способен координировать врождённый и приобретённый компоненты иммунитета посредством взаимодействия с дендритными клетками и Т-клетками, регулируя, таким образом, иммунный ответ в лёгких [24, 33]. Функция дендритных клеток в регулировании иммунного ответа зависит от уровня их «созревания». «Незрелые» дендритные клетки обладают фагоцитирующей способностью, в то время как «зрелые» дендритные клетки презентируют антиген Т-клеткам и стимулируют Т-клетки в региональных лимфатических узлах и тканях. SP-A ингибирует пролиферацию Т-клеток двумя способами:
На основании накопленных данных было предложено [33], что основной функцией SP-A в лёгких является регулирование «иммунологической среды» и предотвращение чрезмерной активации каскадов воспалительного ответа, что потенциально может привести к повреждению лёгочной ткани и, как следствие, к нарушению газообмена.
Кроме описанных выше функций, SP-A опосредует механизмы аллергических реакций в лёгких, участвуя в удалении аллергена, ингибировании связывания IgE и аллергена и освобождения гистамина, супрессии активации сенсибилизированных базофиллов, тучных клеток или эозинофиллов, супрессии пролиферации В- и Т-клеток, и модуляции иммунного ответа дендритными клетками и макрофагами [12]. В модели на мышах выявлено, что внутриносовое введение SP-A снижает эозинофилию в случае аллергического бронхолёгочного аспергиллёза [19].
SP-A человека состоит из двух генных продуктов, SP-A1 и SP-A2, структура и функция которых различна. Генетический локус SP-A человека расположен на хромосоме 10 и представлен двумя функциональными генами — sftpa1 (или SP-A1) и sftpa2 (или SP-A2), расположеными в противоположной транскрипционной ориентации [11]. Белок SP-A собирается как октадекамер, состоящий из шести тримерных субъединиц. Каждый тример SP-A человека состоит из двух молекул SP-A1 и одной молекулы SP-A2 [29]. В то же время, тримеры, состоящие только из одного SP-A варианта, также могут обладать функциональной активностью [21, 31]. «Зрелый» белок SP-A, являясь членом семейства коллектинов C-типа, состоит из четырёх доменов:
«шейка» между коллагеноподобным и углевод-узнающим доменами. Различия в амикнокислотной последовательности между вариантами SP-A1 и SP-A2 локализуются в коллагеноподобном домене.
Функциональные различия между SP-A1 и SP-A2 включают их способность стимулировать фагоцитоз [21, 22], ингибировать секрецию сурфактанта [30], стимулировать продукцию TNF-a [32], так же, как и различия в их аггрегации и олигомеризации [5, 30]. Во всех этих случаях SP-A2 обладал большей активностью, чем SP-A1. Более того, SP-A2 в большей степени, чем SP-A1, связывал углеводы [23]. Всё это указывает на то, что структурные особенности SP-A2 в большей степени, чем SP-A1, способствуют связыванию с углеводами.
Наиболее важное различие в структуре SP-A1 и SP-A2 — аминокислотная позиция 85 коллагеноподобного региона белка SP-A, где SP-A1 имеет цистеин, а SP-A2 — аргинин. Дополнительный цистеин в SP-A1 может быть вовлечён в формирование межтримерной или внутритримерной дисульфидной связи и может отвечать за различия в олигомеризации SP-A1 и SP-A2 [30]. Было показано, что замена Arg 85 на Cys 85 в SP-A2 приводит к снижению функциональной активности SP-A2 до уровня SP-A1, а замена Cys 85 на Arg 85 в SP-A1 повышает активность SP-A1 до уровня SP-A2. Таким образом, структурные различия в коллагеноподобном домене между SP-A1 и SP-A2 могут отвечать за функциональные различия между ними.
Поскольку продукты гена SP-A2 более функциональны, чем SP-A1, общая активность SP-A в лёгких может зависеть не только от общего содержания SP-A, но и от соотношения SP-A1 к SP-A2. Известно, что заболевания лёгких сопровождаются изменением как общего содержания белка SP-A в бронхоальвеолярной жидкости у различных индивидуумов [7, 10], так и соотношения SP-A1 и SP-A2 в броноальвеолярном лаваже [27]. Следовательно, нарушения экспрессии генов SP-A1 и SP-A2 могут привести к неадекватному соотношению SP-A вариантов в лёгких, что, в свою очередь, может внести вклад в неэффективное модулирование механизмов иммунной защиты в лёгких и соответственно повлиять на остроту и продолжительность инфекционных заболеваний лёгких.
Фёдорова В.А., д.м.н., зав. отделом зоо- и зооантропонозных инфекций ГНУ Саратовского НИВИ РАСХН, г. Саратов;
Заднова С.П., д.б.н., в.н.с. лаборатории патогенных вибрионов ФКУЗ «Российского НИПЧИ «Микроб», г. Саратов.
Легочный сурфактант

Легочный сурфактант — это поверхностно-активный липопротеиновый комплекс (фосфолипопротеин), образованный альвеолярными клетками II типа . Белки и липиды, составляющие поверхностно-активное вещество, имеют как гидрофильные, так и гидрофобные области. По адсорбировать на воздух-вода интерфейс в альвеолах , с гидрофильными головных групп в воде и гидрофобные хвосты , обращенной к воздуху, основной липидного компонента поверхностно -активного вещества, дипальмитоилфосфатидилхолин (DPPC), уменьшает поверхностное натяжение .
Содержание
Функция [ править ]
- Для увеличения податливости легких .
- Для предотвращения ателектаза (коллапса легкого) в конце выдоха.
- Для облегчения восстановления дыхательных путей при коллапсе.
Альвеолы можно сравнить с газом в воде, поскольку альвеолы влажные и окружают центральное воздушное пространство. Поверхностное натяжение действует на границе раздела воздух-вода и приводит к тому , пузырь меньше ( за счет уменьшения площади поверхности раздела). Давление газа ( P ), необходимое для поддержания равновесия между разрушающей силой поверхностного натяжения ( γ ) и силой расширения газа в альвеоле радиуса r , выражается законом Лапласа :
Соответствие [ править ]
Комплаенс — это способность легких и грудной клетки расширяться. Податливость легких определяется как изменение объема на единицу изменения давления в легком . Измерения объема легких, полученные во время контролируемого раздувания / сдувания нормального легкого, показывают, что объемы, полученные во время сдувания, превышают объемы, полученные во время раздувания при заданном давлении. Эта разница в объемах надувания и спуска при заданном давлении называется гистерезисом и возникает из-за поверхностного натяжения воздух-вода, которое возникает в начале надувания. Однако сурфактант снижает поверхностное натяжение альвеол , что наблюдается у недоношенных детей, страдающих респираторным дистресс-синдромом. . Нормальное поверхностное натяжение воды составляет 70 дин / см (70 мН / м), а в легких — 25 дин / см (25 мН / м); однако в конце срока годности сжатые молекулы фосфолипидов поверхностно-активного вещества снижают поверхностное натяжение до очень низких, почти нулевых уровней. Таким образом, легочный сурфактант значительно снижает поверхностное натяжение , увеличивая податливость, позволяя легким надуваться намного легче, тем самым уменьшая работу дыхания. Это уменьшает разницу давлений, необходимую для надувания легких. Податливость легких уменьшается, а вентиляция уменьшается, когда легочная ткань становится больной и фиброзной. [2]
Регулировка размера альвеол [ править ]
По мере увеличения размера альвеол поверхностно-активное вещество все больше распределяется по поверхности жидкости. Это увеличивает поверхностное натяжение, эффективно замедляя скорость расширения альвеол. Это также помогает всем альвеолам в легких расширяться с одинаковой скоростью, так как альвеолы, которые расширяются быстрее, будут испытывать сильное повышение поверхностного натяжения, замедляющее скорость расширения. Это также означает, что скорость сокращения становится более равномерной, так как при более быстром уменьшении размера поверхностное натяжение уменьшится больше, поэтому другие альвеолы могут сокращаться легче, чем это возможно. Поверхностно-активное вещество снижает поверхностное натяжение легче, когда альвеолы меньше, поскольку поверхностно-активное вещество более концентрировано.
Предотвращение скопления жидкости и поддержание сухости дыхательных путей [ править ]
Поверхностное натяжение вытягивает жидкость из капилляров в альвеолярные пространства. Поверхностно-активное вещество уменьшает скопление жидкости и сохраняет дыхательные пути сухими за счет снижения поверхностного натяжения. [3]
Врожденный иммунитет [ править ]
Иммунная функция сурфактанта в первую очередь связана с двумя белками: SP-A и SP-D . Эти белки могут связываться с сахарами на поверхности патогенов и тем самым опсонизировать их для поглощения фагоцитами. Он также регулирует воспалительные реакции и взаимодействует с адаптивным иммунным ответом. Разложение или инактивация поверхностно-активного вещества может способствовать повышению восприимчивости к воспалению и инфекции легких. [4]
Состав [ править ]
- ~ 40% дипальмитоилфосфатидилхолина (DPPC); [5]
- ~ 40% другие фосфолипиды (ПК); [5]
- ~ 10% поверхностно-активных белков ( SP-A , SP-B , SP-C и SP-D ); [5]
- ~ 10% нейтральных липидов ( холестерина ); [5]
- Следы других веществ .
Липиды [ править ]
DPPC [ править ]
Дипальмитоилфосфатидилхолин (DPPC) представляет собой фосфолипид с двумя 16-углеродными насыщенными цепями и фосфатной группой с присоединенной четвертичной аминогруппой. DPPC — самая сильная молекула сурфактанта в смеси легочных сурфактантов. Он также имеет более высокую способность к уплотнению, чем другие фосфолипиды, потому что аполярный хвост менее изогнут. Тем не менее, без других веществ смеси легочных сурфактантов кинетика адсорбции DPPC очень медленная. Это происходит прежде всего потому, что температура фазового перехода между гелем и жидким кристаллом чистого DPPC составляет 41,5 ° C, что выше, чем температура человеческого тела, равная 37 ° C. [6]
Другие фосфолипиды [ править ]
Молекулы фосфатидилхолина составляют ~ 85% липидов в поверхностно-активном веществе и имеют насыщенные ацильные цепи. Фосфатидилглицерин (PG) образует около 11% липидов в поверхностно-активном веществе, он имеет цепи ненасыщенных жирных кислот, которые псевдоожижают липидный монослой на границе раздела. Также присутствуют нейтральные липиды и холестерин. Компоненты этих липидов диффундируют из крови в альвеолярные клетки типа II, где они собираются и упаковываются для секреции в секреторные органеллы, называемые ламеллярными телами . [ необходима цитата ]
Белки [ править ]
Белки составляют оставшиеся 10% поверхностно-активного вещества. Половина из этих 10% составляют белки плазмы, а остальная часть образована аполипопротеинами , поверхностно-активными белками SP-A, SP-B, SP-C и SP-D. Аполипопротеины продуцируются секреторным путем в клетках типа II. Они претерпевают много посттрансляционных модификаций, попадая в ламеллярные тела. Это концентрические кольца липида и белка диаметром около 1 мкм.
-
и СП-Д — коллекционны . Они наделяют врожденный иммунитет, поскольку у них есть домены распознавания углеводов, которые позволяют им покрывать бактерии и вирусы, способствующие фагоцитозу макрофагами. [7] Также считается, что SP-A участвует в механизме отрицательной обратной связи, контролирующем выработку поверхностно-активного вещества. [ необходима цитата ] и SP-C — это гидрофобные мембранные белки, которые увеличивают скорость распространения поверхностно-активного вещества по поверхности. SP-B и SP-C необходимы для правильной биофизической функции легких. Люди и животные, рожденные с врожденным отсутствием SP-B семейства сапозинов, страдают трудноизлечимой дыхательной недостаточностью, тогда как у рожденных с отсутствием SP-C обычно развивается прогрессирующий интерстициальный пневмонит. [8]
Белки SP снижают критическую температуру фазового перехода DPPC до значения ниже 37 ° C [9], что улучшает его адсорбцию и скорость распространения поверхности раздела. [10] [11] Сжатие границы раздела вызывает фазовый переход молекул поверхностно-активного вещества в жидкость-гель или даже гель-твердое тело. Высокая скорость адсорбции необходима для поддержания целостности области газообмена в легких.
Каждый белок SP имеет различные функции, которые действуют синергетически, чтобы поддерживать интерфейс, богатый DPPC, во время расширения и сокращения легких. Изменения в составе смеси поверхностно-активных веществ изменяют условия давления и температуры для фазовых превращений, а также форму кристаллов фосфолипидов. [12] Только жидкая фаза может свободно растекаться по поверхности с образованием монослоя. Тем не менее, было замечено, что если область легких резко расширяется, плавающие кристаллы трескаются, как « айсберги». «. Затем белки SP избирательно привлекают больше DPPC к границе раздела, чем другие фосфолипиды или холестерин, поверхностно-активные свойства которых хуже, чем у DPPC. SP также закрепляет DPPC на границе раздела, чтобы предотвратить выдавливание DPPC при уменьшении площади поверхности [ 11] Это также снижает сжимаемость интерфейса. [13]
Искусственные поверхностно-активные вещества [ править ]
Доступен ряд типов легочных сурфактантов.
Синтетические легочные сурфактанты
-
(Exosurf) — смесь DPPC с гексадеканолом и тилоксаполом, добавленными в качестве агентов для распределения. (искусственное соединение, расширяющее легкие или ALEC) — смесь DPPC и PG — состоит из DPPC, пальмитоил-олеоилфосфатидилглицерина и пальмитиновой кислоты в сочетании с синтетическим пептидом из 21 аминокислоты, который имитирует структурные характеристики SP-B. — DPPC, PG, пальмитиновая кислота и рекомбинантный SP-C — DPPC , POPG и пальмитиновая кислота .
Поверхностно-активные вещества животного происхождения
- (Альвеофакт) — извлекается из жидкости лаважа легких коров.
- (Сурванта) — экстрагируется из измельченного легкого коровы с дополнительным DPPC, пальмитиновой кислотой и трипальмитином.
- (Beraksurf) — извлеченный из измельченного легкого теленка с дополнительным DPPC, пальмитиновой кислотой и трипальмитином
Величина поверхностного натяжения внутри легкого [ править ]
Несмотря на то, что поверхностное натяжение может быть значительно уменьшено легочным сурфактантом, этот эффект будет зависеть от концентрации сурфактанта на границе раздела. Концентрация на границе раздела имеет предел насыщения, который зависит от температуры и состава смеси. Поскольку во время вентиляции происходит изменение площади поверхности легких, концентрация поверхностно-активного вещества обычно не находится на уровне насыщения. Поверхность увеличивается во время вдоха, что, следовательно, открывает пространство для новых молекул поверхностно-активного вещества, которые могут быть привлечены к границе раздела. Между тем, по истечении срока действия площадь поверхности уменьшается, слой поверхностно-активного вещества сжимается, приближая молекулы поверхностно-активного вещества друг к другу и дополнительно уменьшая поверхностное натяжение. [ необходима цитата ]
Молекулы SP способствуют увеличению кинетики адсорбции на границе раздела поверхностно-активных веществ, когда концентрация ниже уровня насыщения . Они также создают слабые связи с молекулами поверхностно-активного вещества на границе раздела и удерживают их дольше, когда поверхность раздела сжата. Поэтому во время вентиляции поверхностное натяжение обычно ниже, чем в состоянии равновесия. Таким образом, поверхностное натяжение изменяется в зависимости от объема воздуха в легких, который защищает их от ателектаза при малых объемах и повреждения тканей при высоких уровнях объема. [10] [12] [13]
| Условие | Напряжение (мН / м) |
|---|---|
| Вода при 25 ° C | 70 |
| Легочный сурфактант в равновесии при 36 ° C | 25 |
| Здоровое легкое при 100% ТСХ | 30 |
| Здоровое легкое между 40 и 60% TLC | 1 ~ 6 |
| Здоровое легкое ниже 40% TLC |
Производство и деградация [ править ]
Производство поверхностно-активного вещества у человека начинается в клетках типа II на стадии развития альвеолярного мешка . Пластинчатые тела появляются в цитоплазме примерно на 20 неделе беременности. [ необходима цитата ] Эти ламеллярные тела секретируются путем экзоцитоза в поверхностный слой воды, выстилающий альвеолярное воздушное пространство, где поверхностно-активное вещество образует сеть трубчатого миелина . У доношенных детей запас сурфактанта в альвеолярных отростках составляет приблизительно 100 мг / кг, а у недоношенных новорожденных — 4–5 мг / кг при рождении. [ необходима цитата ]
Клетки клуба также производят компонент сурфактанта легких. [14]
Период полураспада альвеолярного сурфактанта составляет от 5 до 10 часов после выделения. Он может расщепляться макрофагами и / или реабсорбироваться в пластинчатые структуры пневмоцитов II типа. До 90% сурфактанта DPPC (дипальмитоилфосфатидилхолина) рециркулируется из альвеолярного пространства обратно в пневмоциты II типа. Считается, что этот процесс происходит через SP-A- стимулирующий рецептор-опосредованный клатрин- зависимый эндоцитоз . [15] Остальные 10% поглощаются альвеолярными макрофагами и перевариваются.
Заболевания [ править ]
-
(IRDS) вызван недостатком сурфактанта, которым обычно страдают недоношенные дети, рожденные до 28–32 недель беременности. [ необходима цитата ]
История [ править ]
В конце 1920-х фон Нергаард [16] идентифицировал функцию легочного сурфактанта в повышении эластичности легких за счет снижения поверхностного натяжения. Однако значение его открытия не было осознано научным и медицинским сообществом в то время. Он также осознал важность низкого поверхностного натяжения легких новорожденных. Позже, в середине 1950-х годов, Паттл и Клементс заново открыли важность поверхностно-активного вещества и низкого поверхностного натяжения в легких. В конце того же десятилетия было обнаружено, что недостаток сурфактанта вызывает респираторный дистресс-синдром у младенцев (IRDS). [17] [12]