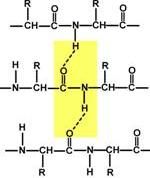
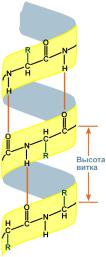
Связи, участвующие в формировании третичной структуры белков
При укладке полипептидная цепь белка стремится принять энергетически выгодную форму, характеризующуюся минимумом свободной энергии. Поэтому гидрофобные радикалы аминокислот стремятся к объединению внутри глобулярной структуры растворимых в воде белков. Между ними возникают так называемые гидрофобные взаимодействия, а также силы ван дер Ваальса между близко прилегающими друг к другу атомами. В результате внутри белковой глобулы формируется гидрофобное ядро. Гидрофильные группы пептидного остова при формировании вторичной структуры образуют множество водородных связей, благодаря чему исключается связывание с ними воды и разрушение внутренней, плотной структуры белка.
Ионные и водородные связи. Гидрофильные радикалы аминокислот стремятся образовать водородные связи с водой и поэтому в основном располагаются на поверхности белковой молекулы.
Все гидрофильные группы радикалов аминокислот, оказавшиеся внутри гидрофобного ядра, взаимодействуют друг с другом с помощью ионных и водородных связей.
Ионные связи могут возникать между отрицательно заряженными (анионными) карбоксильными группами радикалов аспарагиновой и глутаминовой кислот и положительно заряженными (катионными) группами радикалов лизина, аргинина или гистидина.
Водородные связи возникают между гидрофильными незаряженными группами (такими как -ОН, -CONH2, SH-группы) и любыми другими гидрофильными группами. Белки, функционирующие в неполярном (липидном) окружении, например белки мембран, имеют обратное устройство: гидрофильные радикалы аминокислот расположены внутри белка, в то время как гидрофобные аминокислоты локализованы на поверхности молекулы и контактируют с неполярным окружением. В каждом случае радикалы аминокислот занимают наиболее выгодное биоэнергетическое положение.
Ковалентные связи. Третичную структуру некоторых белков стабилизируют дисульфидные связи, образующиеся за счёт взаимодействия SH-групп двух остатков цистеина. Эти два остатка цистеина могут находиться далеко друг от друга в линейной первичной структуре белка, но при формировании третичной структуры они сближаются и образуют прочное ковалентное связывание радикалов.
Большинство внутриклеточных белков лишено дисульфидных связей. Однако такие связи распространены в белках, секретируемых клеткой во внеклеточное пространство. Полагают, что эти ковалентные связи стабилизируют кон-формацию белков вне клетки и предотвращают их денатурацию. К таким белкам относят гормон инсулин и иммуноглобулины.
Все белки с одинаковой первичной структурой, находящиеся в одинаковых условиях, приобретают одинаковую, характерную для данного индивидуального белка конформацию, определяющую его специфическую функцию. Функционально активную конформацию белка называют «нативная структура».
Супервторичная структура белков
Супервторичная структура формируется за счёт межрадикальных взаимодействий.
Определённые характерные сочетания α-спиралей и β-структур часто обозначают как «структурные мотивы». Они имеют специфические названия: «α-спираль-поворот- α-спираль», «структура β-бочонка», «лейциновая застёжка-молния», «цинковый палец» и др. Специфическое пространственное расположение α-спиралей и β-структур формируется за счёт межрадикальных взаимодействий.
1. Супервторичная структура типа β-бочонка. Такая структура действительно напоминает бочонок, где каждая β-структура расположена внутри и связана с α-спиральным участком полипептидной цепи, находящимся на поверхности молекулы.
Супервторичную структуру в виде β-бочонка имеют некоторые ферменты, например триозо-фосфатизомераза и один домен пируваткиназы.
2. Структурный мотив «α-спираль-поворот-α-спиралъ». Этот «структурный мотив» обнаружен во многих ДНК-связывающих белках. Двухспиральная структура ДНК имеет две бороздки — большую и малую. Большая бороздка хорошо приспособлена для связывания белков, имеющих небольшие спиральные участки. В данный структурный мотив входят две α-спирали: одна более короткая, другая более длинная, которые соединены поворотом полипептидной цепи. Более короткая α-спираль располагается поперёк бороздки, а более длинная α-спираль — в большой бороздке, образуя нековалентные специфические связи радикалов аминокислот с нуклеотидами ДНК.
3. Супервторичная структура в виде «цинкового пальца». Этот вид супервторичной структуры также часто отмечают в ДНК-связывающих белках. «Цинковый палец» — фрагмент белка, содержащий около 20 аминокислотных остатков, в котором атом цинка связан с радикалами четырёх аминокислот: обычно с двумя остатками цистеина и двумя — гистидина. В некоторых случаях вместо остатков гистидина также находятся остатки цистеина.
Два близко лежащих остатка цистеина отделены от двух других остатков гистидина (или цистеина) аминокислотной последовательностью, состоящей примерно из 12 аминокислотных остатков. Этот участок белка образует α-спираль, которая может специфично связываться с регуляторными участками большой бороздки ДНК. Специфичность взаимодействия ДНК-связывающего белка с определённой областью ДНК зависит от последовательности аминокислотных остатков, расположенных в области «цинкового пальца».
4. Супервторичная структура в виде «лейциновой застёжки-молнии». Некоторые ДНК-связывающие белки олигомерны, т.е. содержат в своём составе несколько полипептидных цепей. Кроме того, существуют белки, которые функционируют в комплексе с другими белками. Объединение протомеров или отдельных белков в комплексы иногда осуществляется с помощью структурных мотивов, называемых «лейциновая застёжка-молния». На поверхности каждой из 2х взаимодействующих полипептидных цепей или белков имеется α-спиральный участок, содержащий по крайней мере 4 остатка лейцина. Лейциновые остатки располагаются через каждые 6 аминокислот один от другого. Так как каждый виток α-спирали содержит 3,6 аминокислотных остатка, радикалы лейцина находятся на поверхности каждого второго витка.
Лейциновые остатки α-спирали одного белка могут взаимодействовать с лейциновыми остатками другого белка с помощью гидрофобных взаимодействий, соединяя их вместе.
Примером соединения белков с помощью «лейциновой застёжки-молнии» могут служить гистоны. Гистоны — ядерные белки, в состав которых входит большое количество положительно заряженных аминокислот — аргинина и лизина. Молекулы гистонов объединяются в комплексы, состоящие из 8 мономерных белков с помощью «лейциновых застёжек», несмотря на то, что все мономеры имеют сильный положительный заряд.
Доменная структура белков. Если полипептидная цепь белка содержит более 200 аминокислот, как правило, её пространственная структура сформирована в виде двух или более доменов. Домен — участок полипептидной цепи, который в процессе формирования пространственной структуры приобрёл независимо от других участков той же цепи конформацию глобулярного белка. Так, лёгкая цепь иммуноглобулина G состоит из двух доменов. В некоторых случаях доменами называют отдельные структурные участки полипептидной цепи.
Домены обычно можно выделить, действуя на белок протеолитическими ферментами, легко разрывающими пептидные связи на участке полипептидной цепи, расположенной между доменами. После этого некоторые домены могут сохранять свои биологические свойства.
Структура и функциональная роль шаперонов в фолдинге белков. В процессе синтеза полипептидных цепей, транспорта их через мембраны, при сборке олигомерных белков возникают промежуточные нестабильные конформации, склонные к агрегации. На вновь синтезированном полипептиде имеется множество гидрофобных радикалов, которые в трёхмерной структуре спрятаны внутри молекулы. Поэтому на время формирования нативной конформации реакционно-способные аминокислотные остатки одних белков должны быть отделены от таких же групп других белков.
Во всех известных организмах от прокариотов до высших эукариотов обнаружены белки, способные связываться с белками, находящимися в неустойчивом, склонном к агрегации состоянии. Они способны стабилизировать их конформацию, обеспечивая фолдинг белков. Эти белки получили название «шапероны».
Классификации шаперонов (Ш)
В соответствии с молекулярной массой все шапероны можно разделить на 6 основных групп:
высокомолекулярные, с молекулярной массой от 100 до 110 кД;
Ш-90 — с молекулярной массой от 83 до 90 кД;
Ш-70 — с молекулярной массой от 66 до 78 кД;
низкомолекулярные шапероны с молекулярной массой от 15 до 30 кД.
Среди шаперонов различают: конститутивные белки (высокий базальный синтез которых не зависит от стрессовых воздействий на клетки организма), и индуцибельные, синтез которых в нормальных условиях идёт слабо, но при стрессовых воздействиях на клетку резко увеличивается. Индуцибельные шапероны относят к «белкам теплового шока», быстрый синтез которых отмечают практически во всех клетках, которые подвергаются любым стрессовым воздействиям. Название «белки теплового шока» возникло в результате того, что впервые эти белки были обнаружены в клетках, которые подвергались воздействию высокой температуры.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ — конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.


Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
© cyberpedia.su 2017-2020 — Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!
Г. Супервторичная структура белков
Пространственная структура каждого белка индивидуальна и определяется его первичной структурой. Однако сравнение конформаций разных по структуре и функциям белков выявило наличие у них похожих сочетаний элементов вторичной структуры. Такой специфический порядок формирования вторичных структур называют супервторичной структурой белков. Супервторичная структура формируется за счёт межрадикальных взаимодействий.
Определённые характерные сочетания а-спиралей и β-структур часто обозначают как «структурные мотивы». Они имеют специфические названия: «α-спираль—поворот—α-спираль», «структура β-бочонка», «лейциновая застёжка-молния», «цинковый палец» и др. Специфическое пространственное расположение а-спиралей и β-струкгур формируется за счёт межрадикальных взаимодействий.
1. Супервторичная структура типа β-бочонка
Такая структура действительно напоминает бочонок, где каждая β-структура (обозначенная на рис. 1-16 стрелкой) расположена внутри и связана с α-спиральным участком полипептидной цепи, находящимся на поверхности молекулы.
Супервторичную структуру в виде β-бочонка имеют некоторые ферменты, например триозофосфатизомераза и один домен пируваткиназы (рис. 1-16).

Рис. 1-16. Супервторичная структура в виде β-бочонка. А — триозофосфатизомераза; Б — домен пируваткиназы
2. Структурный мотив «α-спираль— поворот —α-спираль»
Этот «структурный мотив» обнаружен во многих ДНК-связывающих белках. Двухспиральная структура ДНК имеет две бороздки — большую и малую. Большая бороздка хорошо приспособлена для связывания белков, имеющих небольшие спиральные участки.
В данный структурный мотив входят две α-спирали: одна более короткая, другая более длинная, которые соединены поворотом полипептидной цепи. Более короткая α-спираль располагается поперёк бороздки, а более длинная α-спираль — в большой бороздке, образуя нековалентные специфические связи радикалов аминокислот с нуклеотидами ДНК (рис. 1-17).

Рис. 1-17. Связывание супервторичной структуры «α-спиральповорот-α-спираль» ДНК-связывающего белка в большой бороздке ДНК
3. Супервторичная структура в виде «цинкового пальца»
Этот вид супервторичной структуры также часто отмечают в ДНК-связывающих белках. «Цинковый палец» — фрагмент белка, содержащий около 20 аминокислотных остатков, в котором атом цинка связан с радикалами четырёх аминокислот: обычно с двумя остатками цистеина и двумя — гистидина. В некоторых случаях вместо остатков гистидина также находятся остатки цистеина (рис. 1-18).

Рис. 1-18. Фрагмент ДНК-связывающего белка в форме «цинкового пальца»
Два близко лежащих остатка цистеина отделены от двух других остатков гистидина (или цистеина) аминокислотной последовательностью, состоящей примерно из 12 аминокислотных остатков. Этот участок белка образует а-спираль, которая может специфично связываться с регуляторными участками большой бороздки ДНК. Специфичность взаимодействия ДНК-связывающего белка с определённой областью ДНК зависит от последовательности аминокислотных остатков, расположенных в области «цинкового пальца».
4. Супервторичная структура в виде «лещиновой застёжки-молнии»
Некоторые ДНК-связывающие белки олиго-мерны, т.е. содержат в своём составе несколько полипептидных цепей. Кроме того, существуют белки, которые функционируют в комплексе с другими белками. Объединение протомеров или отдельных белков в комплексы иногда осуществляется с помощью структурных мотивов, называемых «лейциновая застёжка-молния».
На поверхности каждой из двух взаимодействующих полипептидных цепей или белков имеется α-спиральный участок, содержащий по крайней мере 4 остатка лейцина. Лейциновые остатки располагаются через каждые 6 аминокислот один от другого. Так как каждый виток а-спирали содержит 3,6 аминокислотных остатка, радикалы лейцина находятся на поверхности каждого второго витка.
Лейциновые остатки α-спирали одного белка могут взаимодействовать с лейциновыми остатками другого белка с помощью гидрофобных взаимодействий, соединяя их вместе (рис. 1-19).

Рис. 1-19. «Лейциновая застёжка-молния» между α-спиральными участками двух белков
Примером соединения белков с помощью «лейциновой застёжки-молнии» могут служить гистоны. Гистоны — ядерные белки, в состав которых входит большое количество положительно заряженных аминокислот — аргинина и лизина. Молекулы гистонов объединяются в комплексы, состоящие из 8 мономерных белков с помощью «лейциновых застёжек», несмотря на то, что все мономеры имеют сильный положительный заряд.
Что такое супервторичная структура белка
2. Белки, выполняющие разные функции, имеют разные последовательности.
3. Белки со схожими функциями имеют похожие последовательности, однако совпадение последовательности проявляется обычно лишь в малой степени.
4. Одинаковые белки, выполняющие одинаковые функции, но выделенные из разных организмов, обычно имеют значительное сходство в последовательности.
5. Одинаковые белки, выполняющие одинаковые функции и выделенные из организмов одного вида, почти всегда обладают совершенно одинаковой последовательностью.
Высшие уровни структуры белков, их биологическая активность тесно связаны и фактически определяются аминокислотной последовательностью. То есть, первичная структура генетически детерминирована и определяет индивидуальные свойства белков, их видовую специфичность, на ее основе формируются все последующие структуры.
Вторичная структура белка – конфигурация полипептидной цепи, образующаяся в результате взаимодействий между её функциональными группами.
Разновидности вторичной структуры:
2. Складчатый лист (β-структура).
3. Статистический клубок.
Первые две разновидности представляют собой упорядоченное расположение, третья – неупорядоченное.
Сравнение конформаций разных по структуре и функциям белков выявило наличие у них похожих сочетаний элементов вторичной структуры. Такой специфический порядок формирования вторичных структур называют супервторичной структурой. Супервторичная структура формируется за счет межрадикальных взаимодействий.
Разновидности супервторичной структуры белков:
1. Супервторичная структура типа β-бочонка. Она действительно напоминает бочонок, где каждая β-структура расположена внутри и связана α-спиральным участком цепи, находящимся на поверхности. Характерна для некоторых ферментов – триозофосфатизомеразы, пируваткиназы.
2. Структурный мотив «α-спираль – поворот – α-спираль». Обнаружен во многих ДНК-связывающих белках.
3. Супервторичная структура в виде «цинкового пальца». Характерна также для ДНК-связывающих белков. «Цинковый палец» – фрагмент белка, содержащий около 20 аминокислот, в котором атом цинка связан с радикалами четырех аминокислот: обычно с двумя остатками цистеина и двумя – гистидина.
4. Супервторичная структура в виде «лейциновой застежки-молнии». Объединение протомеров или отдельных белков в комплексы иногда осуществляется с помощью структурных мотивов, называемых «лейциновая застежка-молния». Примером такого соединения белков могут служить гистоны. Это ядерные белки, в состав которых входит большое количество положительно заряженных аминокислот – аргинина и лизина. Молекулы гистонов объединяются в комплексы с помощью «лейциновых застежек», несмотря на то, что все мономеры имеют сильный положительный заряд.
Содержание типов вторичных структур в разных белках неодинаково.
По наличию α-спиралей и β-структур глобулярные белки можно разделить на 4 категории:
1. К первой категории относятся белки, в структуре которых обнаружена только α-спираль. Это миоглобин, гемоглобин.
2. Ко второй категории относят белки с α-спиралями и β-структурами. Характерные сочетания α-спиралей и β-структур обнаружены во многих ферментах: лактатдегидрогеназа, фосфоглицераткиназа.
3. В третью категорию включены белки, имеющие только β-структуру. Сюда относятся: иммуноглобулины, фермент супероксиддисмутаза.
4. В четвертую категорию включены белки, имеющие в своем составе лишь незначительное количество регулярных вторичных структур.
Третичная структура белка – пространственная ориентация полипептидной цепи или способ ее укладки в определенном объеме.
В зависимости от формы третичной структуры различают глобулярные и фибриллярные белки. В глобулярных белках чаще преобладает α-спираль, фибриллярные белки образуются на основе β-структуры.
В стабилизации третичной структуры глобулярного белка могут принимать участие:
1. водородные связи спиральной структуры;
2. водородные связи β-структуры;
3. водородные связи между радикалами боковых цепей;
4. гидрофобные взаимодействия между неполярными группами;
5. электростатические взаимодействия между противоположно заряженными группами;
Конформация петидных цепей в белках (вторичная структура). Типы химических связей, участвующих в формировании вторичной структуры. Супервторичные структуры.
Вторичная структура — это пространственное расположение полипептидной цепочки в виде α-спирали или β-складчатости безотносительно к типам боковых радикалов и их конформации. Она стабилизирована водородными связями, которые замыкаются между пептидными, амидными (-N-H) и карбонидными (-C=O)группами, т.е. входят в пептидную единицу, и дисульфидными мостиками между остатками цистеина
Полинг и Кори предложили модель вторичной структуры белка в виде левозакрученной α-спирали, в которой водородные связи замыкаются между каждой первой и четвертой аминокислотой, что позволяет сохранять нативную структуру белка, осуществление им простейших функций, защищать от разрушения. На один виток спирали приходится 3,6 аминокислотных остатка, шаг спирали составляет 0,54 нм. В образовании водородных связей принимают участие все пептидные группы, что обеспечивает максимальную стабильность, снижает гидрофильность и увеличивает гидрофобность белковой молекулы. Альфа-спираль образуется самопроизвольно и является наиболее устойчивой конформацией, отвечающей минимуму свободной энергии .
Полинг и Кори предложили и другую упорядоченную структуру — складчатый β- слой. В отличие от конденсированной α-спирали β- слои почти полностью вытянуты и могут располагаться как параллельно , так и антипараллельно
В стабилизации данных структур также принимают участие дисульфидные мостики и водородные связи.
Супервторичная структура — это более высокий уровень организации белковой молекулы, представленный ансамблем взаимодействующих между собой вторичных структур
Некоторый специфический порядок чередования вторичных структур наблюдается во многих разных по структуре и функциям белках и носит название супервторичной структуры.
Такие упорядоченные структуры часто обозначают как структурные мотивы,которые имеют специфические названия: «а-спираль—поворот—а-спи-раль», «лейциновая застежка-молния», «цинковые пальцы», «структура Р-бочонка» и др.
По наличию а-спиралей и b-структур глобулярные белки могут быть разделены на 4 категории:
1.В первую категорию включены белки, в которых имеются только а-спирали, например миоглобин и гемоглобин .
2. Во вторую категорию включены белки, в которых имеются а-спирали и b-структуры. ЛДГ.
3. В третью категорию включены белки, имеющие только вторичную b-структуру. Такие структуры обнаружены в иммуноглобулинах, в ферменте супероксиддисмутазе
4. В четвертую категорию включены белки, имеющие в своем составе лишь незначительное количество регулярных вторичных структур. К таким белкам можно отнести небольшие богатые цистином белки или металлопротеины.
В ДНК-связывающих белках имеются общие виды супервторичных структур: «спираль—поворот—спираль», «лейциновая застежка-молния», «цинковые пальцы».ДНК-связывающие белки содержат центр связывания, комплементарный участку ДНК с определенной нуклеотидной последовательностью. Эти белки участвуют в регуляции действия генов.
«а- Спираль—поворот—а-спираль»
Двуспиральная структура ДНК имеет 2 бороздки: большую и малую. Большая бороздка хорошо приспособлена для связывания белков, имеющих небольшие спиральные участки.
В данный структурный мотив входят 2 ос-спирали: одна более короткая, другая более длинная, соединенные поворотом полипептидной цепи.
Более короткая а-спираль располагается поперек бороздки ДНК, а более длинная а-спираль находится в большой бороздке, образуя нековалентные специфические связи радикалов аминокислот с нуклеотидами ДНК.
Цинковый палец»
«Цинковый палец» — фрагмент белка, содержащий около 20 аминокислотных остатков.
Атом цинка связан с радикалами 4 аминокислот: 2 остатков цистеина и 2 — гистидина.
В некоторых случаях вместо остатков гистидина находятся остатки цистеина.
Этот участок белка образует а-спираль, которая может специфично связываться с регуляторными участками большой бороздки ДНК.
Специфичность связывания индивидуального регуляторного ДНК-связывающего белка зависит от последовательности аминокислотных остатков, расположенных в области «цинкового пальца».
«Лейциновая застежка-молния»
Взаимодействующие белки имеют а-спиральный участок, содержащий по крайней мере 4 остатка лейцина.
Лейциновые остатки расположены через 6 аминокислот один от другого.
Так как каждый виток а-спирали содержит 3,6-аминокислотного остатка, радикалы лейцина находятся на поверхности каждого второго витка.
Лейциновые остатки а-спирали одного белка могут взаимодействовать с лейциновыми остатками другого белка (гидрофобные взаимодействия), соединяя их вместе .
Многие ДНК-связывающие белки взаимодействуют с ДНК в виде олигомерных структур, где субъединицы связываются друг с другом «лейциновыми застежками». Примером таких белков могут служить гистоны.
Гистоны— ядерные белки, в состав которых входит большое количество положительно заряженных аминокислот — аргинина и лизина (до 80%).
Молекулы гистонов объединяются в олигомерные комплексы, содержащие 8 мономеров с помощью «лейциновых застежек», несмотря на сильный положительный заряд этих молекул.
Конформация петидных цепей в белках (третичная структура). Типы химических связей, участвующих в формировании третичной структуры. Доменная структура и ее роль в функционировании белков. Роль шаперонов (белки теплового шока) в формировании третичной структуры белков in vivo.
У большинства белков полипептидные цепи свернуты особым образом в компактную глобулу. Способ свертывания полипептидных цепей глобулярных белков называется третичной структурой. Третичная структура поддерживается уже обсуждавшимися выше связями трех типов — ионными, водородными и дисульфидными, а также гидрофобными взаимодействиями. В количественном отношении наиболее важны именно гидрофобные взаимодействия; белок при этом свертывается таким образом, чтобы его гидрофобные боковые цепи были скрыты внутри молекулы, а гидрофильные, наоборот, выставлены наружу
ДОМЕННАЯ СТРУКТУРА И ЕЕ РОЛЬ В ФУНКЦИОНИРОВАНИИ БЕЛКОВ
1. Длинные полипептидные цепи часто складываются в несколько компактных, относительно независимых областей. Они имеют самостоятельную третичную структуру, напоминающую таковую глобулярных белков, и называются доменами.
Благодаря доменной структуре белков легче формируется их трехмерная структура.
2. Центры связывания белка с лигандом часто располагаются между доменами (например, центр связывания трипсина с его лигандом — пищевым белком). Разные домены в белке могут перемещаться относительно друг друга при взаимодействии с лигандом (например, в молекуле гексокиназы).
В некоторых белках домены выполняют самостоятельные функции, связываясь с различными лигандами. Такие белки называются многофункциональными белками.
Правильное сворачивание (фолдинг ) полипептидных цепей белков в клетках эукариот обеспечивается специфическими белками, называемыми шаперонами (chaperone). Шапероны необходимы для эффективного формирования третичной структуры полипептидных цепей других белков, но они не входят в состав конечной белковой структуры.
Новосинтезированные белки после выхода с рибосом для правильного функционирования должны укладываться в стабильные трехмерные структуры и оставаться такими на протяжении всей функциональной жизни клетки. Поддержание контроля качества структуры белка и осуществляется шаперонами, катализирующими укладку полипептидов. Сборка полипротеинов и укладка мультибелковых комплексов также осуществляется шаперонами. Шапероны связываются с гидрофобными участками неправильно уложенных белков, помогают им свернуться и достигнуть стабильной нативной структуры и, тем самым, предотвращают их включение в нерастворимые и нефункциональные агрегаты. В течение своей функциональной жизни белок может подвергаться различным стрессам и денатурации. Такие частично денатурированные белки могут стать, во-первых, мишенью протеаз, во-вторых, агрегировать и, в-третьих, укладываться в нативную структуру с помощью шаперонов. Баланс и эффективность, с которой происходят эти три процесса, определяются соотношением компонентов, участвующих в этих реакциях
Активный центр белков и его специфическое взаимодействие с лигандом как основа биологической функции белков. Комплементарность взаимодействующих белков с лигандом. Обратимость связывания.
Активный центр белков — определённый участок белковой молекулы, как правило, находящийся в её углублении («кармане»), сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга.
Высокая специфичность связывания белка с лигандом обеспечивается комплементарностью структуры активного центра белка структуре лиганда
Под комплементарностью понимают пространственное и химическое соответствие взаимодействующих молекул. Лиганд должен обладать способностью входить и пространственно совпадать с конформацией активного центра. Это совпадение может быть неполным, но благодаря конформационной лабильности белка активный центр способен к небольшим изменениям и «подгоняется» под лиганд. Кроме того, между функциональными группами лиганда и радикалами аминокислот, образующих активный центр, должны возникать связи, удерживающие лиганд в активном центре. Связи между лигандом и активным центром белка могут быть как нековалентными (ионными, водородными, гидрофобными), так и ковалентными.
1. Характеристика активного центра
Активный центр белка — относительно изолированный от окружающей белок среды участок, сформированный аминокислотными остатками. В этом участке каждый остаток благодаря своему индивидуальному размеру и функциональным группам формирует «рельеф» активного центра.
Объединение таких аминокислот в единый функциональный комплекс изменяет реакционную способность их радикалов, подобно тому, как меняется звучание музыкального инструмента в ансамбле. Поэтому аминокислотные остатки, входящие в состав активного центра, часто называют «ансамблем» аминокислот.
Уникальные свойства активного центра зависят не только от химических свойств формирующих его аминокислот, но и от их точной взаимной ориентации в пространстве. Поэтому даже незначительные нарушения общей конформации белка в результате точечных изменений его первичной структуры или условий окружающей среды могут привести к изменению химических и функциональных свойств радикалов, формирующих активный центр, нарушать связывание белка с лигандом и его функцию. При денатурации активный центр белков разрушается, и происходит утрата их биологической активности.
Часто активный центр формируется таким образом, что доступ воды к функциональным группам его радикалов ограничен, т.е. создаются условия для связывания лиганда с радикалами аминокислот.
В некоторых случаях лиганд присоединяется только к одному из атомов, обладающему определённой реакционной способностью, например присоединение О2 к железу миоглобина или гемоглобина. Однако свойства данного атома избирательно взаимодействовать с О2 определяются свойствами радикалов, окружающих атом железа в составе тема. Гем содержится и в других белках, таких как цитохромы. Однако функция атома железа в цитохромах иная, он служит посредником для передачи электронов от одного вещества другому, при этом железо становится то двух-, то трёхвалентным.
Основное свойство белков, лежащее в основе их функций, — избирательность присоединения к определённым участкам белковой молекулы специфических лигандов.
2. Многообразие лигандов
- Лигандами могут быть неорганические (часто ионы металлов) и органические вещества, низкомолекулярные и высокомолекулярные вещества;
- существуют лиганды, которые изменяют свою химическую структуру при присоединении к активному центру белка (изменения субстрата в активном центре фермента);
- существуют лиганды, присоединяющиеся к белку только в момент функционирования (например, О2, транспортируемый гемоглобином), и лиганды, постоянно связанные с белком, выполняющие вспомогательную роль при функционировании белков (например, железо, входящее в состав гемоглобина).
В тех случаях, когда аминокислотные остатки, формирующие активный центр, не могут обеспечить функционирование данного белка, к определённым участкам активного центра могут присоединяться небелковые молекулы. Так, в активном центре многих ферментов присутствует ион металла (кофактор) или органическая небелковая молекула (кофермент). Небелковую часть, прочно связанную с активным центром белка и необходимую для его функционирования, называют «простатическая группа». Миоглобин, гемоглобин и цитохромы имеют в активном центре простетическую группу — гем, содержащий железо .
Соединение протомеров в олигомерном белке — пример взаимодействия высокомолекулярных лигандов. Каждый протомер, соединённый с другими протомерами, служит для них лигандом, так же как они для него.
Иногда присоединение какого-либо лиганда изменяет конформацию белка, в результате чего формируется центр связывания с другими лигандами. Например, белок кальмодулин после связывания с четырьмя ионами Са 2+ в специфических участках приобретает способность взаимодействовать с некоторыми ферментами, меняя их активность.
Четвертичная структура белков. Особенности строенияи функционирования олигомерных белков на примере гемоглобина. Кооперативные изменения конформации протомеров. Возможность регуляции биологической функции олигомерных белков аллостерическими лигандами.
Под четвертичной структурой подразумевают способ укладки в пространстве отдельных полипептидных цепей, обладающих одинаковой (или разной) первичной, вторичной или третичной структурой, и формирование единого в структурном и функциональном отношениях макромолекулярного образования. Многие функциональные белки состоят из нескольких полипептидных цепей, соединенных не ковалентными связями, а неко-валентными (аналогичными тем, которые обеспечивают стабильность третичной структуры). Каждая отдельно взятая полипептидная цепь, получившая название протомера, мономера или субъединицы, чаще всего не обладает биологической активностью. Эту способность белок приобретает при определенном способе пространственного объединения входящих в его состав протомеров, т.е. возникает новое качество, не свойственное мономерному белку. Образовавшуюся молекулу принято называть олигомером (или мультимером). Олигомерные белки чаще построены из четного числа протомеров (от 2 до 4, реже от 6 до  с одинаковыми или разными молекулярными массами – от нескольких тысяч до сотен тысяч. В частности, молекула гемоглобина состоит из двух одинаковых α- и двух β-полипептидных цепей, т.е. представляет собой тетрамер.
с одинаковыми или разными молекулярными массами – от нескольких тысяч до сотен тысяч. В частности, молекула гемоглобина состоит из двух одинаковых α- и двух β-полипептидных цепей, т.е. представляет собой тетрамер.
Кооперативные изменения конформации протомеров.
Изменение конформации , а следовательно и функциональных свойств всех протомеров олигомерного белка при присоединение лиганда только к одному из них носит название-кооперативные изменения конформации протомеров.
Аллостерическая регуляция. Фермент изменяет активность с помощью нековалентно связанного с ним эффектора. Связывание происходит в участке, пространственно удаленном от активного (каталитического) центра. Это связывание вызывает конформационные изменения в молекуле белка, приводящие к изменению определенной геометрии каталитического центра. Активность может увеличиться — это активация фермента, или уменьшиться — это ингибирование «Сообщение» о присоединении аллостерического активатора передается посредством конформационных изменений каталитической субъединице, которая становится комплементарной субстрату, и фермент «включается». При удалении активатора фермент вновь переходит в неактивную форму и «выключается». Аллостерическая регуляция является основным способом регуляции метаболических путей.
Дата добавления: 2018-02-18 ; просмотров: 1290 ; Мы поможем в написании вашей работы!
1. Супервторичная структура типа б-бочонка
Этот «структурный мотив» обнаружен во многих ДНК-связывающих белках. Двухспиральная структура ДНК имеет две бороздки — большую и малую. Большая бороздка хорошо приспособлена для связывания белков, имеющих небольшие спиральные участки.
В данный структурный мотив входят две а-спирали. Более короткая а-спираль располагается поперёк бороздки, а более длинная а-спираль — в большой бороздке, образуя не-ковалентные специфические связи радикалов аминокислот с нуклеотидами ДНК
3. Супервторичная структурав виде «цинкового пальца»
Этот вид супервторичной структуры также часто отмечают в ДНК-связывающих белках. «Цинковый палец» — фрагмент белка, содержащий около 20 аминокислотных остатков, в котором атом цинка связан с радикалами четырёх аминокислот: обычно с двумя остатками цистеина и двумя — гистидина. В некоторых случаях вместо остатков гистидина также находятся остатки цистеина
4. Супервторичная структура в виде «лейциновой застёжки-молнии»
Некоторые ДНК-связывающие белки олигомерны, т.е. содержат в своём составе несколько полипептидных цепей. Кроме того, существуют белки, которые функционируют в комплексе с другими белками. Объединение протомеров или отдельных белков в комплексы иногда осуществляется с помощью структурных мотивов, называемых «лейциновая застёжка-молния».
10. Четвертичная структура белка-это количество и взаиморасположение полипептидных цепей
Белки, состоящие из одной полипептидной цепи, имеют только третичную структуру (лизоцим, пепсин, миоглобин, трипсин).Их называют мономерами.Цепи белков соединенные ковалентными связями (например дисульфидными)поэтому инсулин мономерный белок.
Для белков, состоящих из нескольких полипептидных цепей, характерна четвертичная структура.
Под четвертичной структурой понимают объединение отдельных полипептидных цепей с третичной структурой в функционально активную молекулу белка.Каждая отдельная полипептидная цепь называется протомером и чаще не обладает биологической активностью.Олигомерные белки содержат от 2(гексокиназа)до 312(пируватдегидрогеназа)пртомеров.Специфичность связывания протомеров за счет зависит от совокупности радикалов третичной структуры и определяется комплементарностьюпротомеров.
Комплементарность-пространственное и химическое соответствие взаимодействующих поверхностей.
В молекуле белка может быть несколько протомеров, которые при объединении образуют олигомер или мультимер.
Для белков с четвертичной структурой характерно понятие субъединицы.
Субъединица – это функционально активная часть молекулы белка.
Примером белка с четвертичной структурой является гемоглобин, состоящий из 4 протомеров: 2 α и 2 β — цепей.
Взаимодействие полипептидных цепей при формировании олигомера происходит за счет полярных групп аминокислотных остатков. Между полярными группами образуется ионная, водородные связи, гидрофобные взаимодействия.
Активные центры возникают при образовании четвертичной структуры.
В молекуле белка имеются прочные (ковалентные) связи, а также слабые, что обеспечивает с одной стороны стабильность молекулы, а с другой лабильность.
Альфа спирали в протомере обозначают латинскими буквами от A до H,начиная с N конца
Кооперативные изменения конформациипротомеров.
Кислород связывается с протомерами гемоглобина чере железо(2),который соединен с 4 атомами азота пиррольных колец и атомом азота Гис F8 белковой части протомера.Связывание кислорода с оставшейся координационной связью железа происходит по другую сторону от плоскости гема.Гис Е7 обеспечивает оптимальные условия.Присоединение кислорода к атому железа одного протомера вызывает его перемещение в плоскостььгема,за ним перемещаются остаток Гис F8 и полипептидная цепь.Так как протомер связан с остальными протомерами,а белки обладают конформационной лабильностью,происходит изменение конформации всего белка.Конформационные изменения ,произошедшие в других протомерах,облегчают присоединение следующей молекулы кислорода ,что вызывает новые конформационные изменения в белке и ускорение связывания следующей молекулы кислорода .Четвертая молекула кислорода присоединяется к гемоглобину в 300 раз легче первой.
Изменение конформациивсехпротомеров олигомерного белка при присоединение лиганда только к одному из них носит название Кооперативные изменения конформациипротомеров.
Аналогичным образом в тканях диссоцифция каждой молекулы кислорода изменяет конфоормацию всех протомеров и облегчает отщепление последующих молекул кислорода.
Структура белка
Белки. Структура белков. Свойства белков.
Белок – это последовательность аминокислот, связанных друг с другом пептидными связями.
Легко представить, что количество аминокислот может быть различно: от минимум двух до любых разумных величин. Биохимики условились считать, что если количество аминокислот не превышает 10, то такое соединение называется пептид; если от 10 и более аминокислот – полипептид. Полипептиды, способные самопроизвольно формировать и удерживать определенную пространственную структуру, которая называется конформацией, относят к белкам. Стабилизация такой структуры возможна лишь при достижении полипептидами определенной длины (более 40 аминокислот), поэтому белками обычно считают полипептиды молекулярной массой более 5 000 Да. (1Да равен 1/12 изотопа углерода). Только имея определенное пространственное строение (нативную структуру), белок может выполнять свои функции.
Размер белка может измеряться в дальтонах (молекулярная масса), чаще из-за относительно большой величины молекулы в производных единицах — килодальтонах (кДа). Белки дрожжей, в среднем, состоят из 466 аминокислот и имеют молекулярную массу 53 кДа. Самый большой из известных в настоящее время белков — титин — является компонентом саркомеров мускулов; молекулярная масса его различных изоформ варьирует в интервале от 3000 до 3700 кДа, он состоит из 38 138 аминокислот (в человеческой мышце solius).
Структура белка
Трехмерная структура белка формируется в процессе фолдинга (от англ. folding — «сворачивание»). Трехмерная структура формируется в результате взаимодействия структур более низких уровней.
Выделяют четыре уровня структуры белка:
Первичная структура — последовательность аминокислот в полипептидной цепи.
Вторичная структура — это размещение в пространстве отдельных участков полипептидной цепи.
Ниже приведены самые распространенные типы вторичной структуры белков:
α-спирали — плотные витки вокруг длинной оси молекулы, один виток составляют 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм (на один аминокислотный остаток приходится 0,15 нм), спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 аминокислотных остатка. Спираль построена исключительно из одного типа стереоизомеров аминокислот (L). Хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина. Расположенные близко друг к другу остатки аспарагина, серина, треонина и лейцина могут стерически мешать образованию спирали, остатки пролина вызывает изгиб цепи и также нарушают структуру α-спирали.
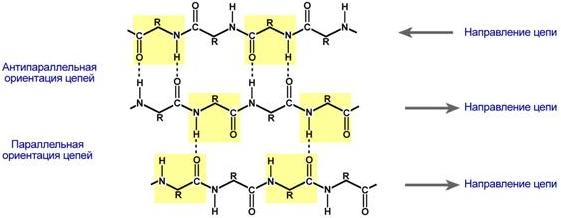
β-складчатые слои — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удаленными друг от друга (0,347 нм на аминокислотный остаток) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Эти цепи обычно направлены N-концами в противоположные стороны (антипараллельная ориентация). Для образования β-складчатых слоев важны небольшие размеры боковых групп аминокислот, обычно преобладают глицин и аланин.
 Участие водородных связей в формировании вторичной структуры Участие водородных связей в формировании вторичной структуры |
 Укладка белка в виде α-спирали Укладка белка в виде α-спирали |
Укладка белка в виде β-складчатого слоя
Неупорядоченные структуры — это неупорядоченное расположение белковой цепи в пространстве.
Пространственная структура каждого белка индивидуальна и определяется его первичной структурой. Однако сравнение конформаций разных по структуре и функциям белков выявило наличие у них похожих сочетаний элементов вторичной структуры. Такой специфический порядок формирования вторичных структур называют супервторичной структурой белков. Супервторичная структура формируется за счёт межрадикальных взаимодействий.
Определённые характерные сочетания α-спиралей и β-структур часто обозначают как «структурные мотивы». Они имеют специфические названия: «α-спираль-поворот-α-спираль», «структура α/β-бочонка», «лейциновая застёжка-молния», «цинковый палец» и др.
Третичная структура – это способ размещения в пространстве всей полипептидной цепи. Наряду с α-спиралями, β-складчатыми слоями и супервторичными структурами в третичной структуре обнаруживается неупорядоченная конформация, которая может занимать значительную часть молекулы.
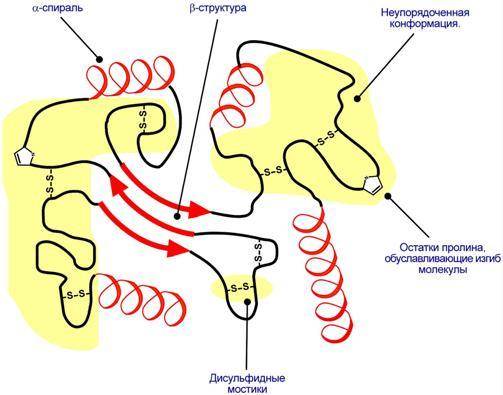
Схематичное представление укладки белка в третичную структуру.
Четвертичная структура возникает у белков, которые состоят из нескольких полипептидных цепей (субъединиц, протомеров или мономеров), при объединении третичных структур этих субъдиниц. Например, молекула гемоглобина состоит из 4 субъединиц. Четвертичную структуру имеют надмолекулярные образования – мультиферментные комплексы, которые состоят из нескольких молекул ферментов и коферментов (пируватдегидрогеназа), и изоферменты (лактатдегидрогеназа — ЛДГ, креатинфосфокиназа – КФК).
Итак. Пространственная структура зависит не от длины полипептидной цепи, а от последовательности аминокислотных остатков, специфичной для каждого белка, а также от боковых радикалов, свойственных соответствующим аминокислотам. Пространственную трехмерную структуру или конформацию белковых макромолекул образуют в первую очередь водородные связи, гидрофобные взаимодействия между неполярными боковыми радикалами аминокислот, ионные взаимодействия между противоположно заряженными боковыми группами аминокислотных остатков. Водородные связи играют огромную роль в формировании и поддержании пространственной структуры белковой макромолекулы.
Что касается гидрофобных взаимодействий, то они возникают в результате контакта между неполярными радикалами, неспособными разорвать водородные связи между молекулами воды, которая вытесняется на поверхность белковой глобулы. По мере синтеза белка неполярные химические группировки собираются внутри глобулы, а полярные вытесняются на ее поверхность. Таким образом, белковая молекула может быть нейтральной, заряженной положительно или же отрицательно в зависимости от рН растворителя и ионогенных групп в белке. Кроме того, конформация белков поддерживается ковалентными связями S—S, образующимися между двумя остатками цистеина. В результате образования нативной структуры белка многие атомы, находящиеся на удаленных участках полипептидной цепи, сближаются и, воздействуя друг на друга, приобретают новые свойства, отсутствующие у индивидуальных аминокислот или небольших полипептидов.
Важно понимать, что фолдинг — сворачивание белков (и других биомакромолекул) из развёрнутой конформации в «нативную» форму — физико-химический процесс, в результате которого белки в своей естественной «среде обитания» (растворе, цитоплазме или мембране) приобретают характерные только для них пространственную укладку и функции.
В клетках имеется ряд каталитически неактивных белков, которые тем не менее вносят большой вклад в образование пространственных структур белков. Это так называемые шапероны. Шапероны помогают правильной сборке трехмерной белковой конформации путем образования обратимых нековалентных комплексов с частично свернутой полипептидной цепью, одновременно ингибируя неправильно образованные связи, ведущие к формированию функционально неактивных белковых структур. В перечень функций, свойственных шаперонам, входит защита расплавленных (частично свернутых) глобул от агрегации, а также перенос новосинтезированных белков в различные локусы клеток.
Шапероны преимущественно являются белками теплового шока, синтез которых резко усиливается при стрессовом температурном воздействии, поэтому их называют еще hsp (heat shock proteins). Семейства этих белков найдены в микробных, растительных и животных клетках. Классификация шаперонов основана на их молекулярной массе, которая варьирует от 10 до 90 kDa. Они являются белками-помощниками процессов образования трехмерной структуры белков. Шапероны удерживают новосинтезированную полипептидную цепь в развернутом состоянии, не давая ей свернуться в отличную от нативной форму, и обеспечивают условия для единственно правильной, нативной структуры белка.
В процессе фолдинга белка некоторые конформации молекулы забраковываются на стадии расплавленной глобулы. Деградацию таких молекул инициирует белок убиквитин.
Деградация белка по убиквитиновому пути включает две основные стадии:
1) ковалентное присоединение убиквитина к подлежащему деградации белку через остаток лизина, наличие такой метки в белке является первичным сигналом сортировки, направляющей образовавшиеся конъюгаты к протеасомам, в большинстве случаев к белку присоединяется несколько молекул убиквитина, которые организованы в виде бусинок на нитке.;
2) гидролиз белка протеосомой (основная функция протеасомы – протеолитическая деградация ненужных и повреждённых белков до коротких пептидов). Убиквитин заслуженно называют «меткой смерти» для белка.
Доме?н белка? – элемент третичной структуры белка, представляющий собой достаточно стабильную и независимую подструктуру белка, чей фолдинг проходит независимо от остальных частей. В состав домена обычно входит несколько элементов вторичной структуры. Сходные по структуре домены встречаются не только в родственных белках (например, в гемоглобинах разных животных), но и в совершенно разных белках. Белок может иметь несколько доменов, эти участки могут выполнять разные функции в одном и том же белке. Доменную структуру имеют некоторые ферменты и все иммуноглобулины. Белки с длинными полипептидными цепями (более 200 аминокислотных остатков) часто создают доменные структуры.
Супервторичная структура типа б-бочонка
Каждая б-структура расположена внутри и связана с а-спиральным участком полипептидной цепи, е Супервторичную структуру в виде-б-бочонка имеют некоторые ферменты.
2. Структурный мотив «а-спираль-поворот-а-спиралъ»
Этот «структурный мотив» обнаружен во многих ДНК-связывающих белках. Двухспиральная структура ДНК имеет две бороздки — большую и малую. Большая бороздка хорошо приспособлена для связывания белков, имеющих небольшие спиральные участки.
В данный структурный мотив входят две а-спирали. Более короткая а-спираль располагается поперёк бороздки, а более длинная а-спираль — в большой бороздке, образуя не-ковалентные специфические связи радикалов аминокислот с нуклеотидами ДНК
3. Супервторичная структурав виде «цинкового пальца»
Этот вид супервторичной структуры также часто отмечают в ДНК-связывающих белках. «Цинковый палец» — фрагмент белка, содержащий около 20 аминокислотных остатков, в котором атом цинка связан с радикалами четырёх аминокислот: обычно с двумя остатками цистеина и двумя — гистидина. В некоторых случаях вместо остатков гистидина также находятся остатки цистеина
4. Супервторичная структура
в виде «лейциновой застёжки-молнии»
Некоторые ДНК-связывающие белки олигомерны, т.е. содержат в своём составе несколько полипептидных цепей. Кроме того, существуют белки, которые функционируют в комплексе с другими белками. Объединение протомеров или отдельных белков в комплексы иногда осуществляется с помощью структурных мотивов, называемых «лейциновая застёжка-молния».
10. Четвертичная структура белка-это количество и взаиморасположение полипептидных цепей
Белки, состоящие из одной полипептидной цепи, имеют только третичную структуру (лизоцим, пепсин, миоглобин, трипсин).Их называют мономерами.Цепи белков соединенные ковалентными связями (например дисульфидными)поэтому инсулин мономерный белок.
Для белков, состоящих из нескольких полипептидных цепей, характерна четвертичная структура.
Под четвертичной структурой понимают объединение отдельных полипептидных цепей с третичной структурой в функционально активную молекулу белка. Каждая отдельная полипептидная цепь называется протомером и чаще не обладает биологической активностью.Олигомерные белки содержат от 2(гексокиназа)до 312(пируватдегидрогеназа)пртомеров.Специфичность связывания протомеров за счет зависит от совокупности радикалов третичной структуры и определяется комплементарностьюпротомеров.
Комплементарность-пространственное и химическое соответствие взаимодействующих поверхностей.
В молекуле белка может быть несколько протомеров, которые при объединении образуют олигомер или мультимер.
Для белков с четвертичной структурой характерно понятие субъединицы.
Субъединица – это функционально активная часть молекулы белка.
Примером белка с четвертичной структурой является гемоглобин, состоящий из 4 протомеров: 2 α и 2 β — цепей.
Взаимодействие полипептидных цепей при формировании олигомера происходит за счет полярных групп аминокислотных остатков. Между полярными группами образуется ионная, водородные связи, гидрофобные взаимодействия.
Активные центры возникают при образовании четвертичной структуры.
В молекуле белка имеются прочные (ковалентные) связи, а также слабые, что обеспечивает с одной стороны стабильность молекулы, а с другой лабильность.
Альфа спирали в протомере обозначают латинскими буквами от A до H,начиная с N конца
Кооперативные изменения конформациипротомеров.
Кислород связывается с протомерами гемоглобина чере железо(2),который соединен с 4 атомами азота пиррольных колец и атомом азота Гис F8 белковой части протомера.Связывание кислорода с оставшейся координационной связью железа происходит по другую сторону от плоскости гема.Гис Е7 обеспечивает оптимальные условия.Присоединение кислорода к атому железа одного протомера вызывает его перемещение в плоскостььгема,за ним перемещаются остаток Гис F8 и полипептидная цепь.Так как протомер связан с остальными протомерами,а белки обладают конформационной лабильностью,происходит изменение конформации всего белка.Конформационные изменения ,произошедшие в других протомерах,облегчают присоединение следующей молекулы кислорода ,что вызывает новые конформационные изменения в белке и ускорение связывания следующей молекулы кислорода .Четвертая молекула кислорода присоединяется к гемоглобину в 300 раз легче первой.
Изменение конформациивсехпротомеров олигомерного белка при присоединение лиганда только к одному из них носит название Кооперативные изменения конформациипротомеров.
Аналогичным образом в тканях диссоцифция каждой молекулы кислорода изменяет конфоормацию всех протомеров и облегчает отщепление последующих молекул кислорода.
Амфотерность
Так как белки содержат кислые и основные аминокислоты, то в их составе всегда имеются свободные кислые (СОО – ) и основные (NH3 + ) группы.
Заряд белка зависит от соотношения количества кислых и основных аминокислот. Поэтому, аналогично аминокислотам, белки заряжаются положительно при уменьшении рН, и отрицательно при его увеличении. Если рН раствора соответствует изоэлектрической точке белка, то заряд белка равен 0.
Если в пептиде или белке преобладают кислыеаминокислоты (глутамат и аспартат), то при нейтральных рН заряд белка отрицательныйи изоэлектрическая точка находится в кислой среде. Для большинства природных белков изоэлектрическая точка находится в диапазоне рН 4,8-5,4, что свидетельствует о преобладании в их составе глутаминовой и аспарагиновой аминокислот.
Если в белке преобладают основныеаминокислоты (лизин и аргинин) – при нейтральных рН заряд положительныйи обусловлен этими, положительно заряженными, аминокислотами.
Амфотерность имеет значение для выполнения белками некоторых функций. Например, буферные свойства белков, т.е. способность поддерживать неизменным рН крови, основаны на способности присоединять ионы Н + при закислении среды или отдавать их при защелачивании.
С практической стороны наличие амфотерности позволяет разделять белки по заряду (электрофорез) или использовать изменение величины рН раствора для осаждениякакого-либо известного белка. Наличие как положительных, так и отрицательных зарядов в белке обуславливает их способность к высаливанию, что удобно для выделения белков в нативнойконформации.
Влияние рН на заряд белка
При смещении рН в растворе изменяется концентрация ионов Н + . При закислении среды (при снижении рН) ниже изоэлектрической точки ионы Н + присоединяются к отрицательно заряженным группам глутаминовой и аспарагиновой кислот и нейтрализуют их. Заряд белка при этом становится положительным.
При увеличении рН в растворе выше изоэлектрической точки концентрация ионов Н + снижается и положительно заряженные группы белка (NH3 + -группы лизина и аргинина) теряют протоны, их заряд исчезает. Суммарный заряд белка становится отрицательным.
Растворимость. Так как большинство белков несет много заряженных групп, то в целом они водорастворимы. Растворимость объясняется:
- наличием зарядаи взаимоотталкиванием заряженных молекул белка,
- наличием гидратной оболочки – чем больше полярных и/или заряженных аминокислот в белке, тем больше гидратная оболочка. Например, 100 г белка альбумина связывает 30-50 г воды
Пример денатурации — свертывание яичных белков при варке яиц. Денатурация бывает обратимой и необратимой.
Необратимая денатурация может быть вызвана образованием нерастворимых веществ при действии на белки солей тяжелых металлов — свинца или ртути.
РЕНАТУРА́ЦИЯ — процесс восстановления структурной организации биополимера (белковой молекулы или молекул нуклеиновых кислот). Ренатурация возможна только при обратимой денатурации. Ренатурация лежит в основе многих биологических механизмов.
Нужно отметить, что не все белки способны ренатурировать; у большинства белков денатурация необратима. Ренатурация возможна только если затронута третичная или вторичная структура. При этом восстанавливаются функции данного белка.
Внешние проявления денатурации сводятся к потере растворимости, особенно в изоэлектрической точке, повышению вязкости белковых растворов, увеличению количества свободных функциональных SH-групп и изменению характера рассеивания рентгеновских лучей. Наиболее характерным признаком денатурации является резкое снижение или полная потеря белком его биологической активности (каталитической, антигенной или гормональной). При денатурации белка, вызванной 8М мочевиной или другим агентом, разрушаются в основном нековалентные связи (в частности,гидрофобны взаимодействия и водородные связи). Дисульфидные связи в присутствии восстанавливающего агента меркаптоэтанола разрываются, в то время как пептидные связи самого остова полипептидной цепи не затрагиваются. В этих условиях развертываются глобулы нативных белковых молекул и образуются случайные и беспорядочные структуры.
Вызывать денатурацию белков могут разнообразные факторы, перечисленные ниже.
Нагревание или излучение белка, например инфракрасное или ультрафиолетовое. Кинетическая энергия, сообщаемая белку, вызывает вибрацию его атомов, вследствие чего слабые водородные и ионные связи разрываются,и белок свертывается (коагулирует).
Сильные кислоты, щелочи, соли денатурируют белок. Под действием этих реагентов ионные связи разрываются и белок коагулирует. Длительное воздействие реагента может вызвать разрыв и пептидных связей.
Тяжелые металлы денатурируют белок. Положительно заряженные ионы тяжелых металлов (катионы) образуют прочные связи с отрицательно заряженными карбоксил-анионами R-групп белка и часто вызывают разрывы ионных связей. Они также снижают электрическую поляризацию белка, уменьшая его растворимость. Вследствие этого находящийся в растворе белок выпадает в осадок.
Органические растворители и детергенты денатурируют белок. Эти реагенты нарушают гидрофобные взаимодействия и образуют связи с гидрофобными (неполярными) группами. В результате разрываются и внутримолекулярные водородные связи. Использование спирта в качестве дезинфицирующего средства основано именно на том, что он вызывает денатурацию белка любых присутствующих бактерий.
13.Свойства белковых растворов определяются большими размерами молекул, т.е. белки являются коллоидными частицами и образуют коллоидные растворы.
К свойствам белковых растворов относятся:
1. Рассеивание света вследствие дифракции на коллоидных частицах – опалесценция. Особенно это заметно при прохождении луча света через белковый раствор, когда виден светящийся конус (эффект Тиндаля).
2. Белковые растворы в отличие от истинных обладают малой скоростьюдиффузии.
3. Неспособностьбелковых частиц проникать через мембраны, поры которых меньше диаметра белков (полунепроницаемые мембраны). Это используется в диализе. Очистка белковых препаратов от посторонних примесей лежит в основе работы «искусственной почки» при лечении острой почечной недостаточности.
4. Создание онкотическогодавления, то есть перемещение воды в сторону более высокой концентрации белка, что проявляется, например, как формирование отеков при повышении проницаемости сосудистой стенки.
5. Высокая вязкость в результате сил сцепления между крупными молекулами, что проявляется, например, при образовании гелей и студней.

Главными факторами устойчивости белка в растворе служат заряд молекулы и гидратная оболочка.
Общий поверхностный заряд белковой молекулы при растворении в воде определяется суммой зарядов отдельных аминокислотных остатков, из которых построен белок. Если в составе протеина преобладают «щелочные» аминокислоты (аргинин, лизин), то молекула в целом заряжается по-ложительно; при преобладании дикарбоновых аминокислот — отрицательно. Одноименно заряженные белковые молекулы в растворе отталкиваются друг от друга, что препятствует их осаждению.
Важной особенностью белка является способность менять величину и даже знак заряда при изменении рН среды, что связано с обратимостью диссоциации ионогенных групп в аминокислотных остатках (см. выше). Так, при добавлении кислоты к раствору белка часть СОО^-групп, связывая избыток протонов, рекомбинирует до СООН-групп; при этом их отрицательные заряды исчезают, а все положительные заряды сохраняются. Это ведет к сдвигу общего заряда белка в положительную сторону.
Для каждого белка можно подобрать такое значение рН среды, при котором количество положительных зарядов в молекуле сравняется с количеством отрицательных, а их алгебраическая сумма будет равна нулю. Это значение рН (не обязательно нейтральное!) называется изоэлектриче-ской точкой белка (ИЭТ). При сдвиге рН в кислую или щелочную сторону
Рис. 2.4. Изменение заряда белковой молекулы при сдвигах рН среды
С локальными поверхностными зарядами белка связано наличие гидратной оболочки: молекулы-диполи воды «облепляют» белок в один или несколько слоев в зависимости от величины заряда. Одно из основных качеств гидратной оболочки — упругость; при столкновении гидратирован-ных молекул белка в растворе они не слипаются, а отскакивают друг от друга, что препятствует их выпадению в осадок. Для осаждения белков нужно нейтрализовать заряд молекулы, доведя рН среды до ИЭТ, и «снять» гидратную оболочку действием концентрированных растворов солей (высаливание) или спирта.
Реакции осаждения белков
Белки в растворе и соответственно в организме сохраняются в нативном состоянии за счет факторов устойчивости, к которым относятся заряд белковой молекулы и гидратная оболочка вокруг нее. Удаление этих факторов приводит к склеиванию молекул белков и выпадению их в осадок. Осаждение белков может быть обратимым и необратимым в зависимости от реактивов и условий реакции. В клинической лабораторной практике реакции осаждения используют для выделения альбуминовой и глобулиновой фракций белков плазмы крови, количественной характеристики их устойчивости в плазме, обнаружения белков в биологических жидкостях и освобождения от них с целью получения без белкового раствора.
Обратимое осаждение.Под действием факторов осаждения белки выпадают в осадок, но после прекращения действия (удаления) этих факторов белки вновь переходят в растворимое состояние и приобретают свои нативные свойства. Одним из видов обратимого осаждения белков является высаливание.
Высаливание. Насыщенным раствором сульфата аммония осаждается альбуминовая фракция белков, полунасыщенным раствором — глобулиновая фракция.
Сущность реакции заключается в дегидратации молекул белка.
1) неразведенный яичный белок;
2) насыщенный раствор сульфата аммония;
3) NaOH, 10% раствор,
4) CuSO4, 1% раствор;
5) дистиллированная вода;
6) сульфат аммония в порошке.
Необратимое осаждение белков.
Необратимое осаждение белков связано с глубокими нарушениями структуры белков (вторичной и третичной) и потерей ими нативных свойств. Такие изменения белков можно вызвать кипячением, действием концентрированных растворов минеральных и органических кислот, солями тяжелых металлов.
Осаждение при кипячении.
Белки являются термолабильными соединениями и при нагревании свыше 50-60 градусов С денатурируются. Сущность тепловой денатурации заключается в разрушении гидратной оболочки, разрыве стабилизирующих белковую глобулу связей и развертывании белковой молекулы. Наиболее полное и быстрое осаждение происходит в изоэлектрической точке (когда заряд молекулы равен нулю), поскольку частицы белка при этом наименее устойчивы. Белки, обладающие кислыми свойствами, осаждаются в слабокислой среде, а белки с основными свойствами — в слабощелочной. В сильнокислых или сильнощелочных растворах денатурированный при нагревании белок в осадок не выпадает, т.к. его частицы перезаряжаются и несут в первом случае положительный, а во втором — отрицательный заряд, что повышает их устойчивость в растворе.