Общие сведения об СМА
Спинальная мышечная атрофия (СМА) — это группа наследственных заболеваний, при которых происходит повреждение нервных клеток, называемых моторными нейронами. Моторные нейроны- это тип нервных клеток в спинном мозге, которые контролируют движения и поддержание мышечного тонуса.
Отмирание моторных нейронов приводит к прогрессивному развитию слабости мышц, их атрофии, и в итоге, обездвиживанию пациента. Спинальная мышечная атрофия делится на несколько типов, в зависимости от того, насколько серьезны симптомы и в каком возрасте они начались:
Частота и тип наследования СМА
Спинальная мышечная атрофия встречается у 1 из 6000 — 10 000, с частотой носительства 1 из 38 человек. Больной ребенок рождается, при наличии двух мутаций, со стороны матери и со стороны отца. Родители, являющиеся носителями мутации в гене SMN1, не имеют клинических симптомов. Спинальная мышечная атрофия наследуется по аутосомно-рецессивному типу:


Есть и другие гены (например ATP7A и др.), поломки в которых приводят к развитию СМА. Поэтому возможны и другие типы наследования (доминантный/X-сцепленный) и, соответственно, другие риски.
Причина заболевания и патогенез СМА
Большинство типов СМА вызваны изменением гена SMN1 . Этот ген отвечает за создание белка (SMN), поддерживающего нормальную функцию моторных нейронов. Мутации гена SMN1 приводят к нехватке выработки функциональных белков SMN. Отсутсутствием белка SMN является ухудшение работы двигательных нейронов в спинном мозге, что приводит к дисфункции произвольных мышечных движений и к прогрессирующей мышечной слабости.
Тяжесть течения болезни модифицируется вторым геном SMN2. Он очень похож на ген SMN1, но отличается последовательностью нуклеотидов в 7 и 8 экзонах. Ген SMN2 не способен продуцировать функциональный белок SMN в достаточном количестве, однако количество копий SMN2, а также последовательность этих копий влияют на фенотип. Поэтому важно получить информацию о количестве копий генов SMN1и SMN2, не только у пациента с признаками СМА, но и у пар, планирующих беременность.
Скрининг новорожденных на СМА
Хотя скрининг новорожденных еще не является стандартной практикой, время имеет решающее значение. Более ранняя диагностика СМА может помочь улучшить исходы для детей с атрофией дыхательных и скелетных мышц.
Не в состоянии сидеть
Ожидаемая продолжительность жизни ≤2 года
Ребенок плохо держит голову
Прогрессирующая слабость мышц, используемых для жевания и глотания
Плохой мышечный тонус
«Поза лягушки» при лежании
Сильная мышечная слабость с обеих сторон тела
Прогрессирующая слабость дыхательных мышц
Умеют сидеть самостоятельно
Ожидаемая продолжительность жизни >2 лет
70% живут до 25 лет
Мышечная слабость и гипотония
Проблемы с глотанием, кашлем и дыханием возникают, но встречаются реже
Ограничение движения в суставах, сколиоз
Умеют ходить, однако постепенно утрачивают эту способность
Нормальная продолжительность жизни
Сколиоз, деформации грудной клетки
Атрофия мышц тазового пояса и проксимальных отделов нижних конечностей
симптомы сходны со СМА III. Постепенное начало слабости, тремора и мышечных фасцикуляций, впервые отмеченных в позднем подростковом или раннем взрослом возрасте.
Метод MLPA для диагностики СМА
Молекулярная диагностика осложнена схожестью генов SMN1 и SMN2, поэтому для диагностики необходимо использовать метод, позволяющий определить количество копий 7 экзона в гене SMN1.
На сегодняшний день MLPA (мультиплексная амплификация лигазно-связанных проб) является общепризнанным золотым стандартом для определения носителей СМА из-за его высокой степени точности для количественного определения числа копий SMN1.
Большинство случаев СМА (> 95%) вызвано гомозиготными делециями экзона 7 и/или экзона 8 в гене SMN1, однако есть другие гены, нарушения в которых могут привести к СМА. Это необходимо учитывать при дифференциальной диагностике при отрицательном результате теста SMN1 . Другие гены, подлежащие тестированию: ATP7A, BICD2, BSCL2, CHCHD10, DCTN1, DNAJB2, DYNC1H1, EXOSC3, EXOSC8, FBXO38, GARS, HSPB1, HSPB3, HSPB8, IGHMBP2, TRPV4, UBA1 и VAP1.
Биологический материал, пригодный для данного исследования:
- Периферическая кровь;
- Кровь плода;
- Карты пятен засохшей крови.
- При отягощенном семейном анамнезе спинальной мышечной атрофии
- При наличии симптомов, наводящих на мысль о СМА, независимо от семейного анамнеза
- Всем парам, планирующим осознанную беременность
1. Arnold ES, Fischbeck KH. Spinal muscular atrophy. Handb Clin Neurol. 2018;148:591-601
2. Keinath MC, Prior DE, Prior TW. Spinal Muscular Atrophy: Mutations, Testing, and Clinical Relevance. Appl Clin Genet. 2021 Jan 25;14:11-25. doi: 10.2147/TACG.S239603. PMID: 33531827; PMCID: PMC7846873
3. Kolb et al. Natural history of infantile-onset spinal muscular atrophy. Ann Neurol. 2017 Dec;82(6):883-891
4. Kraszewski et al. Pilot study of population-based newborn screening for spinal muscular atrophy in New York state. Genet Med. 2018 Jun;20(6):608-613
5. Rouzier C, Chaussenot A, Paquis-Flucklinger V. Molecular diagnosis and genetic counseling for spinal muscular atrophy (SMA). Arch Pediatr. 2020 Dec;27(7S):7S9-7S14. doi: 10.1016/S0929-693X(20)30270-0. PMID: 33357600.
ООО «Медикал Геномикс» ИНН: 6952037742 Лицензия № ЛО-69-01-002086 от 06.10.2017
Юр. адрес: г. Тверь, ул. Желябова, 48
ООО «Лаб-Трейдинг», ИНН: 6950225035
Юр. адрес: г. Тверь, ул. 1-Я За Линией Октябрьской Ж/Д, 2, оф. 22
«Обращаем ваше внимание на то, что вся информация (включая цены) на этом интернет-сайте носит исключительно информационный характер и ни при каких условиях не является публичной офертой, определяемой положениями Статьи 437 (2) Гражданского кодекса РФ.»
Как диагностируют и лечат спинальную мышечную атрофию

Лекарства, помогающие вылечить спинальную мышечную атрофию (СМА), появились недавно. О заболевании стали говорить чаще, чтобы привлечь внимание к проблеме дорогостоящих лекарств или в поддержку адресных сборов
О спинальной мышечной атрофии (СМА) — тяжелом редком генетическом заболевании — стали активно говорить в обществе и СМИ лишь несколько лет назад, хотя само заболевание, конечно, известно науке давно. Впервые оно было описано в 1891 году австрийским неврологом Г. Верднигом и затем в 1892 году немецким неврологом Й. Гоффманом.
Сегодня оживление вокруг проблематики СМА вызвано тем, что лишь относительно недавно благодаря активному развитию фармацевтической промышленности и генной терапии появились препараты, способные существенно замедлить прогрессирование заболевания. До этого момента болезнь считалась неизлечимой, а постановка диагноза «СМА» была равноценна приговору.
В последние годы о СМА рассказывают пациентские и благотворительные организации, медицинские работники, СМИ, а отдельные люди и фонды собирают средства на покупку дорогостоящих лекарств для таких больных. В результате самое общее представление о СМА имеют и многие обычные люди, далекие от медицины. Например, знают, что оно связано с тяжелой инвалидностью, сильным ограничением подвижности и что цены на спасительные лекарства от СМА исчисляются десятками миллионов рублей.
Что сегодня известно о СМА науке? Почему лечение этой болезни так дорого стоит? Как сегодня живут пациенты с этим диагнозом? Давайте разбираться.

Автор статьи — Кристина Невмержицкая, врач-невролог, заведующая отделением неврологии Областной детской клинической больницы Екатеринбурга, медицинский эксперт благотворительного фонда «Семьи СМА»
Что такое СМА
СМА — это аутосомно-рецессивное нервно-мышечное заболевание, характеризующееся прогрессирующими симптомами вялого паралича и мышечной атрофии. СМА одно из самых распространенных редких (орфанных) заболеваний. Распространенность СМА составляет 1 на 6–10 тыс. новорожденных. Согласно официальным данным, в России сегодня 890 детей со СМА. Каждый год рождается около 200 детей с этим диагнозом [1].
При СМА из-за генетической поломки возникает недостаток особого белка SMN (survival motor neuron). Это провоцирует постепенную гибель α-мотонейронов спинного мозга, которые иннервируют скелетные мышцы и отвечают за их сокращение.
В синтезе белка SMN участвуют два гена — SMN1 и SMN2. Ген SMN1 основной, он кодирует 85% белка. Второй ген SMN2 — оставшиеся 15% белка. Таким образом, если из-за мутации ген SMN1 не работает, единственным источником информации о белке SMN становится ген SMN2. Однако у больных СМА разное количество копий гена SMN2. Чем больше таких копий, кодирующих белок SMN, тем, как правило, легче течение болезни и благоприятнее прогноз. Количество копий гена SMN2 устанавливается путем генетического анализа.
Глобально у всех больных СМА наблюдается прогрессирующая мышечная слабость, ухудшение или постепенная потеря амплитуды движений, нарушения дыхания и глотания. При этом у больных сохраняется интеллект, способность к обучению и выполнению профессиональных навыков.
Как наследуется СМА
СМА — генетическое заболевание с аутосомно-рецессивным типом наследования. Это значит, что родители ребенка со СМА могут быть носителями дефектного гена SMN1, при этом заболевание не проявляется, а сами они могут не подозревать о риске передать его потомству. В случае если оба родителя передадут поврежденный ген ребенку, СМА разовьется у него с вероятностью 25%.
Если же ребенок получит поврежденный ген только от одного родителя, то не будет иметь симптомов заболевания, а так же, как и родители, будет носителем этого дефектного гена. Вероятность этого составляет 50%.

Типы СМА
В настоящее время принято выделять несколько типов спинальной мышечной атрофии на основании возраста появления первых симптомов и максимальных двигательных умений больного. Каждый тип при естественном течении заболевания связан с разной прогнозируемой продолжительностью жизни. По результату генетического анализа тип СМА установить нельзя.
СМА не зря называют коварным заболеванием. Нередко его признаки появляются внезапно, на фоне нормального общего развития, после чего все приобретенные навыки — удержания головы, сидения, ползания, стояния — постепенно теряются.
Классических типов СМА пять. Отдельно выделяют СМА 0 и IV типов [2].
СМА 0
СМА 0 типа нередко объединяют с I типом СМА. Он также, как и I тип, имеет самое тяжелое течение. СМА 0 типа проявляется еще внутриутробно — ребенок начинает менее активно шевелиться. С первых дней жизни у новорожденного наблюдаются резко сниженная спонтанная двигательная активность и мышечная гиподинамия, отсутствие сухожильных рефлексов, возникают проблемы с дыханием и глотанием.
Продолжительность жизни детей с этим типом СМА составляет несколько недель.
СМА I
Самый тяжелый тип СМА. Первые признаки заболевания возникают в возрасте до шести месяцев. Как правило, родители первыми замечают тревожные симптомы: ребенок не держит голову, не переворачивается и не может сидеть без посторонней поддержки. Дети со СМА I типа очень слабые, не могут в полную силу кричать и кашлять, испытывают трудности с принятием пищи, глотанием, дыханием и отхождением мокроты, в результате чего у них высок риск осложненного течения респираторных заболеваний.
Ожидаемая продолжительность жизни таких больных составляет меньше двух лет. Более ⅔ детей со СМА не доживают до двух лет и погибают в результате развития дыхательной недостаточности из-за слабости дыхательной мускулатуры.
СМА II
Данный тип СМА протекает медленнее и впервые проявляется в возрасте от шести до 18 месяцев. Главный признак — ребенок с трудом встает на ноги, в большинстве случаев у него вовсе не получается удерживать вертикальное положение тела. Ходить такие дети не могут. Также наблюдается задержка моторного развития, дрожание рук, сколиоз вследствие слабости мышц и контрактуры суставов. Больным может потребоваться инвалидная коляска. Вкупе с другими приспособлениями — поддержками, упорами — это позволяет зафиксировать оптимальное положение тела пациента.
Ожидаемая продолжительность жизни больных с этим типом СМА — 20–40 лет.

СМА III
Для третьего типа СМА характерно стабильное развитие больных до определенного возраста. Они могут сидеть, стоять и ходить. Затем болезнь проявляет себя — из-за прогрессирующей слабости мышц нижних конечностей походка постепенно становится неустойчивой. В ряде случае пациенты теряют способность ходить.
Продолжительность жизни больных со СМА III типа, как правило, такая же, как у обычных людей.
СМА IV
Этот тип СМА считается самым легким. Он проявляется уже во взрослом возрасте — после 25 лет. У таких больных наблюдаются умеренные двигательные нарушения, мышечная слабость, тремор. В ряде случаев из-за прогрессирования заболевания теряется способность ходить.
Диагностика СМА
Крайне важно установить диагноз как можно раньше, чтобы начать лечение и реабилитацию [3], [4].
Для подтверждения диагноза обычно проводят молекулярно-генетический анализ. Он показывает, имеется ли у больного дефект в гене SMN1, а также число копий гена SMN2. Анализ может быть назначен любым врачом, заподозрившим СМА. Педиатр и невролог может заметить настораживающее отставание развития ребенка от возрастных норм, поэтому родителям важно вовремя проводить все плановые осмотры ребенка и самим наблюдать за его физическим развитием.
При необходимости могут быть назначены и другие исследования, в том числе дополнительный генетический анализ, электромиография, некоторые лабораторные исследования, которые в большей степени служат для исключения похожих заболеваний. После уточнения диагноза требуется осмотр несколькими узкими специалистами для оценки факторов риска развития дыхательной недостаточности, ортопедических проблем, трудностей кормления и откашливания.
Очень важно, чтобы с каждым больным ребенком работала мультидисциплинарная команда специалистов, знающих все аспекты и нюансы лечения и реабилитации больных СМА.
Лечение СМА
Сегодня для лечения СМА в мире применяются три препарата.
Крупнейшие мировые фармацевтические компании параллельно исследуют и разрабатывают лекарства. В том числе оценивается эффективность увеличения доз препаратов, тестируются различные способы введения и комбинации лекарств.
Два из трех разработанных препаратов подходят для лечения всех типов СМА и на всех этапах. Однако чем раньше начинается лечение, тем лучшего эффекта можно достичь. Данная группа лекарств влияет на работу гена SMN2, который, в свою очередь, кодирует белок SMN, отвечающий за выживание нейронов спинного мозга. Препараты позволяют стабилизировать течение заболевания, улучшить двигательные функции больного и приобрести новые моторные навыки.
Сегодня это одни из самых дорогих лекарств в мире. Один из препаратов доставляется в ампулах. Одна ампула стоит около 4,5 млн руб. Получать лечение необходимо в течение всей жизни по определенной схеме. В первый год лечения необходимо сделать шесть уколов, затем каждый год делать по три укола. Второй препарат представляет собой раствор для приема внутрь, который можно применять в домашних условиях. Примерная стоимость годового курса лечения — $340 тыс.
Третий революционный препарат для лечения СМА у детей — продукт генной терапии. При помощи вирус-вектора препарат доставляет синтетическую функциональную копию гена SMN1 в нейроны спинного мозга. В результате лечения в моторных нейронах, лишенных гена SMN1, восстанавливается продуцирование белка SMN. Дозировка этого лекарства устанавливается индивидуально для каждого пациента в зависимости от веса. Безопасность и эффективность препарата установлены у детей в возрасте до двух лет или с весом до 21 кг. Лекарство применяется однократно — вводится пациенту путем внутривенной инфузии в течение одного часа. Из-за дороговизны разработка стоимость такого лечения достигает 150 млн руб.
На сегодняшний день любая медикаментозная терапия пациентам со СМА должна назначаться специалистами, имеющими достаточный опыт в ее применении.
Жизнь со СМА: как помочь больному
До появления препаратов для лечения СМА больным оказывалась только паллиативная помощь, призванная максимально облегчить симптомы [5].
Теперь речь идет о реабилитации, однако отработанных эффективных методик пока мало. На данный момент с уверенностью можно говорить только об эффективности физической терапии и гидрокинезотерапии.
Огромную роль в реабилитации больного со СМА играют его близкие. Вместе в врачами разных профилей они образуют единую команду, совместными усилиями которой ребенку могут быть обеспечены максимально эффективная системная реабилитация и уход.
Физическая терапия
Из-за общей мышечной слабости больные СМА не могут совершать движения в том же объеме, что здоровые люди. Из-за этого возникает риск развития контрактур суставов, которые со временем могут стать постоянными и ограничивать движения. Лечебная физкультура включает комплексы упражнений по восстановлению гибкости и общих функциональных возможностей. Упражнения подбираются индивидуально для каждого пациента в зависимости от особенностей его здоровья. Например, для полностью лежачих больных занятия ставят целью в том числе увеличение объема и амплитуды активных/пассивных движений в любом сегменте тела и конечностей. У сидячих пациентов — повышение мобильности.
В лечебной физкультуре также применяются различные вспомогательные устройства и приспособления. Например, вертикализатор позволяет улучшить прочность костей и может использоваться в домашних условиях.
Гидрокинезотерапия
Гидрокинезотерапия представляет собой комплекс водных лечебных упражнений, дополняемый подводным массажем и ортопедическими приспособлениями.
Упражнения проходят в специально оснащенном бассейне при оптимальной температуре воды. В целом вода — это дружественная среда для больных СМА, в том числе за счет снятия нагрузки на позвоночник, суставы и сердце. Занятия позволяют укрепить все группы мышц, способствуют восстановлению двигательных функций, повышают общий тонус пациентов и очень нравятся детям.
Где узнать о СМА больше
SMA Europe — европейская пациентская организация, созданная в 2006 году. Она объединяет пациентские и исследовательские организации всей Европы, посвященные СМА.
«Семьи СМА» — российская пациентская организация, часть SMA Europe, созданная в 2015 году. На сайте представлена актуальная информация о СМА для пациентов и их семей, в том числе последние новости о законодательных аспектах и фармацевтическом рынке. Работает горячая линия.
TogetherInSMA— международный сайт, созданный для информирования пациентов со СМА и их семей. Здесь на русском языке можно получить общую информацию о СМА, доступных методах лечения, найти практические руководства по уходу за больными и другие полезные сведения.
Вниманиесма.рф — информационный портал, созданный при поддержке второй по величине в мире фармацевтической компании. Ресурс полностью посвящен симптоматике СМА, в том числе первым тревожным симптомам заболевания.
Узнать о том, как поддержать людей с редкими (орфанными) заболеваниями можно на сайте «Редкое искусство помогать» и в аккаунте @rare_art.
Важно помнить, что ни информация данных ресурсов, ни эта статья не заменяют очную консультацию у медицинского специалиста по любым вопросам, связанным с диагностикой и лечением СМА.
Спинальная мышечная атрофия (СМА): что это такое?
СМА — редкая генетическая болезнь, требующая участия специалистов паллиативной помощи. Какие степени СМА бывают, чем характеризуется каждая, какое оборудование нужно пациентам — читайте в статье
Спинальная мышечная атрофия (СМА): что это такое?
СМА — редкая генетическая болезнь, требующая участия специалистов паллиативной помощи. Какие степени СМА бывают, чем характеризуется каждая, какое оборудование нужно пациентам — читайте в статье
СМА – одно из самых часто встречающихся генетических заболеваний из разряда редких: оно встречается у одного новорожденного из 6-10 тысяч. Если в семье есть ребенок со СМА, он должен получать паллиативную помощь, поскольку заболевание прогрессирующее и на сегодня — неизлечимое. Однако степени заболевания очень разные: одни пациенты умирают во младенчестве, другие — живут до старости.
Предлагаем вам познакомиться с основной информацией о СМА и той помощи, в которой нуждается семья с этим редким заболеванием. Информацию собрал и упорядочил фонд «Семьи СМА»: полную версию «ликбеза», включая истории семей, психологические аспекты, решение медицинских проблем в зависимости от состояния пациента, вы можете найти на сайте специального проекта фонда «Семьи СМА».
Что такое СМА?
СМА (спинальная мышечная атрофия) ― генетическое нервно-мышечное заболевание, которое поражает двигательные нейроны спинного мозга и приводит к нарастающей мышечной слабости. Заболевание носит прогрессирующий характер, слабость начинается с мышц ног и всего тела и с развитием заболевания доходит до мышц, отвечающих за глотание и дыхание. При этом интеллект больных СМА абсолютно сохранен.
В зависимости от тяжести симптомов выделяют 3 основных типа СМА: СМА 1, СМА 2, СМА 3. Чем раньше проявляются первые признаки болезни, тем ярче выражены симптомы, тем они тяжелее и тем быстрее прогрессирует заболевание.
СМА I (БОЛЕЗНЬ ВЕРДНИГА-ГОФФМАНА)
Наиболее тяжелая форма. Возраст проявления болезни: до 6 месяцев
Описание
- Выраженная мышечная гипотония; синдром «вялого ребенка»; не держит голову; не достигает способности сидеть и переворачиваться; обвисшее тело при удерживании подвешенным на животе;
- Ослабленные кашлевой, сосательный и глотательные рефлексы; поперхивание; дыхательные нарушения;
- В анамнезе может быть сниженная внутриутробная активность плода. Может наблюдаться деформация суставов и конечностей из-за внутриутробной гипотонии.
Течение
- Грубая задержка моторного развития;
- Быстрое развитие контрактур и деформаций грудной клетки;
- Прогрессирование бульбарных и дыхательных нарушений, проблемы с глотанием еды и слюны, отхождением мокроты;
- Высокий риск развития аспирационных пневмоний;
- Быстрое нарастание дыхательной недостаточности, особенно при присоединении инфекции.
Прогноз
- Наиболее тяжелая форма: при отсутствии респираторной поддержки большинство детей не доживают до 2 лет;
- Смерть наступает, как правило, из-за нарастания дыхательной недостаточности и развития пневмоний;
- Своевременная респираторная поддержка может увеличить продолжительность жизни ребенка;
- Такие дети нуждаются в паллиативном наблюдении.
«Нет человека без патологических генов». Генетик Наталия Белова рассказывает о редких болезнях и помощи семьям с больными детьми. А также о том, можно ли избежать генетической «поломки» у ребенка и почему жизнь «редких» — пока еще борьба
СМА II (БОЛЕЗНЬ ДУБОВИЦА)
Возраст проявления болезни: 6-18 месяцев.
Описание
- Отставание в моторном развитии;
- Способность сидеть без поддержки, иногда ― ползать или стоять, но эти возможности редуцируются по мере взросления;
- Может наблюдаться тремор пальцев;
- Мышечные и скелетные деформации;
- Нарушения дыхания.
Течение
- Задержка моторного развития, его остановка и регресс;
- Слабость межреберных мышц, поверхностное диафрагмальное дыхание, ослабление кашлевой функции, со временем развитие дыхательной недостаточности;
- Повышенный риск осложнений после респираторной инфекции;
- Деформации грудной клетки, контрактуры, сколиоз.
Прогноз
- Своевременная помощь и респираторная поддержка увеличивают продолжительность жизни.

Юлия Самойлова. Самый известный в России человек со СМА
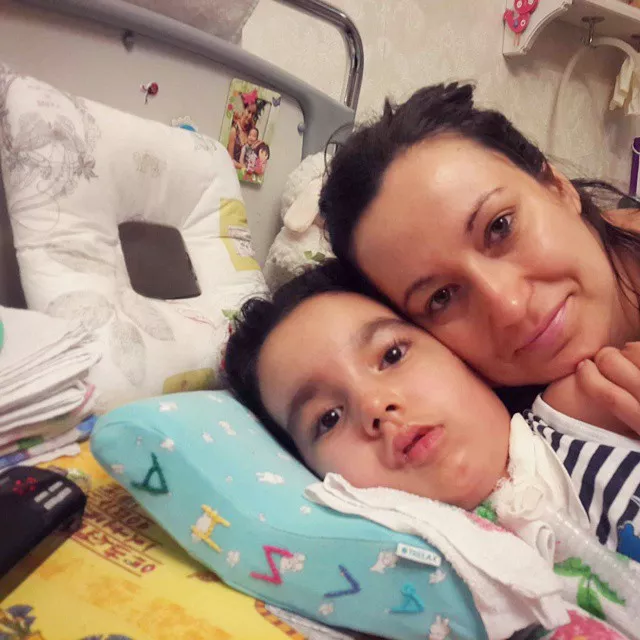
СМА III (БОЛЕЗНЬ КУГЕЛЬБЕРГА-ВЕЛАНДЕРА)
Возраст проявления болезни: после 18 месяцев
Описание
- Способность ходить самостоятельно (со временем теряется);
- Сложности с комплексными моторными навыками (например, подъем по лестнице, бег);
- По мере прогрессирования болезни могут отмечаться трудности с жеванием и глотанием, а также дыхательные проблемы и проблемы с откашливанием.
Течение
- Прогрессирует медленно;
- К подростковому возрасту большинство больных садятся в коляску, но у некоторых способность самостоятельно ходить может сохраниться до взрослого возраста;
- Со временем появляются выраженные контрактуры и сколиоз;
- Риск осложнений после респираторной инфекции.
Прогноз
- При надлежащем уходе имеют обычную продолжительность жизни.
Механизм СМА
СМА вызывается поломкой в гене SMN1. Ген SMN2 частично компенсирует утрату гена SMN1.
- Ген SMN1 поврежден и не соответствует норме
- Важные белки не производятся в достаточном количестве
- Двигательные нейроны функционируют неправильно и отмирают
- Импульсы не распознаются
- Мышцы теряют силу и атрофируются
- Движения ограничены, это затрудняет перемещение, дыхание и глотание

Диагностика и помощь специалистов
При выявлении симптомов, которые могут указывать на болезнь, необходимо комплексное обследование для установления точного диагноза.
Диагностика: необходимо получить консультацию невролога, специалиста по нервно-мышечным заболеваниям, который может установить диагноз на основании симптомов. Для подтверждения диагноза требуется проведение ДНК-диагностики и консультация генетика.
Генетическая диагностика: тест ДНК для выявления делеции гена SMN1 и определения количества копий SMN2.
Дополнительные исследования:
- Биохимия крови: креатинкиназа (КФК) — в норме при СМА I, в норме или незначительно повышена при других типах;
- Электронейромиография — показывает снижение нервных импульсов, помогает дифференцировать СМА от других нервно-мышечных болезней. Сенсорная нервная проводимость обычно в норме.
Медицинская помощь
Врачи-специалисты:
- Невролог ― ставит диагноз, назначает поддерживающее лечение, ведет постоянное наблюдение за ходом болезни.
- Генетик ― ставит диагноз и, в случае необходимости, консультирует семью по вопросам дальнейшего потомства.
- Участковый педиатр (терапевт) ― помогает лечить болезни, которыми болеют все.
- Пульмонолог или реаниматолог ― помогает выявить и скомпенсировать дыхательные нарушения, решать проблемы с откашливанием, дает консультации по респираторной поддержке.
- Ортопед ― оценивает нарушения опорно-двигательного аппарата (контрактуры, деформации), определяет необходимый объем профилактических мер, помогает корректировать эти нарушения.
- Нейрохирург ― занимается исправлением сколиоза. ― подбирает комплекс упражнений и абилитационных процедур и обучает родителей регулярно делать их дома самостоятельно.
- Нутрициолог или диетолог ― помогает подобрать оптимальное питание.
- Гастроэнтеролог ― помогает в случае возникновения проблем с желудком и кишечником.
- Кардиолог ― наблюдает за работой сердечно-сосудистой системы.
- Специалист по паллиативной помощи ― помогает комплексно улучшить качество жизни.
- Другие специалисты привлекаются по мере возникновения специфических проблем.

Я верю, что скоро мальчики с Дюшенном будут жить не так, как сейчас Личная история семьи Татьяны Андреевны Гремяковой, президента благотворительного фонда «Гордей»
Важные аспекты:
- Семейно-ориентированный подход ― врач учитывает мнение семьи по всем вопросам, касающимся лечения ребенка, в том числе проведения медицинских вмешательств и их объема, их приемлемости и сроков проведения;
- Ориентация на качество жизни пациента ― прежде чем предложить семье применение каких-либо медицинских технологий, необходимо учесть, как это повлияет на качество жизни, потому что важно жить полноценно, а не существовать;
- Качественная коммуникация и полноценное информирование пациента и членов семьи обо всех аспектах СМА ― как можно более полная информация о болезни, о том, что будет происходить и с чем придется столкнуться, а также как с этим справляться;
- Обучение практическим навыкам ухода и применения медицинского оборудования должно быть неотъемлемой частью медицинской помощи;
- Междисциплинарный и мультипрофессиональный подход ― необходима работа междисциплинарной команды (к примеру, невозможно ограничиться наблюдением невролога и получить весь спектр необходимой помощи для полноценной поддержки).
Помогающие организации
Благотворительный фонд «Семьи СМА» — единственная в России организация, специализирующаяся на помощи семьям, столкнувшимся со спинальной мышечной атрофией. Оказывается благотворительную, информационную, психологическую поддержку семьям, консультирует специалистов по вопросам заболевания и методов работы с пациентами со СМА.
Фонд помощи хосписам «Вера». Благотворительная и консультативная помощь семьям с неизлечимо больными детьми, неизлечимо больным взрослым.
ОДКБ № 1 Отделение паллиативной помощи детям, Екатеринбург, Свердловская область. Оказывается медицинскую, информационную, социальную и психологическую помощь семьям, воспитывающим ребенка-инвалида с паллиативным состоянием.
«Научно-исследовательский клинический институт педиатрии имени академика Ю.Е. Вельтищева» ФГБОУ ВО РНИМУ им.Н.И.Пирогова. Институт находится в Москве. Обращаться за медицинской помощью детям со СМА и другими нервно-мышечными заболеваниями могут жители всей России.
Клиника «Чайка». Консультации врача-пульмонолога Штабницкого Василия Андреевича для детей и взрослых со СМА.
Детский хоспис «Дом с маяком» (Москва, ближнее Подмосковье). Медицинская, психологическая, правовая, социальная, благотворительная помощь семьям с неизлечимо больными детьми и молодыми взрослыми (до 25 лет).
Марфо-Мариинский медицинский центр «Милосердие» (г.Москва). Медицинская, психологическая, правовая помощь, помощь няни, мероприятия, духовная поддержка, благотворительная помощь семьям с неизлечимо больными детьми.
Более подробную информацию вы найдете на сайте благотворительного фонда «Семьи СМА» и их специального проекта о жизни со спинальной мышечной атрофией. Спецпроект предназначен тем, кто столкнулся с диагнозом СМА и хотел бы узнать все самое важное об этой болезни: к каким специалистам и куда обращаться, как ухаживать, за чем следить, о чем помнить, какая терапия существует на сегодняшний день.
Спинальные мышечные атрофии у детей
Спинальные мышечные атрофии – группа клинически и генетически гетерогенных наследственных заболеваний, вызванных прогрессирующей дегенерацией мотонейронов передних рогов спинного мозга (1). Начало заболевания варьирует от рождения до взрослого возраста. Является орфанным заболеванием (2)
Этиология и патогенез: Генетическое заболевание, при котором возможны все типы наследования (аутосомно-доминантный, аутосомно-рецессивный, Х-сцепленный). Ген SMN ответственен за развитие спинальной мышечной атрофии детского возраста с аутосомно-рецессивным типом наследования (1,6)
Название протокола: Спинальные мышечные атрофии у детей
Код(ы) по МКБ-10:
| МКБ-10 | |
| Код | Название |
| G 12 | Спинальная мышечная атрофия и родственные синдромы |
| G 12.0 | Детская спинальная мышечная атрофия, I тип (Верднига-Гоффманна) |
| G 12.1 | Другие наследственные спинальные мышечные атрофии |
| G 12.2 | Болезнь двигательного нейрона |
| G 12.8 | Другие спинальные мышечные атрофии и родственные синдромы |
| G 12.9 | Спинальная мышечная атрофия неуточненная |
Дата разработки/пересмотра протокола: 2018 год.
Сокращения, используемые в протоколе:
| АД | аутосомно-доминантный |
| АР | аутосомно-рецессивный |
| ГЭФР | гастроэзофагеальный рефлюкс |
| ЖКТ | желудочно-кишечный тракт |
| ИВЛ | инвазивная вентиляция легких |
| КТ | компьютерная томография |
| КФК | креатинфосфокиназа |
| МРТ | Магниторезонансная томография |
| НИВЛ | неинвазивная вентиляция легких |
| ПЦР | полимеразная цепная реакция |
| РКИ | рандомизированное клиническое исследование |
| СМА, SMA | спинальная мышечная атрофия |
| УЗИ | ультразвуковое исследование |
| ЭМГ | электромиография |
| MLPA | multiplex dependent probe amplification |
| SMN | сокр. от Survival Motor Neuron (ген «выживаемости мотонейрона» — англ.) |
Пользователи протокола: детские неврологи, неонатологи, педиатры, врачи общей практики, реабилитологи, детские хирурги-ортопеды, анестезиологи-реаниматологи, пульмонологи, клинические генетики.
Категория пациентов: дети.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортных или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). Результаты, которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
| GCP | Наилучшая клиническая практика. |

Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
— 800 RUB / 4500 KZT / 27 BYN — 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной

13-15 октября, Алматы, «Атакент»
600 брендов, более 150 компаний-участников из 20 стран.
Новинки рынка стоматологии. Цены от производителей
Классификация
- Спинальная амиотрофия I типа (спинальная амиотрофия раннего детского возраста, или болезнь Верднига-Гоффмана).
- Спинальная амиотрофия II типа (спинальная амитрофия детского возраста, промежуточная форма).
- Спинальная амитрофия III типа (болезнь Кугельберга-Веландера).
- Бульбоспинальная амиотрофия Кеннеди (форма взрослых).
- Дистальная.
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ (1,3,4,5-14)
Диагностические критерии
Жалобы: практические отсутствие или позднее формирование двигательных навыков.
- СМА 1 типа характеризуется дебютом ранее 6 месяцев, симптомокомплексом «вялого» ребенка, колоколообразной формой грудной клетки, выраженной гипотонией, арефлексией, фасцикуляциями языка и проблемами с дыханием. Пациенты обычно погибают до 2 лет от дыхательной недостаточности, возникающей в результате интеркурентных инфекций.
- СМА II типа характеризуется началом заболевания в возрасте от 6 мес. до 1,5 года и более медленным прогрессированием, тип наследования аутосомно-рецессивный. У больных также отмечается симптомокомплекс «вялого» ребенка, гипотония, арефлексия, фасцикуляции языка и проблемы с дыханием. Такие пациенты максимально способны самостоятельно сидеть, и у них развиваются многочисленные контрактуры крупных суставов
- СМА III типа развивается в возрасте от 1,5 лет, в большинстве случаев прогрессирует медленно, тип наследования аутосомно-рецессивный. эти пациенты могут самостоятельно ходить. Пациенты обычно имеют слабость в подвздошных, четырехглавых и аддукторных мышцах, гипотонию, гипорефлексию и фасцикуляции языка. Некоторые из пациентов этой группы со временем утрачивают способность к самостоятельному передвижению.
- СМА IV типа (бульбоспинальная амиотрофия Кеннеди, форма взрослых) проявляется в среднем на 4 десятилетии жизни со слабости бульбарных мышц (дисфагия, дизартрия) с последующим присоединением слабости проксимальных отделов конечностей, слабость мимической мускулатуры, атрофии и фасцикуляции в языке, генерализованные фасцикулякуции, крампи, постуральный тремор, сенсорная полиневропатия. Часто характерны гинекомастия, снижение половой функции, гипогонадизм, нарушение сперматогенеза, бесплодие, сахарный диабет. Тип наследования — Х-сцепленный рецессивный.
- Изменения нервно-мышечной системы: фибрилляции мышц языка, генерализованная мышечная гипотония, атрофии мышц и фасцикуллярные подергивания в мышцах спины, туловища, проксимальных (реже в дистальных) отделах верхних и нижних конечностей; гипорефлексия вплоть до арефлексии;
- Изменения костно-суставной системы: деформация грудной клетки, деформация позвоночника (кифосколиоз), контрактуры суставов, патология стоп.
- Нарушение дыхательной функции: как результат нарушения откашливания и глотания, гиповентиляции во время ночного сна, недоразвитиядеформации грудной клетки, частных инфекционных заболеваний вследствие нарушения эвакуации секреторного отделяемого из дыхательных путей.
- Дисфункция ЖКТ: нарушения глотания (в т.ч. из-за бульбарного синдрома) нарушения моторики ЖКТ, которые включают запоры, задержку эвакуации содержимого желудка и потенциально опасный для жизни гастроэзофагальный рефлюкс (ГЭФР).
- Болевой синдром: как последствие патологии опорно-двигательного аппарата, остеопении и переломов.
- Нарушение роста и гипо-/гипертрофия.
- Нарушения чувствительности: не характерно.
- Нарушения психоречевого и когнитивного развития: не характерно
- Дети, которые не могут сидеть без посторонней помощи («лежачие пациенты»);
- Дети, которые могут самостоятельно сидеть, но не могут ходить без посторонней помощи («сидячие пациенты»);
- Дети, которые могут самостоятельно ходить («ходячие пациенты»).
- Общий анализ крови и мочи: специфических изменений нет.
- Биохимический анализ крови: уровень КФК может быть нормальным или слегка повышенным. Интерпретация для оценки задержки двигательного аппарата:
- в некоторых случаях целесообразна ликворограмма — повышение количества белка на 25 % и более.
- Электромиография (ЭМГ): ритмичные потенциалы фасцикуляций с амплитудой до 300 мкВ и частотой 5-35 Гц (ритм частокола). Скорости проведения импульса по периферическим двигательным волокнам могут быть как нормальными, так и немного сниженными за счет вторичных денервационных изменений. Для детей 1 и 2 типов имеет меньшее диагностическое значение, чем для иных типов.
- УЗИ и МРТ мышц: признаки жирового замещения мышечной ткани.
- Генетические тесты – предназначены для установления диагноза СМА, прогнозирования и выбора терапевтических подходов. Отсутствие полных копий SMN1 подтверждает диагноз, информация о копиях SMN2 является важной для прогноза и выбора терапии.
- Количественная ПЦР: идентифицирует гомозиготную делецию SMN1, но не позволяет подсчитать количество копий SMN1 и SMN2.

Диагностический алгоритм:
Примечания: ЭМГ – электромиография, НМП- нервно-мышечная проводимость; КФК – креатинфосфокиназа; НМЗ- нервно-мышечные заболевания
Зависимость клинической картины СМА от количества копий генов SMN1 и SMN2.
| Тип СМА | Количество копий генов | Особенности клинической картины |
| СМА | Полное отсутствие обоих генов SMN1 и SMN2 | Летальная ситуация |
| СMA тип 0 | Нет SMN1 гена и 1 копия SMN2 гена. | Тяжелая мышечная слабость, смерть наступает до 1 месяца |
| СMA тип I | Преимущественно делеции SMN1 или несколько миссенс мутаций в SMN1; SMN2 обычно 2 копии. |
Симптомокомплекс «вялого» ребенка, смерть наступает до 2 лет. |
| СMA тип II | Мутации превращают ген SMN1 в SMN2; Копий гена SMN2 > 3 копий; Могут встречаться миссенс точечные мутации. |
Могут самостоятельно сидеть. |
| СMA тип III | Копий гена SMN2 > 3 копий; Могут встречаться миссенс точечные мутации. |
Могут самостоятельно ходить. |
| Специалист | Цель |
| Детский невролог | Клиническая диагностика заболевания, направление на генетическую и параклиническую диагностику. Разработка краткосрочного и долгосрочного плана ведения и реабилитации. Координатор мультидисициплинарной команды специалистов, мониторинг и оценка эффективности комплексного плана лечения и реабилитации. Принятие решения о назначении специфической терапии. |
| Генетик | Генетическая верификация диагноза. Медико-генетическое консультирование семьи, информирование о методах пренатальной и предимплатанционной диагностики. |
| Педиатр | Диагностика и коррекция нарушений со стороны внтуренних органов. Мониторинг физического, соматического и нутритивного статуса. |
| Пульмонолог/специалист по респираторной поддержке | Диагностика нарушений дыхательной системы, разработка и реализация плана лечения и долгосрочной курации в случае их наличия |
| Анестезиолог-реаниматолог (детский) | Диагностика нарушений дыхательной системы пациентов, нуждающихся в проведении неинвазивной вентиляции легких (НИВЛ), коррекция водно-электролитного обмена и белкового статуса на фоне дефицита массы тела тяжелой степени. |
| Гастроэнтеролог | Диагностика и коррекция нарушений пищеварительной системы, разработка и реализация плана лечения и долгосрочной курации в случае их наличия. |
| Диетолог | Решение вопросов подбора и реализации диеты |
| Ортопед | Диагностика нарушений костно-суставной системы, консервативная коррекция патологии позвоночника, суставов, стоп; хирургическая коррекция. Подбор ортезов/туторов и иных необходимых приспособлений. |
| Реабилитолог (в т.ч. специалист ЛФК) | Разработка и реализация комплексной реабилитации (в т.ч. двигательной). Обучение семьи пациента. |
| Психолог | Квалификация психологических нарушений, разработка и реализация плана лечения и долгосрочной курации в случае их наличия. Семейное психологическое консультирование |
Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований
Дифференциальная диагностика СМА и других поражений спинного мозга
| Диагноз Признак |
Боковой амиотрофический склероз | Вертеброгенная шейная миелопатия | Сирингомиелия |
| Клиника | Периферические парезы, высокие сухожильные периостальные рефлексы, фибрилляции, фасцикулляции мышц, поражение черепно-мозговых нервов (V-XII), атрофии | Периферические парезы и расстройства чувствительности в зонах иннервации шейных сегментов, доминируют симптомы ишемического поражения двигательных структур шейного утолщения | Дистальные атрофии, мышечный тонус и рефлексы снижены, болевой синдром, расстройства чувствительности диссоциированного типа, вазомоторные и трофические нарушения, дизрафический статус |
| Течение | Прогредиентное | Медленно прогрессирующее | Медленно прогрессирующее |
| Рентгенография | Без особенностей | Шейного отдела — выраженные явления остеохондроза и сужение позвоночного канала | Кифосколиоз, добавочные ребра, не заращение дужек шейных и поясничных позвонков, ассимиляция атланта с затылочной костью, базилярная импрессия |
Другие редкие формы спинальных мышечных атрофий представлены в таблице. Некоторые из них имеют единичные описания в мировой литературе, многие из которых специфичны для конкретных изолятов.
Дифференциальная диагностика проксимальных аутосомно-рецессивных СМА и других форм СМА
Самое частое из редких: что нужно знать о СМА

Во время пикета взрослых пациентов (18+) со спинально-мышечной атрофией (СМА) у здания правительства Москвы с требованием предоставить им жизненно необходимые препараты — Спинразу и Рисдиплам. 31.08.2021. Фото: Максим Стулов/Ведомости/ТАСС
Частота заболевания
СМА – одно из самых часто встречающихся заболеваний из орфанных (редких), болеет один новорожденный на 6000-10000 .
Причина СМА
СМА – наследственное заболевание, оно связано с мутациями в гене SMN1.
Чтобы болезнь проявилась, носителями мутации в этом гене должны быть оба родителя. Рецессивный ген СМА имеет примерно каждый 40-й. Вероятность рождения больного ребенка от двух носителей – 25%, с такой же вероятностью ребенок двух носителей не будет иметь генной поломки. Ещё в 50% случаев он будет носителем СМА, но сам не заболеет.
В редких случаях (менее 2%) больные дети рождаются в семьях, где носителем является только один родитель. У второго родителя мутация гена происходит при закладке яйцеклетки или сперматозоида.
Что повреждается в результате мутации
Из-за дефектного гена в организме нарушается выработка белка SMN – протеина выживаемости мотонейронов. Без этого белка мотонейроны – нервные клетки спинного мозга, отвечающие за координацию движений и мышечный тонус – отмирают, сигнал в мышцы ног, спины и отчасти рук не идёт.
Без необходимого тонуса мышцы постепенно атрофируются. Отсутствие мышц пресса и спины приводит, кроме прочего, к обширным искривлениям позвоночника, а они – к проблемам с дыханием, которые из-за слабых мышц и так есть.
Болезнь может проявляться с первых месяцев жизни или в более позднем возрасте.
От чего зависит степень тяжести болезни
Изображение с сайта bfm.my
За выработку белка SMN отвечают два гена – SMN1 и SMN2.
При этом SMN1 – основной «заказчик» данного белка, а SMN2 – дополнительный, он вырабатывает белок в количестве, недостаточном для нормальной работы организма. В случаях, когда в геноме человека SNM1 отсутствует, SNM2 начинает выполнять замещающие функции, но никогда не может полностью восполнить недостачу.
Копий SMN2 в геноме бывает до восьми. От имеющегося у человека числа копий SMN2 и зависит тяжесть состояния больного. Такой сложный механизм болезни приводит к тому, что СМА имеет несколько форм, и состояние больных – очень разное.
Какие формы СМА существуют?
Существует 4 типа СМА, различающиеся степенью тяжести и возрастом, в котором впервые проявляется заболевание.
СМА I, болезнь Верднига-Гоффмана. Самая тяжёлая форма болезни, проявляется у младенцев от 0 до 6 месяцев. Дети с этой формой с рождения имеют трудности с дыханием, сосанием и глотанием, а также не осваивают самые простые контролируемые движения – не держат голову, не сидят самостоятельно. Ранее считалось, что большинство (80%) не доживают до двух лет. Сейчас благодаря новым стратегиям ИВЛ и зондовому кормлению срок жизни можно продлить ещё на несколько месяцев.
СМА II, болезнь Дубовица. Первые проявления болезни в 7-18 месяцев. Человек с таким типом СМА может есть и сидеть, но не ходит самостоятельно. Продолжительность жизни зависит от степени поражения мышц, обеспечивающих дыхание.
СМА III, болезнь Кюгельберга-Веландер. Болезнь впервые проявляется после полутора лет. Такие больные могут стоять (испытывая боль), но не ходят. На продолжительность жизни СМА III типа, как правило, не влияет, но сильно ухудшает её качество.
СМА IV, этот тип называется ещё «взрослой СМА», поскольку болезнь проявляется обычно в возрасте после 35 лет.
Симптомы – мышечная слабость, сколиоз и тремор. Кроме того, развиваются контрактуры суставов (ограничения подвижности в суставах) и нарушения метаболизма.
Прогрессирование заболевания не очень быстрое, сначала мышечная слабость затрагивает мышцы ног, затем – рук. Обычно проблем с глотательной и дыхательной функцией у больных нет.
Большинство из больных IV типом СМА могут ходить, и лишь некоторым приходится прибегать к инвалидным коляскам.
СМА, связанные с нарушением гена SMN, в медицинской литературе называют проксимальными – они составляют 95% от всех спинальных амиотрофий. СМА, не связанных с геном SMN, довольно много, но встречаются они редко. К ним относится, например, болезнь Кеннеди. Исследования 1990-х годов показали, что болезнь Кеннеди не связана не с поломкой гена SMN1, но с другими генетическими мутациями, приводящими к нарушению усвоения белка SMN. Болезнь проявляется у людей старше 35 лет. Для СМБА характерна, в основном, слабость конечностей.
Один из видов СМА, не связанный с геном SMN, называется болезнь Кеннеди. То, что эту болезнь до сих пор иногда относятся к СМА – анахронизм. В конце 1960-х, когда было выполнено подробное описание этой атрофии, её посчитали разновидностью СМА, так как при ней поражаются те же нервы и мышцы, что и при трёх типах СМА (но в гораздо меньшей степени).
Как это лечат?
Врач-невролог паллиативного отделения Краевой детской клинической больницы № 2 Герман Момот держит в руках препарат «Спинраза» для лечения пациентов со спинальной мышечной атрофией. Россия. Владивосток. 28.05.2020. Фото: Юрий Смитюк/ТАСС
В последние годы в мире активно разрабатываются препараты против СМА, три из них уже применяются в мире, остальные находятся на разных стадиях разработки.
Спинраза – препарат, разработанный компанией Biogen, увеличивает производство белка SMN из «резервного» гена SMN2. При регулярной терапии спинраза приостанавливает развитие СМА и стабилизирует состояние больного.
Спинраза выпускается в дозировке 12 мг на 5 мл для интратекального введения (непосредственно в спинномозговую жидкость) и одобрен для всех возрастов и типов СМА без каких-либо ограничений.
В первый год необходимо будет сделать 6 инъекций: 3 дозы с 14-ти дневным интервалом, 1 дозу спустя 30 дней и далее – раз в 4 месяца. Впоследствии препарат нужно будет применять постоянно в течение всей жизни каждые 4 месяца.
Препарат следует начать применять, как только был поставлен диагноз. Эффективность и безопасность применения нусинерсена изучалась у детей в возрасте от 0 до 17 лет, опыт применения у пациентов старше 18 лет ограничен, применение препарата у пациентов старше 65 лет не изучалось.
После применения спинразы наблюдались улучшения двигательной активности у пациентов со СМА I, II и III типа. Возможные осложнения спинразы – инфекция верхних дыхательных путей, инфекции нижних дыхательных путей и запоры, возможно также развитие ателектаза, отклонения коагуляции и тромбоцитопения, включая острую тяжелую тромбоцитопению, а также развитие гломерулонефрита.
13 февраля 2019 года спинраза получила в России орфанный статус. 16 августа 2019 года препарат был официально зарегистрирован в России.
3 августа 2020 комиссия Минздрава рекомендовала правительству включить препарат для лечения спинальной мышечной атрофии в перечень жизненно необходимых и важнейших лекарственных препаратов на следующий год. Однако по состоянию на сентябрь переговоры по возмещению за счет средств федерального бюджета на 2021 год не завершены.
Есть прецеденты выигранных судов, когда суд обязал региональные власти обеспечить пациентов спинразой за счёт региональных бюджетов.
Стоимость препарата – около 8 миллионов рублей за одну инъекцию.
Золгенсма (Zolgensma) — первый препарат генной терапии, разработанный для лечения спинальной мышечной атрофии (СМА). Предназначен для устранения генетической причины СМА путем замены дефектного или отсутствующего гена SMN1 для остановки прогрессирования заболевания. Препарат доставляет полностью функциональную копию гена SMN в организм человека. Препарат разработан компанией Авексис для однократного применения (одна инъекция на всю жизнь).
В настоящее время препарат одобрен в США для больных СМА возрастом до 2 лет, включая тех, кто не имеет симптомов при постановке диагноза. В Европе препарат получают больные СМА I типа с количеством копий SMN2 не более 3 копий, ограничения по весу 21 кг. Препарат вводится однократно внутривенно, доза определяется с учётом массы тела ребёнка.
Наиболее эффективно применение препарата до появления первых симптомов заболевания у детей, у которых наличие СМА установлено по результатам скрининга. Исследования о применении препарата у детей более позднего возраста, уже имеющих симптомы СМА, продолжаются.
Наиболее частыми нежелательными реакциями на фоне применения Золгенсма были повышение активности печёночных ферментов и рвота. В инструкции по применению препарата имеется предупреждение о риске развития тяжёлого острого поражения печени.
В середине июля 2020 года компания «Новартис» подала в Министерство здравоохранения РФ досье на регистрацию препарата к применению в России. По существующей процедуре, процесс регистрации может занять до полугода.
В настоящее время компанией-производителем объявлена программа сострадательного применения (до официальной регистрации препарата), по которому 100 доз препарата будут распространены между ста пациентами со СМА любого типа до двух лет методом лотереи. В России по этой программе препарат получили 4 ребёнка.
Кроме того, за счёт средств благотворителей препарат получили 16 российских детей, ещё двое принимают участие в программе клинических испытаний.
Стоимость дозы препарата составляет около 152 миллионов рублей (самый дорогой препарат в мире).
Рисдиплам (RG7916) («Эврисди») – препарат компании Roche, является модификатором сплайсинга (генетической модификации) гена SMN2, увеличивающим экспрессию полноразмерных функциональных белков. В отличие от других препаратов, применяется перорально.
Исследования проводились с участием пациентов от 0 до 60 лет со СМА II и III типов. Улучшает моторную функцию пациентов. Противопоказаний на сегодняшний день не зарегистрировано.
18 марта 2020 года компания «Рош» подала заявку на рассмотрение для дальнейшей регистрации препарата в Министерство здравоохранения РФ.
Кроме того, в мире идут клинические испытания ещё нескольких препаратов – бранаплам, релдесемтив, SRK-015 и других.
По мнению врачей комбинация препаратов при лечении СМА возможна, но её целесообразность должна рассматриваться в каждом случае индивидуально.
Можно ли помочь больным СМА и как именно?

Фото с сайта f-sma.ru
Вылечить болезнь пока нельзя, но можно облегчать состояние больных СМА, то есть различными способами компенсировать проявления болезни.
При тяжёлых типах СМА больным приходится помогать дышать и глотать. Поэтому им жизненно необходимы мобильные аппараты ИВЛ, аспираторы-откашливатели, мешки Амбу.
Ещё детям со СМА очень нужна помощь волонтёров, способных хоть на короткое время подменить родителей.
Детям, больным СМА, помощь может понадобиться в любой момент, поэтому мамы и папы всегда начеку и сами осваивают навыки реанимации, необходимые на случай, если ребенок внезапно перестал дышать.
Менее тяжёлым больным нужны лекарства, облегчающие дыхание, корсеты, коляски и другие приспособления, облегчающие перемещение и жизнь людей со слабыми мышцами.
Болезнь, продолжающаяся много лет, выматывает, поэтому пациентам, особенно взрослым, часто необходима помощь психолога.
Благотворительный фонд «Семьи СМА» помогает детям и взрослым со спинальной мышечной атрофией и другими нервно-мышечными заболеваниями и их семьям.
Фонд работает по всей территории России. Работа фонда имеет два основных направления – оказание помощи самим больным СМА и их близким и работа на системные изменения ситуации со СМА в России.
Вы можете поддержать деятельность фонда, сделав пожертвование любым удобным для вас способом. Помочь можно, оформив разовое или регулярное пожертвование на специальной странице фонда или отправив на короткий номер 3443 смс со словом СМА и, через пробел, суммой пожертвования – например, СМА 300.
Можно ли заболеть СМА из-за прививок?
В Европе и США связь между прививками и проявлением болезни не прослежена.
Понять, есть ли связь между СМА и прививками, может объяснение разницы между СМА и полиомиелитом. Полиомиелит – инфекционное заболевание, когда от инфекции повреждается организм изначально здорового ребёнка. Ребёнок со СМА, родившийся с повреждённым геномом, внешне может выглядеть здоровым, но на самом деле он уже болен, просто симптомы его болезни проявляются постепенно. В этом отношении СМА – такая же «отложенная» болезнь как, например, миодистрофия Дюшенна или синдром Ретта, когда ребёнок, некоторое время развивавшийся в соответствии с нормой, теряет приобретённые ранее навыки и становится инвалидом.
Большинство проявлений СМА связаны с освоением первых двигательных навыков. Первые проявления болезни совпадают по времени с несколькими возрастными прививками. В итоге человек и его родные могут утверждать, что он «заболел от прививки», но на самом деле у него просто проявились признаки болезни, которая уже была.
Как определяют, что у ребенка именно СМА, а не какая-то другая болезнь?
Несмотря на то, что впервые СМА была описана австрийским неврологом Гвидо Верднигом и немецким неврологом Джоханном Хоффманном ещё в начале 1890-х годов, полностью понять природу заболевания удалось только в конце XX века. Ген SMN1 был открыт в 1995 году. Чтоб подтвердить диагноз СМА, нужен генетический тест.
В России соответствующие генетические тесты стали доступны в начале 2000-х годов. Генетический тест на СМА возможно сделать по ОМС, однако на практике не слишком много врачей знают этот редкий диагноз и направляют больных на соответствующее исследование. Стоимость такого тестирования в коммерческих лабораториях Москвы – порядка 6 тысяч рублей.
Отсутствие специальной диагностики привело также к путанице в диагнозах. Большинство больных СМА в России не выявлены, у многих выявленных в качестве диагноза записана «болезнь Верднига-Гоффмана», хотя не у всех из них (особенно взрослых) в действительности именно этот тип болезни.
Сколько больных СМА в России?
С учётом частоты заболевания, количество больных СМА в России должно составлять от семи до двадцати четырёх тысяч человек. На сегодняшний день в реестре пациентов фонда «Семьи СМА» находится около 400 человек.
Кто в России помогает людям со СМА и их семьям
Благотворительный фонд «Вера», детский хоспис «Дом с маяком», благотворительный фонд «Детский паллиатив», благотворительный фонд «Семьи СМА», детская паллиативная служба «Милосердие».
С 2014 года в Москве развивается совместный проект службы «Милосердие» и фонда «Семьи СМА» «Клиники СМА» На встречах, которые проходят раз в месяц, больные могут получить консультации пульмонолога, ортопеда, физиотерапевта и психолога. В последнее время часть встреч ориентированы и на нужды взрослых пациентов.
Известные люди со СМА

Певица Юлия Самойлова во время V благотворительного баскетбольного матча, организованного фондом «Шаг вместе», во Дворце спорта «Динамо» в Крылатском. 13.05.2017. Фото: Валерий Шарифулин/ТАСС
Итальянка Симона Спиноглио родилась с наследственным заболеванием – спинальной мышечной атрофией 2 типа. Она с самого рождения не может ходить и передвигается только с помощью электрической коляски. Но ее жизнь полна и насыщенна; ничто не может помешать ее стремлению жить.
Симона работает на «горячей линии» итальянской Ассоциации «Семьи СМА» (Famiglies of SMA) и помогает детям и взрослым со СМА и другими нервно-мышечными заболеваниями.
Также Симона записала несколько популярных в итальянском сообществе СМА песен – о свободе делать то, что ты хочешь, несмотря на болезнь.
Российская певица Юлия Самойлова родилась в городе Ухта (Республика Коми) В возрасте десять лет выступила на благотворительном концерте, после чего была приглашена заниматься пением в местный Дворец пионеров. В пятнадцати лет начала заниматься в городском Доме культуры.
В 2008 году собрала собственную музыкальную группу (распалась в 2010). В 2013 году приняла участие в конкурсе «Фактор А» на телеканале «Россия». Заняла второе место и получила персональную премию Аллы Пугачёвой «Золотая звезда Аллы». В 2017 году из-за недопуска России в конкурсную программу не смогла принять участие в конкурсе «Евровидение». Передвигается на коляске.
Программист из Владимира Валерий Спиридонов. Окончил школу с золотой медалью, затем защитил диплом инженера. В 2015 году Валерий планировал стать участником эксперимента итальянского хирурга Серджио Канаверо по пересадке головы человека (эксперимент был отменен).
Сегодня Валерий – член городской общественной палаты Владимира, эксперт по вопросам доступной среды, а также создатель собственного сообщества «Desire for life», рассказывающего о создании доступной среды и перспективных медицинских проектах. Валерий – участник многих телепрограмм на российском и зарубежном ТВ.
Полезные ресурсы про СМА
Сайт фонда «Семьи СМА» Фонд публикует информацию о болезни и свежие новости о лечении СМА в России. Много новостей выходит на странице фонда в ФБ.
Благодарим за предоставленную информацию фонд «Семьи СМА» и лично Ирину Старову-Кислину.
Мы просим подписаться на небольшой, но регулярный платеж в пользу нашего сайта. Милосердие.ru работает благодаря добровольным пожертвованиям наших читателей. На командировки, съемки, зарплаты редакторов, журналистов и техническую поддержку сайта нужны средства.
Спинальные амиотрофии ( Спинальные мышечные атрофии )
Спинальные амиотрофии — это генетические заболевания, проявляющиеся мышечной атрофией и обусловленные дегенеративными изменениями спинальных мотонейронов и моторных ядер ствола головного мозга. Общим симптомокомплексом выступают симметричные вялые параличи с атрофиями мышц и фасцикуляциями на фоне интактной чувствительной сферы. Диагностируются спинальные амиотрофии по данным семейного анамнеза, неврологического статуса, ЭФИ нервно-мышечного аппарата, МРТ позвоночника, ДНК-анализа и морфологического исследования мышечного биоптата. Лечение малоэффективно. Прогноз зависит от формы спинальной мышечной атрофии и возраста ее дебюта.

Общие сведения
Спинальные амиотрофии (спинальные мышечные атрофии, СМА) — наследственно обусловленные заболевания, в основе которых лежит дегенерация мотонейронов спинного мозга и ствола головного мозга. Описаны в конце XIX века. Их частота составляет 1 случай на 6-10 тыс. новорожденных. Около 85% спинальных мышечных атрофий составляют проксимальные формы с более выраженной слабостью и атрофиями проксимальных мышечных групп конечностей. На долю дистальных форм приходится лишь 10% СМА. На сегодняшний день спинальные амиотрофии представляют практический интерес для целого ряда дисциплин: детской и взрослой неврологии, педиатрии, генетики.

Причины
Благодаря современной генетике установлено, что возникающие дегенеративные процессы двигательных нейронов обусловлены мутациями в генах SMN, NAIP, H4F5, ВTF2p44, расположенных на 5-ой хромосоме в локусе 5q13. Несмотря на то, что спинальные амиотрофии детерминируются аберрациями одного хромосомного локуса, они представляют собой группу разнородных нозологий, одни из которых проявляются в младенческом возрасте, а другие манифестируют у взрослых. В большинстве случаев амиотрофии наследуются аутосомно-рецессивно.
Патогенез
Генетические мутации приводят к развитию дегенеративных изменений в передних рогах спинного мозга. Нарушается иннервация и нейротрофика поперечно-полосатой мускулатуры. В результате постепенно возникает атрофия мышечной ткани. Преимущественное поражение отдельных групп мышц (проксимальных или дистальных частей верхних или нижних конечностей) у различных форм спинальных амиотрофий отличается. Характерно отсутствие нарушений чувствительности.
Классификация
Общепринятым считается разделение спинальных мышечных атрофий на детские и взрослые. Детские СМА классифицируются на ранние (дебютирующие в первые месяцы жизни), более поздние и ювенильные. Детские спинальные амиотрофии представлены:
- амиотрофией Верднига-Гоффманна;
- ювенильной формой Кугельберга-Веландера;
- хронической инфантильной СМА;
- синдромом Виалетто-ван Лэре (бульбоспинальная форма с глухотой);
- синдромом Фацио-Лонде.
Взрослые формы СМА манифестируют в возрасте от 16 до 60 лет и отличаются более доброкачественным клиническим течением. К СМА взрослого возраста относятся:
- бульбоспинальная амиотрофия Кеннеди;
- скапулоперонеальная;
- лицелопаточноплечевая и окулофарингеальная формы;
- дистальная СМА;
- мономелическая СМА.
Выделяют также изолированные и сочетанные спинальные амиотрофии. Изолированные СМА характеризуются преобладанием поражения спинальных мотонейронов, которое во многих случаях является единственным проявлением заболевания. Сочетанные спинальные амиотрофии представляют собой редкие клинические формы, при которых симптомокомплекс амиотрофии комбинируется с другой неврологической или соматической патологией. Описаны сочетания СМА с врожденными пороками сердца, глухотой, олигофренией, понтоцеребеллярной гипоплазией, врожденными переломами.
Симптомы спинальных амиотрофий
Общим для спинальных мышечных атрофий является симптомокомплекс симметричного вялого периферического паралича: слабость, атрофия и гипотония мышечных групп одноименных конечностей (чаще вначале обеих ног, а затем и рук) и туловища. Пирамидные нарушения не типичны, но могут развиваться на поздних стадиях. Расстройства чувствительности отсутствуют, функция тазовых органов сохранена. Обращает внимание более выраженное поражение проксимальных (при проксимальных СМА) или дистальных (при дистальных СМА) мышечных групп. Типично наличие фасцикулярных подергиваний и фибрилляций.
Болезнь Верднига-Гоффмана
Встречается в 3-х клинических вариантах. Врожденный вариант дебютирует в первые 6 мес. жизни и является наиболее злокачественным. Его симптомы могут проявляться еще во внутриутробном периоде слабым шевелением плода. Дети с рождения имеют мышечную гипотонию, не способны переворачиваться и держать голову, при более позднем дебюте — не могут сидеть. Патогномонична поза лягушки — ребенок лежит с разведенными в стороны и согнутыми в коленях и локтях конечностями.
Амиотрофии имеют восходящий характер — вначале возникают в ногах, затем вовлекаются руки, позже — дыхательная мускулатура, мышцы глотки и гортани. Сопровождается задержкой психического развития. К 1,5 годам наступает смертельный исход.
Ранняя спинальная амиотрофия манифестирует до 1,5 лет зачастую после инфекционного заболевания. Ребенок утрачивает двигательные способности, не может стоять и даже сидеть. Периферические парезы сочетаются с контрактурами. После вовлечения дыхательных мышц развивается дыхательная недостаточность и застойная пневмония. Летальный исход обычно происходит в возрасте до 5-ти лет. Поздний вариант дебютирует после 1,5 лет, отличается сохранением двигательной способности до 10-летнего возраста. Летальный исход наступает к 15-18 годам.
Ювенильная спинальная амиотрофия Кугельберга-Веландера
Характеризуется дебютом в период от 2 до 15 лет. Начинается с поражения проксимальных мышц ног и тазового пояса, затем захватывает плечевой пояс. Около четверти пациентов имеют псевдогипертрофии, что делает клинику сходной с проявлениями мышечной дистрофии Беккера. В плане дифдиагностики большое значение имеет наличие мышечных фасцикуляций и данные ЭМГ. Течение амиотрофии Кугельберга-Веландера доброкачественное без костных деформаций, в течение ряда лет пациенты остаются способными к самообслуживанию.
Бульбоспинальная амиотрофия Кеннеди
Наследуется рецессивно сцеплено с Х-хромосомой, манифестирует только у мужчин после 30-летнего возраста. Типично медленное, относительно доброкачественное течение. Дебютирует с амиотрофии проксимальных мышц ног. Бульбарные расстройства появляются через 10-20 лет и благодаря медленному прогрессированию не вызывают нарушения витальных функций. Может наблюдаться тремор головы и рук. Патогномоничным симптомом выступают фасцикулярные подергивания в периоральных мышцах. Зачастую отмечается эндокринная патология: атрофия яичек, снижение либидо, гинекомастия, сахарный диабет.
Дистальная СМА Дюшенна-Арана
Может иметь как рецессивный, так и доминантный тип наследования. Дебют приходится чаще на 20-летний возраст, но может произойти в любой период до 50 лет. Амиотрофии начинаются в кистях рук и приводят к формированию «когтистой кисти», затем охватывают предплечье и плечо, в связи с чем рука приобретает вид «руки скелета». Парезы мышц голеней, бедер и туловища присоединяются гораздо позже. Описаны случаи манифестации заболевания монопарезом (поражением одной руки). Прогноз благоприятный, за исключением случаев сочетания данного вида СМА с торсионной дистонией и паркинсонизмом.
Скапуло-перонеальная СМА Вюльпиана
Манифестирует в период от 20 до 40 лет амиотрофиями плечевого пояса. Типичны «крыловидные лопатки». Затем присоединяется поражение перонеальной группы мышц (разгибатели стопы и голени). В ряде случаев вначале поражаются перонеальные мышцы, а затем плечевой пояс. Спинальная амиотрофия Вюльпиана отличается медленным течением с сохранностью способности передвигаться спустя 30-40 лет от ее дебюта.
Осложнения
К наиболее частым неблагоприятным последствиям можно отнести постоянные падения и ассоциированные с ними патологические переломы, что связано с постепенно нарастающей мышечной атрофией мышц нижних конечностей. При бульбоспинальной амиотрофии Кеннеди нередко наблюдаются осложнения со стороны эндокринной и репродуктивной систем – эректильная дисфункция, первичное бесплодие, сахарный диабет.
Более тяжелые состояния встречаются реже, в основном при болезни Верднига-Гоффмана или на поздних стадиях других амиотрофий. Вследствие выраженной атрофии мышц глотки и дыхательной мускулатуры пища попадает в дыхательные пути (аспирация), развивается дыхательная недостаточность. Возможны грубые костно-суставные деформации, утрата способности к ходьбе и самообслуживанию. В единичных случаях обнаруживается рак грудной железы.
Диагностика
Больных со спинальными амиотрофиями курируют врачи-неврологи, а при манифестации в детском возрасте – педиатры или неонатологи. При необходимости может потребоваться привлечение для консультации других специалистов – эндокринологов и генетиков. Для диагностики некоторых разновидностей амиотрофий большое значение имеют анамнестические данные, а именно возраст появления симптоматики (например, болезнь Верднига-Гоффмана всегда дебютирует у детей до 6 месяцев, а амиотрофия Кугельберга-Веландера – после 2 лет).
Во время осмотра пациента обращается внимание на снижение общего мышечного тонуса, ослабление или утрату сухожильных рефлексов, скелетно-мышечные деформации. У части больных отмечается псевдогипертрофия икроножных мышц. Чтобы подтвердить или исключить диагноз назначается следующее дополнительное обследование:
- Лабораторные исследования. В лабораторных анализах практически все показатели находятся в пределах нормальных значений. Исключение составляет концентрация креатинфосфокиназы, которая у небольшой части пациентов может быть высокой.
- ЭМГ. При проведении игольчатой электромиографии обнаруживаются признаки дегенерации двигательных спинномозговых нейронов – снижение скорости и амплитуды вызванных потенциалов действия, регистрация спонтанной биоэлектрической активности в покое (фасцикуляций, фибрилляций), «ритм частокола».
- Биопсия мышц. При гистологическом исследовании мышечной ткани отмечаются типичные для амиотрофии изменения: некроз миофибрилл, разрастание жировой и соединительной ткани, чередование атрофии и гипертрофии в сочетании с интактными участками мышечной ткани.
- Спирометрия. При поражении дыхательной мускулатуры во время выполнения функции внешнего дыхания выявляются рестриктивные нарушения в виде снижения жизненной емкости легких.
- Генетический анализ. Основной метод диагностики, позволяющий достоверно установить диагноз спинальной амиотрофии. С помощью полимеразной цепной реакции обнаруживаются генетические мутации.
Дифференциальная диагностика
Дифференциальный диагноз спинальных амиотрофий необходимо проводить с другими наследственными нейродегенеративными заболеваниями, поражающими мышечную ткань. К таким патологиям можно отнести:
- псевдогипертрофическую мышечную дистрофию Дюшенна;
- ювенильный боковой амиотрофический склероз;
- детский церебральный паралич.
Лечение спинальных амиотрофий
Немедикаментозная терапия
Все без исключения больные должны быть госпитализированы в стационар. В тяжелых ситуациях (например, при дыхательной недостаточности вследствие слабости дыхательных мышц) пациентов переводят в отделение реанимации и интенсивной терапии и подключают к аппарату ИВЛ. Все мероприятия направлены на облегчение состояния пациента. Несмотря на это, комплексный подход и строгое соблюдение рекомендаций врачей позволяют улучшить качество жизни больного. Виды консервативной терапии, применяющиеся для терапии спинальных амиотрофий:
- Обеспечение питания. При значительном нарушении акта глотания особое внимание уделяется вопросу кормления. Консистенция пищи должна быть полутвердой, положение пациента вертикальным. Может понадобиться установка назогастрального зонда.
- ЛФК. С целью повышения тонуса мышц и замедления их атрофии рекомендуются регулярные физические нагрузки. Наиболее эффективно совмещение активных (выполняются специалистом) и пассивных упражнений (выполняются самим пациентом).
- Физиолечение. Для активации метаболизма в мышечных тканях назначаются сеансы электростимуляции модулированным током, грязевые аппликации, электрофорез.
- Массаж. Для улучшения кровообращения и лимфооттока в мышцах выполняются различные виды массажа – ручной (стимулирующий, расслабляющий) и аппаратный (вибромассаж).
- Ортопедическое лечение. Для предупреждения и коррекции костных деформаций и суставных контрактур рекомендуется использование ортопедических приспособлений: корсетов, ортезов, ортопедической обуви.
- Респираторная поддержка. Нередко возникает необходимость в устранении кислородной недостаточности. В зависимости от тяжести состояния больного назначаются ингаляции кислорода через лицевую маску/назальную канюлю или неинвазивная вентиляция легких через портативные аппараты ИВЛ.
Для достижения максимального эффекта лечение должно проводиться непрерывно и подбираться индивидуально для конкретного пациента.
Медикаментозная терапия
Этиотропная терапия с доказанной эффективностью на сегодняшний день отсутствует. Лекарственные препараты, применяющие для лечения спинальных амиотрофий, следующие:
- Метаболические средства. Для улучшения обменных процессов в мотонейронах и мышечных тканях применяются препараты, стимулирующие функцию митохондрий (коэнзим Q10, янтарная кислота), ноотропы (пирацетам, гамма-аминомасляная кислота), L-карнитин.
- Вальпроаты и Кленбутерол. Исследования показали, что противоэпилептические препараты из группы производных вальпроевой кислоты и агонист бета-адренергических рецепторов Кленбутерол способны увеличивать образование белка выживаемости мотонейронов (SMN) и, соответственно, улучшать клиническое течение заболевания.
- ИПП и прокинетики. Пациентам с гастроэзофагальным рефлюксом, который нередко развивается при нарушении глотания, назначаются ингибиторы протонной помпы (эзомепразол) и средства, стимулирующие моторику желудочно-кишечного тракта (итоприд).
- Муколитики и отхаркивающие средства. У больных со слабостью дыхательной мускулатуры для устранения таких проблем как слабое отхаркивание и скопление в дыхательных путях густой мокроты применяются препараты, разжижающие мокроту (ацетилцисетин) и стимулирующие ее отхаркивание (терпингидрат).
- Гормональные препараты. Людям с возникшими эндокринологическими осложнениями показаны инсулин, сахароснижающие препараты (метформин), тестостерон и антиандрогены (дутастерид).
Хирургическое лечение
При развитии грубых деформаций грудной клетки и позвоночника или крайне выраженных контрактур суставов показаны ортопедические операции. Лежачим больным, страдающим постоянно рецидивирующими пневмониями, выполняется трахеостомия. При гастроэзофагеальном рефлюксе, резистентном к медикаментозному лечению, прибегают к лапароскопической фундопликации Ниссена.
Экспериментальное лечение
Постоянно ведутся многочисленные исследовательские работы по разработке лекарственных средств, способных остановить или хотя бы замедлить процесс нейродегенерации. Значительные успехи достигнуты в области генной терапии. Уже используются в клинической практике препараты, корректирующие дефекты матричной РНК гена SMN – Спинраза и Рисдиплам. В конце 2019 года был зарегистрирован и одобрен к клиническому применению препарат Золгенсма, который содержит функционально полноценный ген SMN1.
Прогноз
Прогноз всецело зависит от клинического варианта СМА и возраста ее манифестации. Наиболее неблагоприятный прогноз имеют детские спинальные амиотрофии, при начале в младенческом возрасте они зачастую приводят к летальному исходу в течение первых 2-х лет жизни ребенка. Спинальные амиотрофии взрослого возраста отличаются способностью больных самостоятельно обслуживать себя в течение многих лет, а при медленном прогрессировании имеют благоприятный прогноз не только для жизни, но и для трудоспособности пациентов (при создании для них оптимальных условий труда).
Профилактика
Специфических методов первичной профилактики не существует. Единственный способ предотвратить возникновение болезни – пренатальная диагностика (обнаружение мутаций в ворсинах хориона или амниотической жидкости) с прерыванием беременности. Предупредить развитие осложнений и максимально сохранить работоспособность позволяет своевременное начало комплексной терапии.
Спинальная мышечная атрофия (СМА) у детей, диагностика, лечение, перспективы
Спинальная мышечная атрофия (СМА) — это генетическое заболевание, которое вызывает мышечную слабость и атрофию (когда мышцы становятся меньше).

СМА может повлиять на способность ребенка ползать, ходить, сидеть и контролировать движения головы. Тяжелая СМА может повредить мышцы, используемые для дыхания и глотания.
Существует четыре типа СМА. Некоторые появляются раньше и более суровы, чем другие. Все виды СМА нуждаются в постоянном лечении бригадой медицинской помощи. Лекарства от СМА нет, но лечение может помочь детям с СМА жить лучше.
Что происходит в СМА?
В СМА нервы, которые контролируют мышечную силу и движение, разрушаются. Эти нервы (называемые двигательными нейронами) находятся в спинном мозге и нижней части головного мозга. Они не могут посылать сигналы от мозга к мышцам, чтобы заставить их двигаться. Поскольку мышцы не двигаются, они становятся меньше (или атрофируются).
Что вызывает СМА?
Большинство видов СМА вызваны проблемой с геном, называемым геном SMN1. Этот ген не производит достаточного количества белка, необходимого для нормальной работы двигательных нейронов. Двигательные нейроны разрушаются и не могут посылать сигналы мышцам.
Ребенок с СМА получает по одной копии гена SMN1 от каждого родителя. Ребенок, получивший ген SMN1 только от одного родителя, вероятно, не проявит никаких признаков СМА, но может передать этот ген своим детям.
Генетическое тестирование людей с СМА и их родителей может помочь определить, насколько вероятно, что у кого-то будет ребенок с СМА.
Каковы признаки и симптомы СМА?
Признаки СМА могут варьироваться. Некоторые дети с СМА не учатся переворачиваться или сидеть в ожидаемом возрасте. Ребенок постарше может падать чаще, чем дети того же возраста, или ему трудно поднимать вещи.
У детей с СМА может развиться сколиоз (искривление позвоночника), если мышцы спины слабы. Если СМА тяжелая, ребенок может быть не в состоянии стоять или ходить, и ему может понадобиться помощь, чтобы поесть и дышать.
Каковы типы СМА?
Четыре типа СМА классифицируются в зависимости от тяжести заболевания и возраста, когда начинаются симптомы:
- Тип I, иногда называемый инфантильным началом СМА или болезнью Верднига-Хоффмана. Тип I начинает поражать младенцев с рождения до 6 месяцев, причем у большинства детей признаки заболевания проявляются к 3 месяцам. Это самая тяжелая форма СМА.
- Тип II начинает поражать детей в возрасте от 7 до 18 месяцев. Дети могут самостоятельно сидеть, но не могут ходить. Эта форма может быть от умеренной до более тяжелой.
- Тип III, также называемый синдромом Кугельберга-Веландера или ювенильным СМА, начинает поражать детей уже в возрасте 18 месяцев или в подростковом возрасте. Дети могут ходить самостоятельно, но у них слабость в руках и ногах, и они могут часто падать. Это самая легкая форма СМА у детей.
- Тип IV — это взрослая форма СМА. Симптомы обычно начинаются после 35 лет и постепенно ухудшаются с течением времени. Поскольку он развивается медленно, многие люди с СМА IV типа не знают, что он у них есть, пока не пройдут годы после появления симптомов.
Как диагностируется СМА?
Когда они думают, что у ребенка может быть СМА, врачи могут заказать:
- генетическое тестирование: Это наиболее распространенный способ тестирования на SMA. Тестирование проверяет наличие делеции или вариации в гене SMN1.
- биопсия мышц: Это когда врачи берут небольшой образец мышц, чтобы проверить его под микроскопом.
Как лечится СМА?
Хотя нет лекарства от СМА, эти методы лечения могут помочь детям, у которых он есть:
- Nusinersen (или Spinraza ™ ), новое лечение СМА, которое было одобрено в 2016 году. Это лекарство увеличивает количество белка, необходимого организму из отсутствующего гена SMN1. Он работает, заставляя «резервный» ген, ген SMN2, больше походить на ген SMN1 и производить необходимый белок. Это делается через спинномозговую пункцию. Четыре дозы вводятся в течение 2 месяцев, а затем каждые 4 месяца после этого. Исследования показали значительное улучшение дыхания, двигательных функций и выживаемости.
- испытания генной терапии. Они продолжаются и показали многообещающие результаты в улучшении общей функции в СМА.
- поддержка дыхания через маску/мундштук или дыхательный аппарат. Если требуется дыхательный аппарат, в дыхательное горло может быть помещена трубка (так называемая трахеостома).
- процедуры, помогающие детям кашлять и очищать слизь, которые могут помочь предотвратить инфекции
- правильное питание. Иногда питательная трубка помещается через нос в желудок (трубка NG) или непосредственно в желудок (называемая гастростомической трубкой или G-трубкой). Таким образом, кормление может идти прямо в желудок.
- препараты
- шина, скоба или иногда хирургическое вмешательство при сколиозе
- физиотерапия и трудотерапия
- консультации и группы поддержки
Заглядывая вперед
Исследования показывают, что дети с СМА лучше всего справляются с командным подходом к их уходу. Родители, врачи, медсестры, терапевты, консультанты и диетолог — все они являются важными членами команды. Этот подход и последние достижения в области медицины улучшили перспективы для детей с СМА.